去除黄曲霉毒素的菌种筛选及其去除特性研究
2018-08-15段素云刘耀华艾君涛杨新建
段素云, 孙 健, 刘耀华,艾君涛,杨新建*
(1.北京农业职业学院,北京房山 102442;2.中国农业大学出版社,北京海淀 100094)
2013—2017年,我国每年花生产量为1700万吨左右,约占全球花生总产量的40%。花生粕是脱壳花生经压榨或浸提取油后的副产物。其营养丰富,粗蛋白质含量为44%~47%;多糖含量高达32.5%;胆固醇含量低,可消化率高,更容易被动物或人体消化吸收 (张姣勤等,2008;梅娜,2007), 并含有 Mg、K、Ca、Fe、Na、Zn、P、Cu、Mn等多种矿质元素及具有抗衰老、抗癌功效的黄酮类物质,同时还含有较少的抗营养因子,因此,综合营养价值高(Hwang等,2010)。目前花生粕常被用作饲料原材料以及用来开发植物源多肽(Yang等,2016),赋予花生粕新的功能特性。然而,花生或花生粕在生长、储藏和转运过程中易受到霉菌毒素的污染,特别是黄曲霉毒素,这将严重影响到花生农产品及其副产品的质量安全。如何解决花生及其副产品的霉菌毒素污染问题,已成为一个亟待解决的难题。
目前,黄曲霉毒素的去除方法主要包括物理法、化学法和生物法。物理法主要包括溶剂萃取、吸附、加热、辐射、太阳照射等,但这些方法具有工艺复杂、成本较高、耗费人力、受环境因素影响、毒素去除效果低等缺点,实际生产中己不再常见。近年来,应用较多的物理脱毒法是依靠霉菌毒素脱毒剂的吸附作用(关心,2016)。化学法主要是使用化学试剂除去毒素,使用的化学试剂主要有次氯酸钠、臭氧、过氧化氢、氢氧化钠、氨水以及氯气等。但添加的化学药品及反应的副产物会严重破坏饲料的营养成分,降低饲料的食用价值;残留的化学药品会影响饲料的色泽与气味,进而影响动物的采食量,抑制动物的生长(李俊霞,2007)。生物法主要利用的是物理吸附结合毒素(酵母、乳酸菌等)、分泌活性物质降解毒素两个途径,并且生物法不但处理条件温和,不会破坏产品品质,而且有些还能增加产品营养价值(刘睿杰等,2012)。但是目前国内外的研究多集中在利用微生物分泌活性物质降解毒素,因为微生物的物理吸附作用存在着结合可逆不稳定,毒素易重新释放,引起二次污染的问题,加之吸附效果受菌种、环境等条件限制,致使菌体吸附不是清除黄曲霉毒素的最佳选择(关心,2016)。
目前,用于生物降解的主要菌种既包括黑曲霉(李冰等,2012)、黄曲霉(Das等,2015)及假蜜环菌(刘大岭等,2003)等真菌类,又包含枯草芽孢杆菌(赵丽红等,2014)、红色黏球菌(王宁等,2009)及红球菌(Eshelli等,2015)等细菌类。 然而,上述菌种之间降解黄曲霉毒素的效果差异较大,同时部分菌株仍然以吸附作用结合毒素,无法达到理想的去除效果。鉴于此,本研究以香豆素为唯一碳源和能源,对待选菌株进行初筛,进一步通过与黄曲霉毒素(AFB1)共培养方式,复筛获得高效去除黄曲霉毒素的菌株,然后在含有黄曲霉毒素的花生粕培养基中验证,并对高效菌株去除黄曲霉毒素的特性进行初步研究,为分离纯化具有去除黄曲霉毒素的物质和探索其降解机制奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 候选菌种 芽孢杆菌(枯草芽孢杆菌、地衣芽孢杆菌),霉菌(黑曲霉、米曲霉),酵母(产朊假丝酵母、酿酒酵母),乳酸菌(植物乳酸杆菌、嗜酸乳杆菌),均由中国农业科学院饲料研究所基因工程研究室保存提供。
1.1.2 花生粕 花生粕购自山东鲁花集团有限公司,粉碎过40目筛备用。
1.1.3 培养基
1.1.3.1 菌种活化培养基 霉菌、酵母培养基:马铃薯培养基(PDA),芽孢杆菌培养基:LB固体培养基,乳酸菌培养基:MRS固体培养基。
1.1.3.2 扩大培养基 活化培养基(液体)。
1.1.3.3 筛选培养基 初筛无机盐培养基:改良Hormisch 筛 选培 养基 ,KH2PO40.25 g,MgSO4·7H2O 0.25 g,KNO30.5 g, (NH4)2SO40.5 g,Ca-Cl2·2H2O 0.005 g,FeCl3·6H2O 0.003 g,pH 7.0;H2O 1000 mL,121℃高压灭菌20 min后加入1 g香豆素。固体培养基加入1.5%琼脂粉,用于AFB1降解菌株的初步筛选。
复筛培养基:相应菌种活化培养基。
固体发酵培养基:灭菌后的基质(90%花生粕和10%麸皮)和水按 1∶1(m/m)的比例混合,自然 pH。
1.1.4 试剂 黄曲霉毒素B1、香豆素,购自北京百 灵 威 科 技 有 限 公 司 ;KH2PO4、MgSO4·7H2O、KNO3、(NH4)2SO4、CaCl2·2H2O、FeCl3·6H2O 均为分析纯。
1.1.5 设备 离心机(3H16RI),湖南赫西仪器设备有限公司;酶标仪(DNM-9602),北京普朗新技术有限公司;均质器(SCIENTZ-09),宁波新芝生物科技股份有限公司。
1.2 试验方法
1.2.1 菌种活化与扩培
1.2.1.1 芽孢杆菌 保藏菌种划线 (或涂布)LB固体平板,37℃倒置培养18 h后,挑取单菌落或刮取一环接入20 mL液体种子培养基的50 mL三角瓶中,在37℃,150 r/min条件下,培养24 h;然后50 mL三角瓶装液20 mL,接种量0.1 mL,37℃,150 r/min摇床培养8~10 h备用。
1.2.1.2 霉菌 保藏的斜面菌种转接于PDA斜面培养基上,30℃恒温箱中培养3 d,长满大量黑色(黑曲霉)或黄绿色(米曲霉)孢子,即为活化的斜面种子。用无菌移液管吸取5 mL无菌水加至斜面上,用接种环轻轻刮下孢子,装入含有玻璃珠的三角瓶中,盖好塞子振荡数分钟,即可用作液体种子。血球计数板计数孢子悬液的浓度。
1.2.1.3 酵母菌活化 保藏菌种划线PDA固体平板,30℃恒温箱中培养24 h,再挑单菌落于液体PDA培养基中,置于30℃,转速为150 r/min的恒温振荡器上培养扩陪15~20 h,然后50 mL三角瓶装液20 mL,接种量0.1 mL,30℃,150 r/min摇床培养12~14 h备用。
1.2.1.4 乳酸菌活化 保藏菌种划线MRS固体平板,静置2 min,然后上面再倒一层MRS固体培养基,37℃恒温静置培养18 h,挑取单菌落接种到少量MRS液体培养基 (50 mL三角瓶装20 mL),然后再倒入一定量的MRS培养基到三角瓶颈部,37℃恒温静置培养48 h;然后50 mL三角瓶装液50 mL,接种量3%,37℃,静置培养14~16 h备用。
1.2.2 去除AFB1菌的筛选
1.2.2.1 初筛 将上述8种菌,按照1.2.1中方法活化培养至对数生长期后,将菌液接种于初筛培养基(液体)中,37℃或30℃振荡或静置培养2~5 d,观察菌株的生长情况。若变浑浊,取样划线于初筛培养基平板上,37℃或30℃培养,生长后挑取菌落,在初筛培养基上传代3次,保存能以香豆素为碳源生长的菌株做进一步筛选。
1.2.2.2 复筛 取初筛菌株分别接种于5 mL相应种子培养基中,相应温度静置或振荡培养相应时间,接着再以5%的接种量转接于100 mL活化培养基中,相应温度静置或振荡培养相应时间,取975μL菌体发酵液与25μL AFB1标准品(100μg/mL)置于灭菌的1.5 mL离心管中,使其毒素终浓度为2.5μg/mL,以无菌的复筛培养基加AFB1作为空白对照,于暗处在相应温度静置或振荡培养72 h,3次平行。反应结束后,离心去除菌体,取其上清液测样。
1.2.2.3 验证 取复筛阳性菌株,活化后,按照5%接种量接种于含有毒素终浓度为2.5μg/g的固体发酵培养基中,于暗处在相应温度静置或振荡培养72 h,3次平行,每12 h翻料一次。对照组在不接种菌种的情况下同样品处理。反应结束后,利用同体积甲醇水(7∶3)浸提,用玻棒搅拌,超声萃取 10 min后,4℃,8000 r/min离心 10 min,取上清待测。
1.2.3 高效菌株去除AFB1特性研究 取适量高效菌株培养液,4℃,8000 r/min离心 15 min,分别收获上清液和菌体。菌体用无菌PBS(pH 7.0)洗涤、离心 3次后加入5 mL无菌PBS(pH 7.0)制成菌悬液。菌体加入 5 mL无菌PBS(pH 7.0)混匀,超声波破碎 30 min后离心,离心上清液过0.22μm滤膜,制得胞内液。将培养液、上清液、菌悬液、胞内液分别加入 AFB1标准品,使 AFB1终浓度为 2.5 μg/mL,以 PBS(pH 7.0) 加 AFB1作为空白对照,37℃,150 r/min暗处振荡培养72 h,检测各组分AFB1去除率。
1.2.4 AFB1去除率的测定 AFB1去除率的测定采用酶联免疫法(ELISA),具体方法见试剂盒说明书,试剂盒购自上海酶联生物科技有限公司。
2 试验结果
2.1 初筛 香豆素作为唯一的碳源和能源对8株目标菌株进行初筛发现,共有4株菌株具有较好的生长情况,包括2株芽孢杆菌(枯草芽孢杆菌和地衣芽孢杆菌),一株酵母菌(酿酒酵母)和一株乳酸菌(植物乳杆菌),具体结果见表1。

表1 8株目标菌株初筛结果
2.2 复筛 由图1可知,初筛中四株具有去除香豆素能力的菌株对AFB1也均有不同程度的去除能力。其中,枯草芽孢杆菌最好,去除率达到(60.73±0.83)%,酿酒酵母次之,为(56.87±1.29)%。
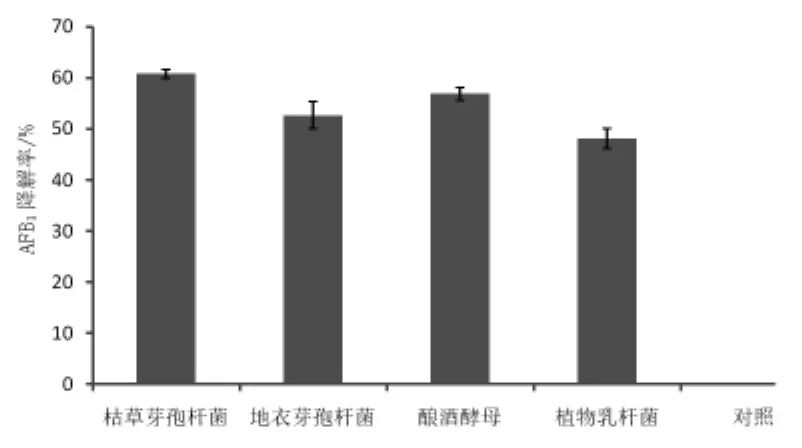
图1 复筛菌株对AFB1的去除率
2.3 验证 根据图2结果显示,在花生粕中,4株复筛菌株对AFB1的去除率较复筛过程有所降低,尤其是酿酒酵母和植物乳杆菌,分别下降了71.71%和80.87%。另外,枯草芽孢杆菌对AFB1的去除率依然最高,达到了(37.39±2.05)%,次之是地衣芽孢杆菌,去除率为(32.65±2.50)%。选择枯草芽孢杆菌为后续研究菌株。
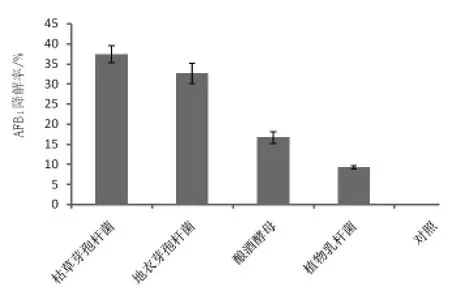
图2 复筛菌株在花生粕中对AFB1的去除率
2.4 高效菌株去除AFB1特性 图3比较了枯草芽孢杆菌培养液、上清液、菌悬液和胞内液对AFB1的去除能力。结果发现,培养液和上清液分别保持了较高的AFB1去除能力,分别达到了(59.19±2.09)%和(57.65±1.50)%,而菌悬液和胞内液虽有一定的去除能力,但均在20%以下,胞内液甚至不足10%。
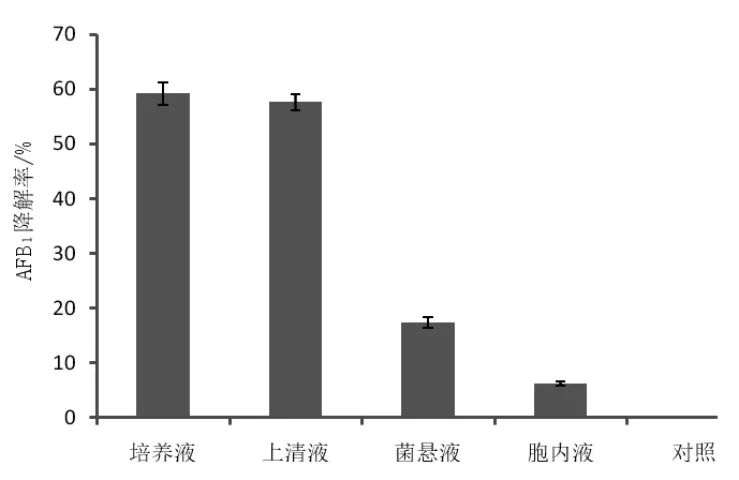
图3 枯草芽孢杆菌各组分对AFB1的去除能力
3 讨论
AFB1标准品毒性极强、对操作者有危险并且价格昂贵,而香豆素是一种可人工合成的化工原材料,无毒较安全,价格低廉,易于获得。因此选取结构相似的香豆素作为唯一碳源和能源。先用香豆素液体培养基作为初筛培养基。液体培养基试管置于恒温摇床培养,好氧菌株(芽孢杆菌、酵母菌)在氧量丰富的培养基内生长繁殖迅速,而兼性厌氧菌株(乳酸菌)通过加大装液量、减少氧气存在量以及提供丰富的营养物质的方法,使其快速繁殖生长,从而保证了具有利用香豆素能力的菌株在没有其他条件影响的情况下正常生长。然后再利用固体平板对有生长的菌株进行3次验证,保证了筛选效果的准确性。通过本方法,初筛过程共筛选得到4株细菌能利用香豆素并生长良好,而复筛结果也证明4株香豆素筛选菌株均能不同程度的去除AFB1,再次验证了香豆素筛选法在去除AFB1目的菌株的筛选中是切实可行的。
经过验证过程发现,芽孢杆菌对于AFB1的去除能力较强,这和玉孙玲玉 (2014)的研究结果相一致,但是利用地衣芽孢杆菌降解AFB1的研究还鲜见报道。同时酵母、乳酸菌也表现出一定的去除能力,这和张秀江等 (2016)的研究结果近似,但去除能力上稍显不足。但本研究结果显示,2株真菌 (黑曲霉和米曲霉)并没有表现出相应的AFB1去除能力,这和张晓雪等 (2017)等的结果不一致,这可能与菌株的来源不同有关。
微生物对 AFB1的脱毒作用有 2种情况,吸附或降解。根据验证试验结果,酿酒酵母和植物乳杆菌发酵含有AFB1的花生粕后,经过超声处理后,去除率大幅下降,这说明酵母菌和乳酸菌对AFB1的去除作用主要体现在吸附性能上 (刘畅等,2010)。然而,也有研究表明,酵母菌对AFB1也有一定的降解作用(张高娜 等,2013),并且还和其细胞壁有一定的关系(徐智鹏 等,2015)。而对于芽孢杆菌则对超声处理影响不大,这说明芽孢杆菌对AFB1的去除作用主要是其代谢产物的降解作用,而其去除AFB1活力的下降(与复筛相比)与芽孢杆菌在以花生粕为基质的培养基上生长情况一般有关(杨新建 等,2015)。另外,图3的结果进一步验证了上述的结果,枯草芽孢杆菌去除AFB1的能力主要依靠的是由其菌体细胞代谢产生并分泌至胞外的某种活性物质的生物降解作用,而不是菌体本身的吸附作用,具体该活性物质的种类和特性还有待采取加热、蛋白酶K处理等措施进一步分析和研究。
4 结论
本研究通过利用香豆素为唯一碳源,经过初筛和复筛过程,筛选出2株芽孢杆菌、1株乳酸菌和1株酵母菌具有AFB1去除能力;同时利用验证过程,初步确定了4株菌对AFB1的去除特性,并根据去除率的高低,筛选了枯草芽孢杆菌为后续研究的目标菌株;通过枯草芽孢杆菌各组分去除AFB1能力的比较,发现枯草芽孢杆菌去除AFB1的能力主要由菌体代谢产生的某种活性物质主导,并提示其是一种胞外物质。为后期分离纯化该菌株去除AFB1的活性物质,研究其作用机制,以及其在花生粕脱毒上的具体应用提供基础。
