新型N1-取代-1,8-萘啶-3-甲酰胺类ASBT 抑制剂的设计、合成及活性研究
2018-08-15赵跃高梦远刘洪涛李文燕何红伟王菊仙
赵跃,高梦远,刘洪涛,李文燕,何红伟,王菊仙
血浆胆固醇水平升高是冠状动脉疾病(coronary artery disease,CAD)的主要危险因素[1],因此降低胆固醇水平有利于预防 CAD。在肝脏中,胆固醇被代谢成胆汁酸并释放到十二指肠中[2],其中超过 90% 的胆汁酸被回肠顶端钠依赖性胆酸转运体蛋白(ASBT)重吸收,并且通过肠肝循环运回到肝脏中[3-6]。胆汁酸螯合剂(BASs)的使用已经证明增加胆汁酸的排泄可以降低肝脏和血清中的胆固醇水平。因此,抑制 ASBT 功能可以减少胆汁酸的重吸收,从而促进胆汁酸的合成,进而增加胆固醇的消耗[7-9]。此外,由于 ASBT 位于回肠内腔的顶端膜上,抑制剂可以不进入循环系统而阻断 ASBT 活性。因此,ASBT 抑制剂一直被认为是治疗高胆固醇血症的新策略[10-12]。
相关的研究表明,喹啉类、苯并硫䓬类和萘酚类等 ASBT 抑制剂 S-1647[13]、S-8921[14]、R-146224[15]、SC-435[16]和 R-16B[17]在动物模型中均可以阻断胆汁酸重吸收并显著降低胆固醇水平(图 1)。已报道的 ASBT 抑制剂 S-8921、R-146224、R-16B 和 SC-435 结构中含有烷氧基苯基、长链烷烃或对二甲苯连接的对称性叔胺或季铵盐的结构片段。而本课题组报道的系列化合物中1-(2,4-二氟苯基)-7-N,N-二甲氨基-4-氧代-1,4-二氢-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(4a1)也具有潜在的抑制 ASBT 的活性[18]。前期构效关系研究表明,化合物 4a1结构中 7 位 N,N-二甲基氨基和 3 位 3,5-二氟苯酰胺基均有利于 ASBT 的抑制活性。基于以上研究结果,本文以 4a1为先导化合物,利用拼合原理,将烷氧基苯基及直链烷烃或对二甲苯连接的对称性叔胺或季铵盐基团引入到先导化合物 4a1的 N-1 位,设计、合成了一系列-1-(烷氧基苯基)-7-二甲氨基-4-氧代-1,4-二氢-1,8-萘啶-3-N-(3,5-二氟苯基)-甲酰胺类化合物(图 2),以期获得活性更优的 ASBT 抑制剂。
1 材料与方法
1.1 材料
梅特勒 MP-70 熔点仪为瑞士梅特勒-托利多公司产品,温度计未经校正;Bruker ARX-400、Bruker ARX-500 型核磁共振仪为德国 Bruker 公司产品;Agilent-1100 型四极杆液质联用仪为美国Agilent 公司产品;MicroBeta 2 液闪仪为美国 PE公司产品;所有试剂均为市售分析纯或化学纯。

图 1 ASBT 抑制剂的结构Figure 1 Structures of ASBT inhibitors
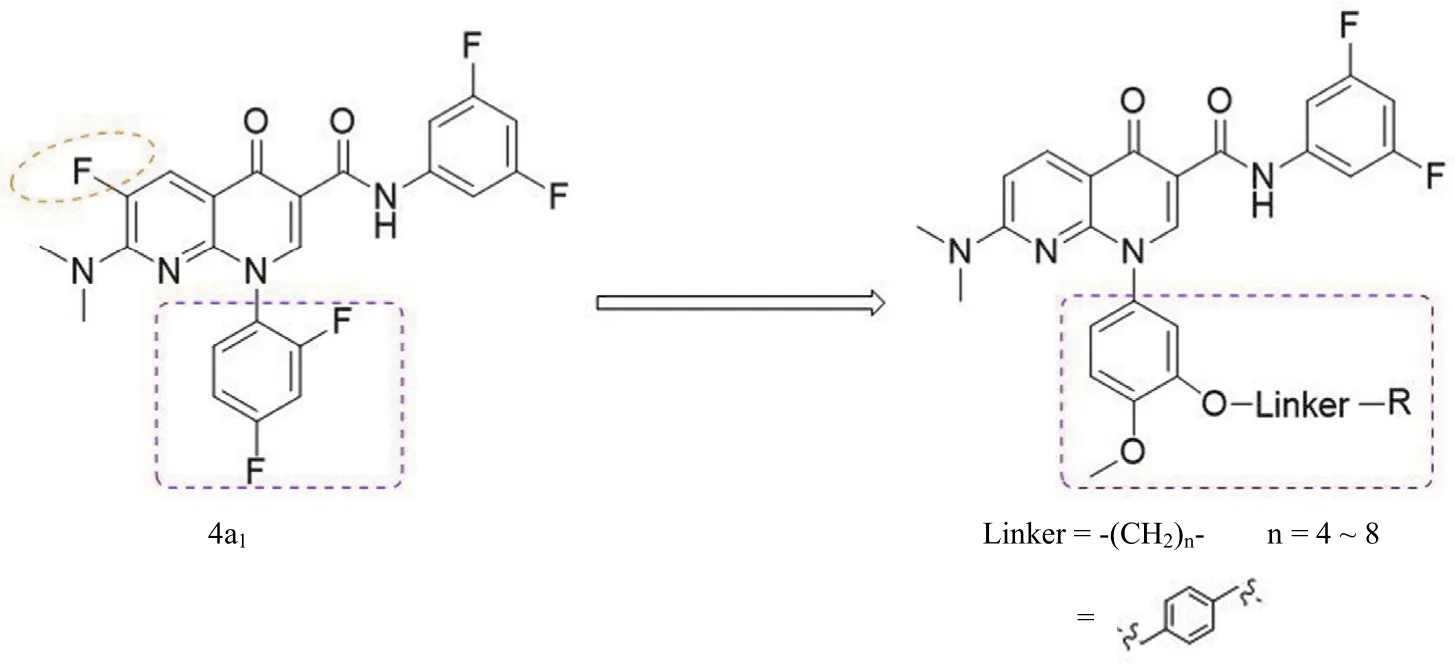
图 2 目标化合物设计思想Figure 2 Design of target compounds
1.2 方法
1.2.1 目标化合物的合成 以 2,6-二氯烟酰乙酸乙酯(1)为起始原料,参考喹诺酮类化合物的合成方法[19],经缩合、取代和水解反应依次制得化合物 2 ~ 6,6 经混合酸酐法与 3,5-二氟苯胺缩合得到 7,7 再经 NaOH-H2O-EtOH 体系水解得到 8,8 与二溴取代烷烃缩合得到化合物 9a ~ 9f,最后与伯胺或叔胺反应得到相应的目标产物 10a ~ 10f(图 3)。
1.2.2 ASBT 抑制活性测试方法 采用人HEK293T 细胞,用 10% FBS 的 DMEM 培养液培养,以 30 万/孔铺到 12 孔板中,同时用pcDNA3.1/hASBT 质粒或 pcDNA3.1 空载体进行转染。转染后的细胞培养 24 h。ASBT 活性分析:12 孔板的细胞用预热的基础溶液温和地清洗两次,然后将 0.5 ml 含有 1 μCi/ml3H 标记的牛磺胆酸和指定浓度的待测化合物的基础溶液加入到12 孔板中,37 ℃ 静止 10 min 后用预冷基础溶液洗 3 遍,然后每孔加 0.3 ml 裂解液裂解细胞,再将裂解液转入到液闪仪中,加入 0.7 ml 的闪烁液,用 MicroBeta2 液闪仪测定。用如下方程计算待测样品的抑制率:
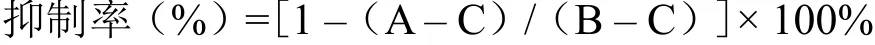
其中,A 为加入待测样品与3H 标记的牛磺胆酸后测定的摄入细胞的3H 值;B 为加入空白对照样品与3H 标记的牛磺胆酸后测定的摄入细胞的3H 值;C 为转染 pcDNA3.1 空载体加入空白对照样品与3H 标记的牛磺胆酸后测定的摄入细胞的3H 值。

图 3 目标化合物合成路线Figure 3 The synthetic pathway of target compounds
2 结果
2.1 目标化合物的合成
共合成目标化合物 48 个,化合物结构均经1H-NMR 和 MS 确证。部分代表性目标化合物的1H-NMR 和 MS 数据如下:
2.1.1 1-{3-[4-(三乙胺溴化物-1-基)丁氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10a1) 白色固体粉末,产率 52.7%,mp:239.0 ~ 240.3 ℃。1H-NMR(400 MHz,CDCl3)δ:1.41(9H,s),2.04(4H,s),3.06(6H,s),3.49 ~ 3.55(8H,m),3.94(3H,s),4.14(2H,s),6.55(1H,t,J= 8.2 Hz),6.75(1H,d,J= 8.9 Hz),6.96 ~ 7.06(3H,m),7.42(2H,d,J= 8.0 Hz),8.45(1H,d,J= 9.0 Hz),9.02(1H,s),12.60(1H,s)。ESI-MS m/z:622.38[M+H]+。
2.1.2 1-{3-[4-(N-甲基吡咯烷溴化物-1-基)丁氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10a3) 白色固体粉末,产率 66.5%,mp:245.3 ~ 246.9 ℃。1H-NMR(400 MHz,CDCl3)δ:2.01 ~ 2.09(5H,m),2.31 ~ 2.35(5H,m),3.04(6H,s),3.32(3H,s),3.88 ~ 3.92(6H,m),3.94(3H,s),4.11(2H,s),6.53(1H,t,J= 8.2 Hz),6.72(1H,d,J=8.9 Hz),6.97 ~ 7.03(3H,m),7.39(2H,d,J=8.0 Hz),8.44(1H,d,J= 9.0 Hz),8.89(1H,s),12.62(1H,s)。ESI-MS m/z:606.32 [M+H]+。
2.1.3 1-{3-[5-(三乙烯二胺溴化物-1-基)戊氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10b3) 白色固体粉末,产率 60.5%,mp:290.8 ~ 291.9 ℃。1H-NMR(400 MHz,CDCl3)δ:1.61 ~ 1.65(2H,m),1.89 ~ 1.95(4H,m),3.03(6H,s),3.25(6H,t,J= 6.4 Hz),3.64 ~ 3.69(8H,m),3.95(3H,s),4.03(2H,t,J= 5.6 Hz),6.53(1H,t,J=8.2 Hz),6.70(1H,d,J= 8.9 Hz),6.97 ~ 7.04(3H,m),7.36(2H,d,J= 8.0 Hz),8.45(1H,d,J=9.0 Hz),8.78(1H,s),12.69(1H,s)。ESI-MS m/z:647.31 [M+H]+。
2.1.4 1-{3-[5-(吗啉-1-基)戊氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10b4) 白色固体粉末,产率 51.3%,mp:200.1 ~ 201.6 ℃。1H-NMR(400 MHz,CDCl3)δ:1.51 ~ 1.56(6H,m),1.88~ 1.91(2H,m),2.47(4H,s),3.02(6H,s),3.72 ~ 3.75(4H,m),3.95(3H,s),4.00(2H,t,J= 5.6 Hz),6.53(1H,t,J= 8.2 Hz),6.70(1H,d,J= 8.9 Hz),6.95(1H,s),6.97(2H,s),7.38(2H,d,J= 8.0 Hz),8.45(1H,d,J= 9.0 Hz),8.82(1H,s),12.67(1H,s)。ESI-MS m/z:622.28[M+H]+。
2.1.5 1-{3-[6-(哌啶-1-基)己氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10c5) 白色固体粉末,产率 54.8%,mp:185.3 ~ 186.9 ℃。1H-NMR(400 MHz,CDCl3)δ:1.39(4H,s),1.83 ~ 1.90(6H,m),2.47(8H,s),3.02(6H,s),3.52(2H,s),3.95(3H,s),3.98(2H,t,J= 6.8 Hz),6.53(1H,t,J= 9.2 Hz),6.70(1H,d,J= 9.1 Hz),6.94(1H,s),6.96(2H,s),7.38(2H,d,J=7.9 Hz),8.46(1H,d,J= 9.0 Hz),8.82(1H,s),12.68(1H,s)。ESI-MS m/z:634.36 [M+H]+。
2.1.6 1-{3-[6-(N-甲基哌啶溴化物-1-基)己氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10c6) 白色固体粉末,产率 59.6%,mp:238.3 ~ 239.8 ℃。1H-NMR(400 MHz,CDCl3)δ:1.78(5H,s),1.88 ~ 1.90(5H,m),2.35(2H,s),3.05(6H,s),3.31(3H,s),3.47(2H,s),3.70 ~ 3.74(6H,m),3.95(3H,s),4.04(2H,t,J= 6.6 Hz),6.54(1H,t,J= 8.8 Hz),6.74(1H,d,J= 9.1 Hz),6.97(2H,s),7.18(1H,s),7.42(2H,d,J= 8.0 Hz),8.45(1H,d,J= 9.0 Hz),8.82(1H,s),12.66(1H,s)。ESI-MS m/z:648.44 [M+H]+。
2.1.7 1-{3-[7-(吡啶溴化物-1-基)庚氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10d7) 白色固体粉末,产率 66.3%,mp:235.9 ~ 237.5 ℃。1H-NMR(400 MHz,CDCl3)δ:1.46(4H,s),1.84 ~ 1.85(2H,m),2.09(2H,s),3.05(6H,s),3.95(3H,s),4.06(2H,t,J= 6.8 Hz),5.04(2H,t,J=7.2 Hz),6.55(1H,t,J= 9.2 Hz),6.77(1H,d,J= 9.1 Hz),6.96(2H,s),7.08(1H,s),7.45(2H,d,J= 7.9 Hz),8.03(2H,t,J= 6.7 Hz),8.38 ~ 8.45(2H,m),9.17(1H,s),9.56(2H,d,J= 5.5 Hz),12.63(1H,s)。ESI-MS m/z:642.45 [M+H]+。
2.1.8 1-{3-[7-(4-甲基哌啶-1-基)庚氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10d8) 白色固体粉末,产率 55.2%,mp:187.3 ~ 188.8 ℃。1H-NMR(400 MHz,CDCl3)δ:0.98(3H,s),1.38 ~ 1.47(8H,m),1.58(6H,s),1.72(4H,s),1.81 ~ 1.88(3H,m),3.03(6H,s),3.95(3H,s),3.98(2H,t,J= 5.6 Hz),6.53(1H,t,J= 8.2 Hz),6.70(1H,d,J= 8.9 Hz),6.94(1H,s),6.96(2H,s),7.38(2H,d,J= 8.0 Hz),8.46(1H,d,J= 9.0 Hz),8.82(1H,s),12.69(1H,s)。ESI-MS m/z:662.48[M+H]+。
2.1.9 1-{3-[8-(吡咯烷-1-基)辛氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10e1) 白色固体粉末,产率 50.9%,mp:182.6 ~ 183.9 ℃。1H-NMR(400 MHz,CDCl3)δ:1.34(6H,s),1.44(2H,s),1.66(4H,s),1.82 ~ 2.02(6H,m),2.65(4H,s),3.02(6H,s),3.95(3H,s),3.98(2H,t,J= 6.6 Hz),6.53(1H,t,J= 8.8 Hz),6.70(1H,d,J= 9.1 Hz),6.95 ~ 6.96(3H,m),7.38(2H,d,J= 8.0 Hz),8.46(1H,d,J= 9.0 Hz),8.82(1H,s),12.68(1H,s)。ESI-MS m/z:648.43 [M+H]。
2.1.10 1-{3-[4-(二乙胺基-1-基)甲基苄氧基]-4-甲氧基苯基}-7-N,N-二甲氨基-1,4-二氢-4-氧代-1,8-萘啶-3-N-(3,5-二氟苯基)甲酰胺(10f1) 白色固体粉末,产率 50.5%,mp:163.1 ~ 164.6 ℃。1H-NMR(400 MHz,CDCl3)δ:1.05(6H,s),2.53(4H,s),3.01(6H,s),3.57(2H,s),3.97(3H,s),5.11(2H,s),6.53(1H,t,J= 9.2 Hz),6.69(1H,d,J= 9.1 Hz),6.99(3H,s),7.36 ~ 7.44(6H,m),8.45(1H,d,J= 9.0 Hz),8.77(1H,s),12.66(1H,s)。ESI-MS m/z:642.32 [M+H]+。
2.2 ASBT 抑制活性
以 S-1647 为阳性对照,采用放射性结合试验(RBA)法,测定了 48 个目标化合物的 ASBT 抑制活性,其 ASBT 活性抑制率结果如表 1 所示。目标化合物均具有 ASBT 抑制活性,其中 8 个化合物抑制活性明显高于阳性对照 S-1647(76.1%)。特别是化合物 10b2、10c3、10c6、10d2、10d3、10d6和 10d7,在 10 µmol/L 浓度下对 ASBT 的抑制率均大于 90%。

表 1 目标化合物 10a ~ 10f 的结构及其 ASBT 抑制活性Table 1 The structures and ASBT inhibitory activities of compounds 10a - 10f

续表 1
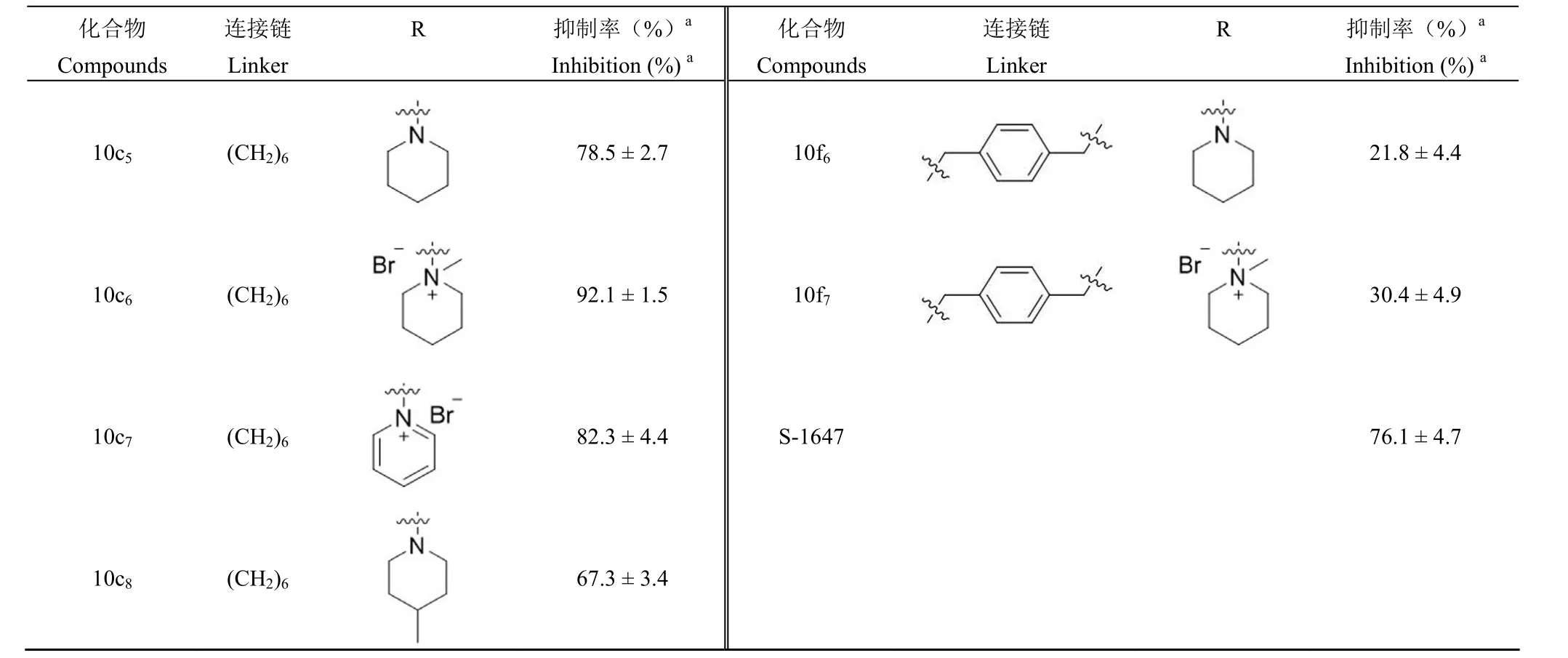
续表 1
3 讨论
ASBT 抑制活性结果表明(表 1),在以 4 ~8 个碳原子直链烷基和对二甲苯基为连接链的化合物中,烷基链的长度为 5 ~ 7 时较为适宜,尤其是烷基链长度为 7 时(10d)活性最好;当烷基链长度增加到 8 时,活性急剧下降;连接链为对二甲苯基时的活性明显弱于直链烷基;这表明连接链的长度和结构均对其活性有影响。对于连接链末端取代基,吡咯烷取代化合物活性明显弱于其成季铵盐相应的化合物(10a2vs10a3、10b1vs10b2、10c1vs10c2和 10d1vs10d2);哌啶取代的化合物活性明显弱于其成季铵盐相应的化合物(10a6vs10a7、10b5vs10b6、10c5vs10c6和 10d5vs10d6);其他季铵盐形式的化合物如三乙烯二胺季铵盐和吡咯季铵盐也优于相对应的叔胺结构化合物。因此末端季铵盐形式对于化合物抑制 ASBT 活性具有重要的意义,值得进一步深入研究。本文以化合物 4a1为先导化合物,设计、合成了一系列新型 N1-取代-1,8-萘啶-3-甲酰胺类化合物,测定其对 ASBT 的抑制活性,总结了化合物的初步构效关系,为新型 ASBT的研究奠定了基础。
