毛果杨PtrMYB161基因在木质部发育中的表达调控1)
2018-08-13刘欣颖刘宝光王志凤刘慧子李伟姜立泉
刘欣颖 刘宝光 王志凤 刘慧子 李伟 姜立泉
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
木材是植物次生生长所形成的木质化组织,是制浆造纸、建筑和生物质能源的重要原材料,是不可或缺的可再生资源[1-2]。木材的形成过程包括维管形成层分化形成次生木质部以及木质部中细胞壁的加厚[3-5]。前人的研究发现,该发育过程受到不同水平的分子网络调控,其中转录水平的调控是一个非常关键的调控环节[6]。研究转录因子调控木材形成分子机制能够为提高森林生产力提供一条崭新且精确的遗传改良途径[7-8]。
NAC和MYB等家族转录因子在木质部发育中起着重要调控作用[9]。在拟南芥中MYB46和MYB83是SND1的下游基因能够激活次生壁生物合成相关基因表达[10-12]。SND1在杨树中有4个同源基因PtrSND1-A1、A2、B1和B2,并且PtrSND1-B1能够直接激活MYB46的同源基因PtrMYB2和PtrMYB21的表达[13-14]。杨树的PtrMYB2/3/20/21、桉树的EgMYB2和松树的PtMYB4参与调控木材形成中次生壁的生物合成[15-16]。通过对毛白杨的研究表明,PtoMYB216参与调控木材形成中木质素的生物合成[17]。PtoMYB170过表达情况下增加木质素含量并导致木质部次生细胞壁增厚[18]。PtoMYB156过表达情况下抑制次木质部中纤维细胞的细胞壁增厚并且导致其纤维素、木质素和木聚糖含量下降[19]。桉树中EgMYB1通过EgH1.3的组蛋白修饰在木材形成中抑制木质部合成并且降低木质素含量[20]。总之,MYB转录因子在参与木质部发育过程中扮演了必不可少的角色[21]。
本团队通过收集毛果杨不同组织进行RNA-seq分析,结果发现PtrMYB161在木质部特异性表达。同时,利用激光显微切割技术收集木质部不同类型细胞进行RNA-seq分析,结果显示该基因在纤维细胞中高丰度表达。以上结果说明该基因可能在木质部发育过程中起着调控作用。本实验以PtrMYB161为研究对象,对其在木质部发育过程中的表达调控进行初步探索。
1 材料与方法
以室温室内人工培养的毛果杨(Populustrichocarpa)为材料进行材料收集与农杆菌遗传转化。胶回收、质粒提取试剂盒购自QIAGEN公司(美国);PCR扩增有关试剂、DNA marker、限制性内切酶Xba I和Sac I、T4 DNA ligase购自NEB(中国北京);反转录试剂盒和pENTR/D-topo试剂盒购自invitrogen公司,pfu高保真酶购自Aglient公司,FastStart Universal SYBR Green Master 购自罗氏公司,大肠杆菌TOP10感受态、农杆菌GV3101以及pBI121载体为本实验室保存。
1.1 PtrMYB161基因特异表达
对温室生长4个月大的毛果杨木质部、韧皮部、叶片、顶芽和形成层进行收集,并利用激光显微切割方法对纤维细胞、导管细胞和形成层细胞分别进行收集。对以上组织细胞进行RNA提取及转录组测序分析。
1.2 PtrMYB161基因克隆和表达载体构建
根据Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html#!search)所公布的mRNA序列进行引物设计PtrMYB161pE-F/R(表1),用质粒提取试剂盒对毛果杨木质部的总RNA进行提取并反转录作为模板,进行目标基因扩增,将纯化后的PCR产物连接至pENTR载体,选取阳性克隆命名为Pentr-PtrMYB161-1,由生物公司进行测序。将得到的具有目的片段的质粒再经过引物PtrMYB161pBI121-F/R(表1)进行扩增,利用XbaⅠ、SacⅠ将扩增后的产物和pBI121载体质粒双酶切,胶回收后的产物连接T4载体并用引物35S-F和PtrMYB161pBI121-R(表1)验证阳性克隆,命名为pBI121-PtrMYB161-1,送至生物公司测序。

表1 引物序列
注:TCTAGA是Xba I;GAGCTC是Sac I。
1.3 PtrMYB161基因亚细胞定位
成功构建PtrMYB161基因融合绿色荧光蛋白(GFP)瞬时表达载体,并利用氯化铯—溴化乙锭超高速梯度密度离心方法进行质粒提取,利用团队已建立的毛果杨木质部原生质体瞬时转化系统,对PtrMYB161转录因子蛋白的亚细胞定位进行分析,质粒与细胞核定位的瞬时表达载体(H2A:mCherry)各5 μL与毛果杨木质部分离出来的原生质体100 μL进行共转化,并过夜培养,次日通过荧光显微镜进行镜检观察。
1.4 转基因毛果杨获得及分子水平分子检测
通过农杆菌介导法对3周大长势健康的毛果杨的第2、3茎节进行浸染并选出抗性株系进行DNA水平检测,利用引物35S-PtrMYB161mid-F/R(表1)进行PCR扩增,对得到阳性植株进行扩繁。
经过qRT-PCR检测PtrMYB161基因在RNA水平的表达情况,利用RNA提取试剂盒对获得的阳性转基因植株RNA提取,采用反转录试剂盒进行反转录合成cDNA。用野生型cDNA作为对照组,Actin作为内参基因。利用引RT-PCR-PtrMYB161-F/R(表1),对野生型和转基因植株进行RT-PCR检测。反应完毕后,根据2-ΔΔCt方法进行数据分析[22]。
1.5 过表达转基因毛果杨的表型观察
选取转基因株系中表达量最高的株系和同时期的对照组野生型毛果杨各3棵,同时移栽到土里,在相同条件下进行观察,培养120 d后,对植株的高度、叶面积、茎节长度以及茎直径进行测量,并利用SPSS 21.0软件进行差异性统计分析。并对转基因株系和对照组野生型毛果杨同时选取第8茎节进行石蜡切片并染色进行表型观察。
2 结果与分析
2.1 PtrMYB161基因在不同组织中差异表达
为了解PtrMYB161基因在毛果杨中不同组织中的表达差异,分别对温室生长4个月大的毛果杨形成层、木质部、韧皮部、叶片和顶芽进行收集,并利用激光显微切割对木质部中的纤维细胞、导管细胞和形成层细胞进行收集,并分别对以上5种组织和3种收集的细胞进行转录组分析。结果如表2所示:组织水平上PtrMYB161基因在木质部特异表达,在形成层、韧皮部、叶片和顶芽中微弱的表达,在细胞水平上PtrMYB161基因主要在纤维细胞中表达,推测PtrMYB161基因可能参与调控木质部发育进而影响杨树次生生长。
2.2 PtrMYB161全长基因的克隆和表达载体的构建
以野生型毛果杨木质部为材料,利用RNA提取试剂盒进行RNA提取,并反转录成cDNA作为模板,进行扩增,获得条带清晰单一且与PtrMYB161基因预期的大小相一致。将带有目的片段的阳性克隆进行测序,测序结果通过DNAstar软件进行比对分析,结果表明克隆片段与目的基因完全相同,将测序正确的菌液命名为Pentr-PtrMYB161-1,根据植物过表达载体pBI121的图谱进行PtrMYB161过表达载体的构建。比对序列结果显示植物表达载体构建成功。利用液氮冻融法将pBI121-PtrMYB161质粒转化到农杆菌GV3101感受态细胞中,检验阳性克隆,保存备用。

表2 PtrMYB161基因在不同组织中特异表达
2.3 PtrMYB161亚细胞定位结果分析
转录因子在细胞核行使功能,为了解PtrMYB161基因是否是典型的转录因子,是否定位在细胞核,现构建了PtrMYB161基因融合绿色荧光蛋白(GFP)瞬时表达载体。利用超高速梯度密度离心提取高纯度的PtrMYB161:sGFP质粒,将提取出的PtrMYB161:sGFP质粒与实验室已有的细胞核定位的瞬时表达载体(H2A:mCherry),共同进行毛果杨木质部原生质体的转化。结果如图1所示:PtrMYB161基因融合GFP发出的绿色荧光与细胞核定位的H2A基因融合mCherry发出的红色荧光完全重叠,重叠区域显示出黄色的光。这一结果表明:PtrMYB161转录因子定位在细胞核,具有转录因子的典型特征。

绿色为PtrMYB161:sGFP定位信号;红色为H2A:mCherry核定位Marker;黄色为PtrMYB161融合GFP发出的绿色荧光与细胞核定位的H2A融合mCherry发出的红色荧光完全重叠。
2.4 转基因植株的获得及分子水平鉴定
用含有pBI121-PtrMYB161的农杆菌GV3101浸染毛果杨茎段,利用引物35S-F和35S-PtrMYB161mid-R (表1)对提取出的DNA进行PCR扩增(图2),1%琼脂糖凝胶电泳显示的结果表示抗性植株中均含有目的基因,说明带有PtrMYB161基因的pBI121过表达载体质粒成功整合到毛果杨基因组中。

M.DNA Marker DL 2000;P.含有PtrMYB161的pBI121载体质粒作为阳性对照;1~6.6个抗性植株的DNA水平PCR条带;W.野生型毛果杨DNA结果作为阴性对照;H.ddH2O作为阴性对照。
利用qRT-PCR技术对转基因植株中的PtrMYB161基因的过表达水平进行鉴定,分别提取苗龄4周的6个转基因株系和相同培养状况的3株野生型无菌苗的第3片叶子总RNA,进行反转录,使用基因特异性引物RT-PCR-PtrMYB161F/R(表1),进行荧光定量PCR。检测结果如表3所示:转基因毛果杨(L1-L6)与野生型毛果杨(W1-W3)相比,转基因植株均为PtrMYB161过表达植株,其中转基因L5株系过表达水平最高,相比于野生型过表达了5 000倍;L1和L6株系相对于野生型过表达了3 000多倍;L3和L4株系相对于野生型过表达了1 000多倍;L2株系相对于野生型过表达水平较低,过表达了500倍。由于L5株系表达最高,因此选择该株系对PtrMYB161过表达后的表型进行观察,本研究选择移栽3棵L5和3棵WT到土中,进行下一步表型观测。
2.5 转基因株系表型性状
对PtrMYB161过表达转基因植株进行观察发现,在相同时间和条件下培养的转基因植株与野生型植株相比,转基因株系的植株高度、叶片面积、茎节长度和茎直径与野生型植株相比明显变矮、变小,茎段木质部层数与野生型相比明显减少,相同视野下,转基因植株茎段纤维细胞与导管细胞数量明显少于野生型纤维细胞与导管细胞数量选取土培约120 d的3棵L5转基因株系和3棵野生型植株,对其茎节长度、叶片面积和茎直径进行测量,利用SPSS 21.0软件,通过检验的方法对其差异显著性进行分析,结果如图3,转基因植株与野生型相比植株高度、茎节长度、茎直径和叶片面积显著变小(表4),并对同期种植到土中的L5和野生型第8茎节进行石蜡切片并染色观察发现,在第8茎节中的L5次生壁细胞的层数明显少于同期种植的野生型如图4(A、B),并且在相同视野下野生型植株木质部中纤维细胞与导管细胞的数量明显大于L5植株木质部中纤维细胞与导管细胞的数量。上述观测结果表明过表达PtrMYB161基因显著的影响了毛果杨木质部发育和毛果杨的生长发育。
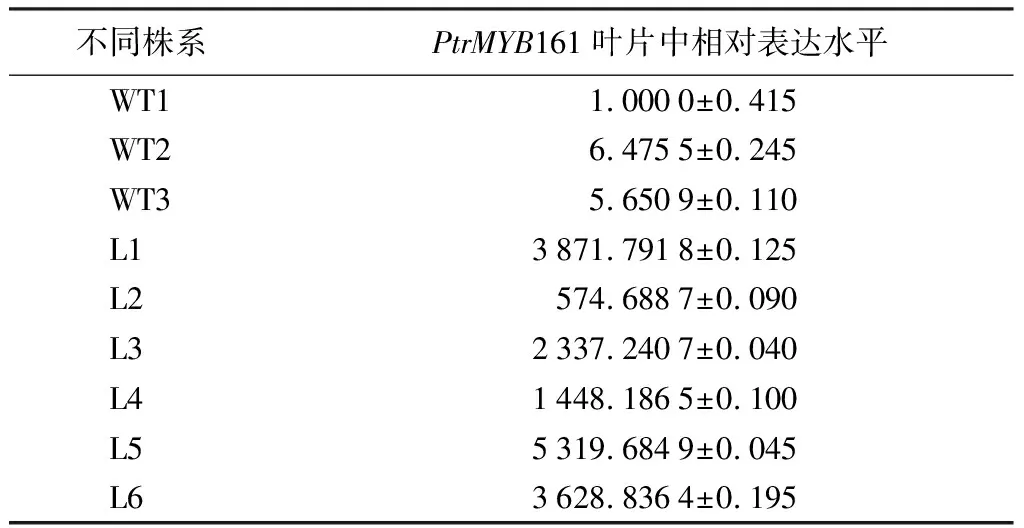
表3 转基因植株荧光定量PCR检测
注:表中数据相对表达水平±标准误;WT1、WT2、WT3.野生型毛果杨;L1~L6. 6个转基因毛果杨植株。

表4 转基因毛果杨表型的统计
注:表中数据“平均值±标准误”;** 表示L5和WT间存在极显著差异(p<0.01)。

A.移栽到土中的转基因植株(WT.野生型植株作为对照;L5.转基因植株);B.叶片大小比较(WT.野生型植株第6片叶子作为对照;L5.转基因植株第6片叶子);C.茎段长度比较(WT.野生型植株第6茎节作为对照;L5.转基因植株第6茎节)。
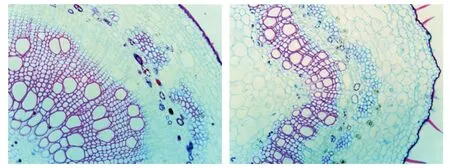
A.野生型对照组第8茎节石蜡切片 B.L5第8茎节石蜡切片
3 结论与讨论
本研究通过毛果杨的组织特异性分析发现PtrMYB161基因在毛果杨各个部位和木质部的不同细胞类型中均有不同程度表达,其中在木质部和纤维细胞中表达丰度最高,这暗示着PtrMYB161基因可能参与调控木质部发育及纤维细胞形成[23]。在对PtrMYB161亚细胞定位发现其定位在细胞核,这为功能未知的转录因子研究提供了初步线索[24-25]。
为了进一步验证PtrMYB161基因是否与木质部发育有关,本研究通过构建过表达载体获得过表达转基因植株并对其进行表型和切片观察分析,过量表达PtrMYB161基因植株的株高、叶面积、茎节长度和茎直径明显小于同期野生型对照组,这一现象很有可能说明过表达的PtrMYB161导致木质素的异位沉积[23],并且转基因组的木质部层数、纤维细胞明显小于同期野生型对照组,这说明在木质部和纤维细胞中特异表达的PtrMYB161基因可能通过参与调控木质部或纤维细胞形成进而影响毛果杨生长发育[26]。
在木本植物中,许多参与次生壁合成调控的转录因子已经被鉴定出来,目前研究重点主要在MYBs、NACs等转录因子[27],PtrMYB161属于MYB转录因子家族,已有研究报道PtrMYB161是PtrWND基因的下游调控因子[28]。PtrMYB161在拟南芥中的同源基因AtMYB52已有报道其参与调控次生细胞壁合成,AtMYB52基因过表达会影响参与次生壁合成相关基因表达[29]。PtrMYB161具有与AtMYB52类似的功能,在毛果杨次生壁合成方面发挥着重要调控作用。此外,有研究报道AtMYB52过表达转基因植株对ABA敏感,响应干旱胁迫和盐胁迫[30]。因此,这也暗示着PtrMYB161也有可能参与调控毛果杨对干旱、盐等逆境胁迫存在响应。后续研究中,我们将除了通过对PtrMYB161启动子活性分析,下游靶基因鉴定等进一步解析其调控毛果杨木质部发育的作用机制,也将研究干旱胁迫条件下该基因对毛果杨木质部发育的影响。
本研究中我们发现PtrMYB161基因在木质部特异表达,并且主要在纤维细胞中特异表达,过量表达PtrMYB161基因导致转基因植株矮小、木质部面积减少,表明该基因在毛果杨木质部发育中起着至关重要的调控作用,为深入研究其分子机制奠定了基础。
