白桦BpTOPP1基因功能1)
2018-08-13陈继英刘超逸王朔徐文娣黄海娇姜静
陈继英 刘超逸 王朔 徐文娣 黄海娇 姜静
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
欧洲白桦(Betulapendula)广泛分布于欧亚大陆和北美,其种内变种裂叶桦(B.pendula‘Dalecarlica’)叶片边缘呈掌状深裂,具有极高的观赏价值[1],是人们喜爱的园林绿化树种之一[2-3]。近年来,人们通过对拟南芥(Arabidopsisthaliana)、苜蓿(Medicagotruncatula)、白菜(Brassicarapassp.chinensis)等研究,对植物叶缘缺刻变异的遗传机理逐渐明晰起来,认为叶缘缺刻的形成与生长素的极性运输产生浓度梯度密切相关[4-10]。有研究证明在植物生长素信号通路中通过可逆磷酸化作用调节生长素运输,其中,PPP家族丝氨酸/苏氨酸蛋白磷酸酶在植物激素信号转导途径中发挥重要作用[11-12]。蛋白激酶和蛋白磷酸酶介导蛋白质的可逆磷酸化是信号转导的重要机制之一,是生物体内普遍存在的调控细胞信号转导过程的重要作用方式,根据以前的研究表明,蛋白磷酸酶参与了ABA、病原侵染、胁迫及发育信号转导途径[13]。
研究团队为了挖掘控制叶缘缺刻性状的关键基因,以裂叶桦不同发育时期叶脉组织为材料,构建了基因表达调控网络,TOPP1(TypeOneProteinPhosphatase1)就是第一层网络中的转录调控因子之一。根据底物的特异性差异和对特定抑制剂的反应不同,丝氨酸和苏氨酸蛋白磷酸酶可分为1型(PP1)和2型(PP2)[14],1型丝氨酸与苏氨酸蛋白磷酸酶(PP1s)与植物生长和发育的各种过程有关,在所有的植物物种中,PP1s由多基因家族编码[15]。PP1s是一大组丝氨酸和苏氨酸蛋白磷酸酶,在拟南芥中,PP1s被称为1型蛋白磷酸酶(TOPPs),先前的研究确认了8个拟南芥的PP1s基因(TOPP1-TOPP8)[15]。以往的研究表明,它们调节胚胎发育和蓝光依赖的气孔开放。水稻(Oryzasativa)中PP1基因的过表达可以增强植物的耐盐性[16]。拟南芥中研究表明,TOPP1是ABA信号通路的一个新的组件,TOPP1基因与它的调节蛋白AtI-2(ArabidopsisInhibitor-2)负调控ABA信号[17]。然而TOPP1基因在调节木本植物生长和发育的分子机制的研究尚不明确。
为了研究白桦(B.platyphylla×B.pendula)BpTOPP1基因的功能,实验采用qRT-PCR方法进行BpTOPP1的时空表达特性分析,同时以白桦的cDNA为模板克隆BpTOPP1基因并构建35S启动子驱动的过表达载体,通过农杆菌介导合子胚的方法进行白桦的遗传转化。拟探讨BpTOPP1基因在白桦叶发育过程中的作用。
1 材料与方法
基因定量分析所需的材料取自东北林业大学白桦育种基地3年生欧洲白桦(对照)和裂叶桦无性系的不同个体,取材部位是欧洲白桦和裂叶桦的第1~4片叶片(L1~L4),取材时间为5月至9月初,每隔15 d取一次材料,其中6月21日是按组织部位取材,分别采集2个无性系不同单株的顶芽(B)、第1~4片叶片(L1~L4)、嫩茎(S1~S3)、木质部(X)、根(R)、叶脉(P1~P4)、叶柄(V1~V4)等,材料采集后每个无性系相同组织部位混样后分3~4份包装并迅速放入液氮中,带回实验室置于超低温冰箱-80 ℃保存备用。
基因克隆材料取自白桦组培苗叶片,白桦遗传转化受体为本实验室保存的白桦优树成熟种子。
1.1 BpTOPP1基因的生物信息学分析与预测
利用ExPASy网站(http://web.expasy.org/protparam/)对BpTOPP1基因进行氨基酸的理化性质分析,登陆NCBI网页,用BlastP程序对BpTOPP1基因的氨基酸序列进行比对、构建进化树。
1.2 BpTOPP1的qRT-PCR
利用Primer 5.0软件设计白桦BpTOPP1基因及内参引物,并利用NCBI网站上的BLAST程序进行基因序列的比对,进而保证引物特异性(表1),所用引物均由上海捷瑞生物工程有限公司合成。

表1 qRT-PCR引物序列
采用北京百泰克生物技术有限公司的植物总RNA提取试剂盒将所取的试验材料提取总RNA,并用ReverTre Ace® qPCR RT Kit(Toyobo,Ltd,Osaka,Japan)反转录试剂盒将mRNA反转录为cDNA,将cDNA稀释10倍后用作qRT-PCR的模板[18],以18S rRNA作为内参扩增BpTOPP1基因。反应体系为:2×SBYR Green PCR Master Mix 10 μL,PCR Forward Primer(10 μL/L)1 μL,PCR Reverse Primer(10 μL/L)1 μL,模板(cDNA溶液)2 μL,加入ddH2O补足到20 μL。PCR反应条件:95 ℃ 3 min预变性,然后以95 ℃ 30 s、95 ℃ 15 s、57 ℃ 40 s进行40个循环,最后95 ℃ 1 min、55 ℃ 30 s、95 ℃ 30 s,进行溶解曲线分析。在ABI 7500定量PCR仪上完成qRT-PCR,3次重复,用2-ΔΔCt的方法对定量结果进行分析[19-24]。
1.3 BpTOPP1基因的遗传转化
BpTOPP1基因通过双酶切的方法进行载体构建(图1),采用农杆菌介导合子胚法进行BpTOPP1基因的遗传转化,将切好的白桦无菌合子胚置于DO600=0.5左右的工程菌液中侵染3~5 min,置于暗处进行共培养(WPM+2.0 mg/L 6-BA+0.2 mg/L NAA)2~3 d,随后进行选择培养(WPM+2.0 mg/L 6-BA+0.2 mg/L NAA+50 mg/L潮霉素+200 mg/L头孢霉素),2~3周后陆续产生抗性愈伤组织,20 d后将抗性愈伤转至分化培养基上继续培养(WPM+0.8~1.0 mg/L 6-BA+50 mg/L GA3+50 mg/L潮霉素+200 mg/L头孢霉素),待其长出不定芽后进行继代培养(WPM+0.8L~1.0 mg/L 6-BA+50 mg/L潮霉素+200 mg/L头孢霉素)[25-26],20~30 d后不定芽生长至3~5 cm时,转入生根培养基(WPM+0.2 mg/L IBA)中,获得白桦潮霉素抗性株系。
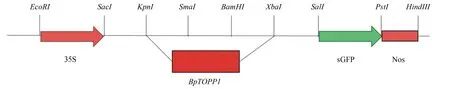
图1 植物表达载体示意图
1.4 转基因植株的分子检测
利用BioTeke新型快捷植物基因组DNA提取试剂盒提取转基因白桦和WT叶片的DNA。以各株系DNA为模版,以BpTOPP1-F1(5’-GGGGTACCATGGAACCTGCAGTCCTGGA-3’)、BpTOPP1-R1(5’-GCTCTAGAATCACTAGGCTTAGCTGCAGCTG-3’)为引物,进行PCR鉴定。以各株系叶片cDNA为模板,以BpTOPP1-F、BpTOPP1-R为引物,以18 S为内参进行qRT-PCR,3次重复。通过2-ΔΔCT法计算BpTOPP1基因在各株系中的相对表达量。
1.5 生长性状的调查
采用组培技术扩大繁殖获得的转基因及对照白桦,2017年5月中旬将组培生根苗移栽至育苗盘中,每个株系移栽50株,在同年9月中旬时进行叶绿素调查,用手持型叶绿素仪(SPAD502,Japan)测定转基因株系和对照株系的叶绿素质量分数,选取功能叶进行测定,每个株系测10株,每株测3次重复。在9月末植物停止生长后,每个株系分别选择10株生长一致的苗木,取第4片功能叶进行叶面积、叶宽和叶长的调查,并对这10株苗木进行苗高和地径调查。
2 结果与分析
2.1 BpTOPP1基因的生物信息学
利用ExPASy网站(http://web.expasy.org/protparam/)对BpTOPP1基因以及其家族基因进行氨基酸的理化性质分析,结果表明BpTOPP1转录因子基因编码氨基酸为313个,分子式为C1603H2487N427O461S20,分子质量为35 758.16 u,原子总数为4 998。通过白桦转录组测序得到BpTOPP1基因的全长序列,用NCBI上的ORF finder对该序列进行分析,该基因包含1个942 bp的开放阅读框,终止密码子为UGA,该基因包含4个外显子和3个内含子。通过NCBI找出拟南芥(Arabidopsisthaliana)的PP1s氨基酸序列,与白桦的BpTOPP1的全长氨基酸序列绘制进化树(图2),结果显示:白桦BpTOPP1与拟南AtTOPP6和AtTOPP4氨基酸序列同源性最高。
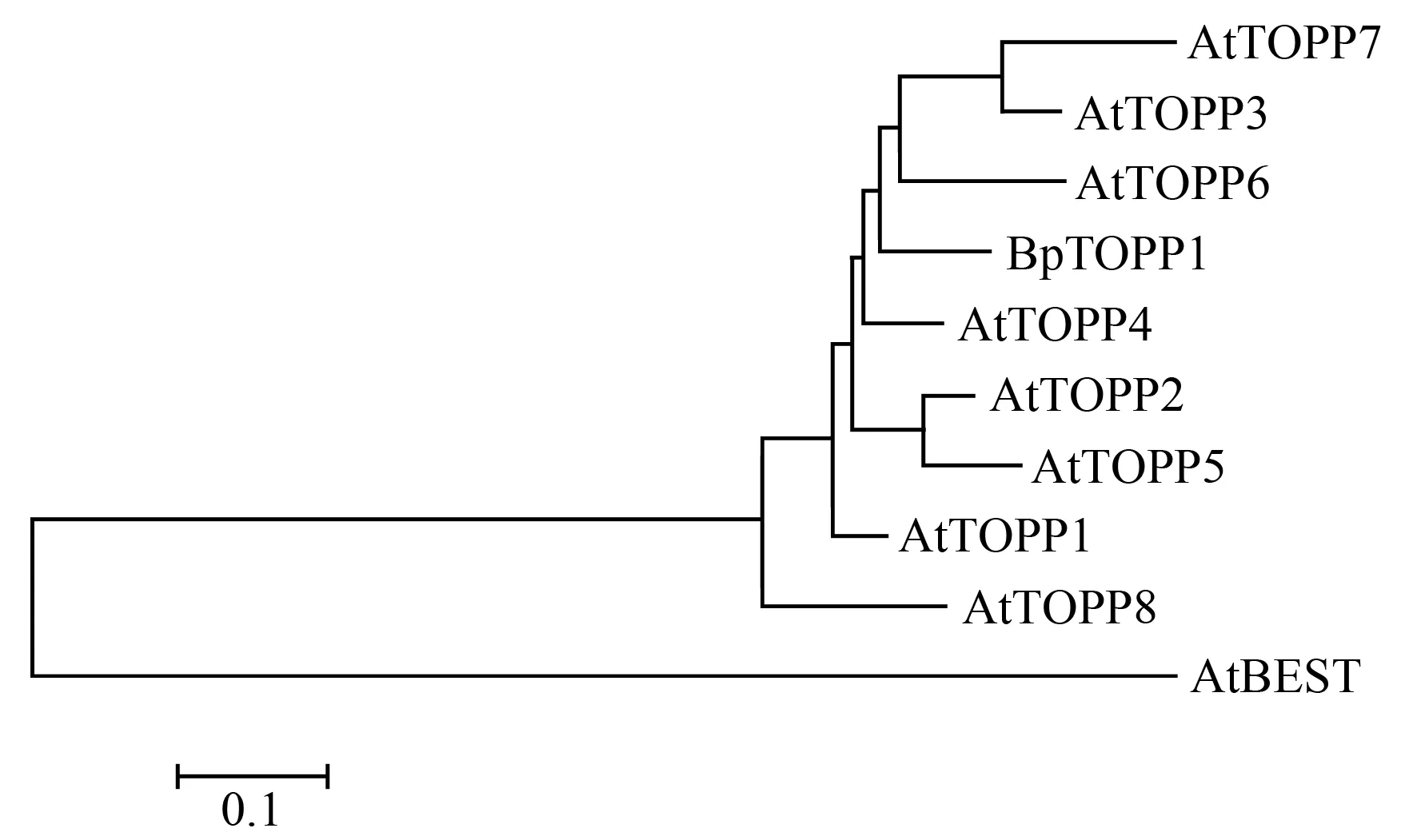
图2 BpTOPP1进化树分析
2.2 BpTOPP1基因在野生型欧洲白桦和裂叶桦中的表达模式
为了更好的了解BpTOPP1基因在白桦生长发育过程中的作用,试验分析了BpTOPP1基因在欧洲白桦和裂叶桦中的表达模式。不同组织器官qRT-PCR结果显示,在欧洲白桦中,只有L2叶片的BpTOPP1基因呈现上调表达,其表达量是对照的2.03倍;该基因在其他组织部位中均呈现显著下调表达(P<0.05,F=1 307),其表达量的平均值低于对照的84.13%(图3)。在裂叶桦中,该基因在第3幼茎及L1~L4叶柄呈上调表达,其表达量平均值是对照的1.83倍,在V2叶脉中该基因的表达量无明显差异;而在其他组织部位均呈现下调表达,其表达量的平均值低于对照的62.88%(图3)。通过测定BpTOPP1基因在两种桦树中的表达量,推测该基因与白桦叶片的生长发育相关。
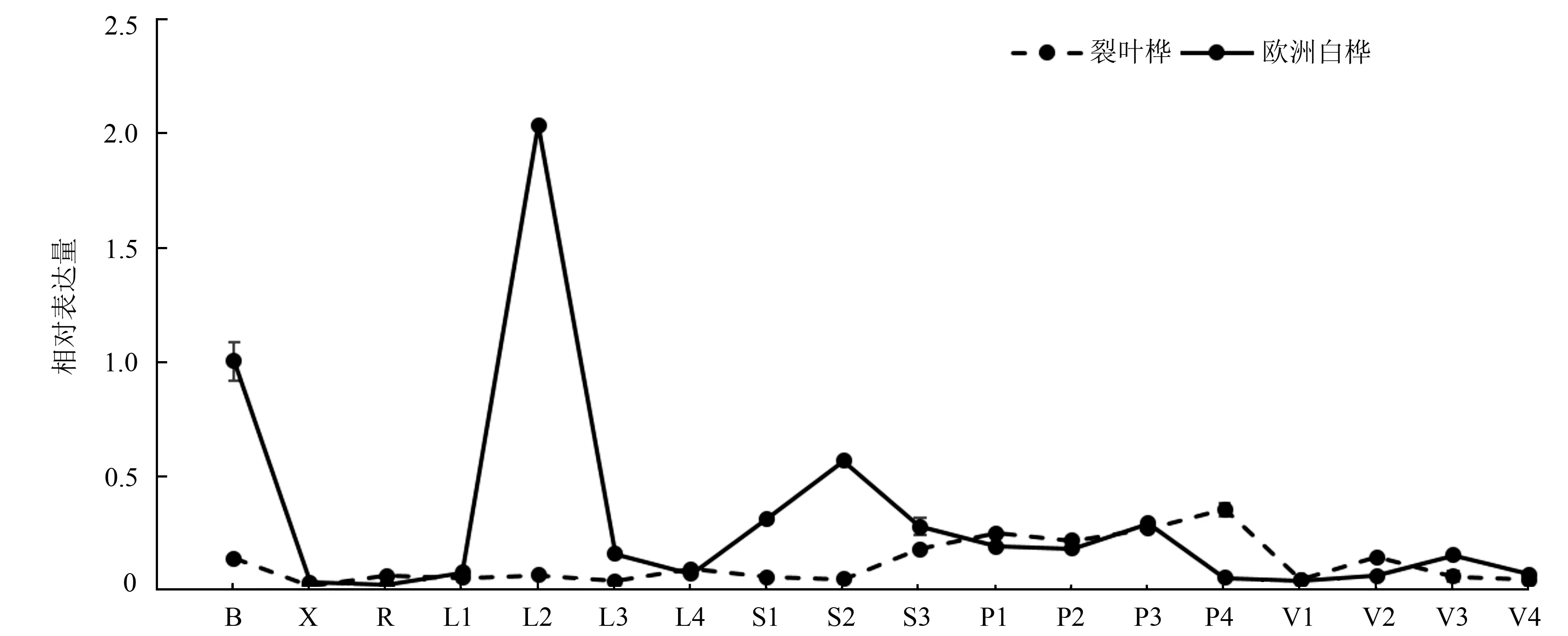
植物组织部位
为了能更进一步了解BpTOPP1基因在白桦的生长发育过程中的作用,试验又分析了不同时期BpTOPP1基因在裂叶桦和欧洲白桦叶片中的表达,结果见图4。若以5月5日两种桦树的第4片叶为对照,测定BpTOPP1基因的表达量,qRT-PCR结果显示,在不同的时期,BpTOPP1基因在两种桦树中均表达,在5月5和8月22日时,裂叶桦中该基因的表达量显著高于欧洲白桦,分别是欧洲白桦的4.24和11.1倍,而在7月21日时,该基因的表达量在欧洲白桦中显著高于裂叶桦,是裂叶桦的10.72倍。
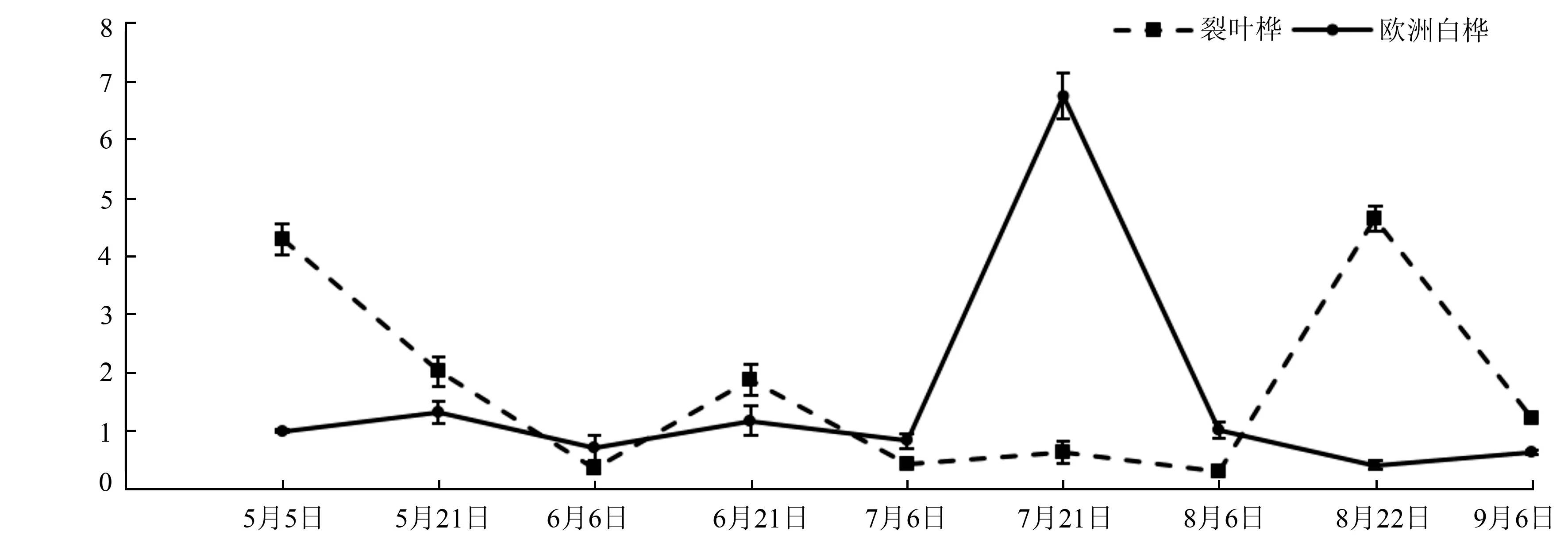
日期
2.3 35S::BpTOPP1转基因白桦的获得
采用双酶切的方法构建了BpTOPP1过表达载体,以野生型白桦的cDNA为模板,分别用KpnI和XbaI对BpTOPP1基因及1300质粒进行双酶切,将酶切纯化后的BpTOPP1与载体质粒1300进行连接,获得重组质粒,命名为35S::BpTOPP1。
BpTOPP1基因的遗传转化采用农杆菌介导合子胚的方法,将选取的种子在自来水下冲洗2~3 d,待种子充分吸水饱满后,即将露出芽点时,在超净工作台中对种子进行表面消毒。在无菌培养皿中纵切合子胚,去掉种皮,将切好的合子胚置于已经活化好的含有35S::BpTOPP1的工程菌液中,侵染白桦合子胚后共培养,然后进行选择培养。20 d后将获得的抗性愈伤组织转至分化培养基上培养,10~15 d长出抗性不定芽后转至继代培养基培养,30 d后长出潮霉素抗性丛生苗,10~15 d可以获得生根苗,将生根苗移栽至育苗盘中,获得35S::BpTOPP1转基因白桦6个株系,命名为TO-1…TO-6(图5)。
2.4 35S::BpTOPP1转基因白桦的分子检测
试验获得6个35S::BpTOPP1遗传转化子,分别提取潮霉素抗性株系的1年生苗木的总DNA,以中间载体质粒1300为阳性对照,WT为阴性对照,同时设水对照,对潮霉素抗性植株进行PCR扩增检测(图6)。结果显示,6个35S::BpTOPP1潮霉素抗性株系均在在942 bp处扩增出了单一条带,而WT株系没有扩增出条带(图6),因此可以初步判断,外源目的基因已经整合到白桦基因组中。
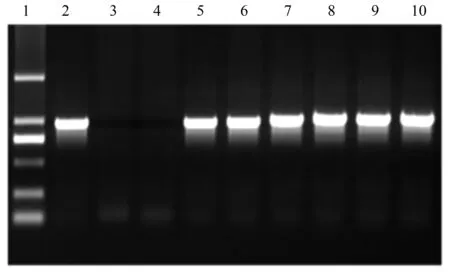
1.DNA Marker DL2000;2.阳性对照;3.阴性对照;4.水对照;泳道5~10为35S::BpTOPP1转基因的白桦。
为了检测外源基因在转基因白桦体内的稳定性遗传,对1年生的转基因白桦进行RT-PCR检测,结果显示(表2),35S::BpTOPP1转基因白桦中BpTOPP1基因的相对表达量均显著高于WT(P<0.05,F=17 970),6个株系中该基因的平均表达量是WT的8.12倍,其中TO-6株系中BpTOPP1基因的相对表达量最高,表达量是WT的18.75倍,可以进一步说明外源BpTOPP1基因在转基因白桦组织细胞中能够过量表达。
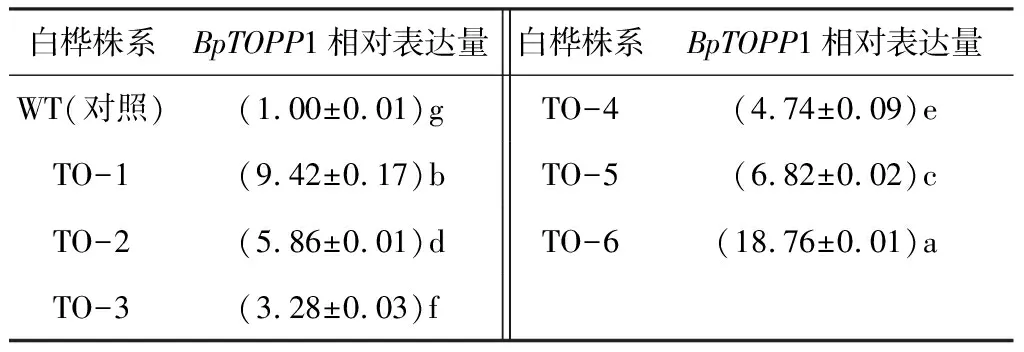
表2 转基因和非转基因对照白桦中BpTOPP1基因的表达特性
注:表中数据是平均值±标准差,数据后同列不同小写字母表示差异显著(P<0.05)。
2.5 35S::BpTOPP1转基因白桦的表型特征
对35S::BpTOPP1转基因白桦进行表型观察,结果发现,6个转基因白桦株系叶片延迟脱落(图7A),对相同时期的第1片叶进行观察发现,转基因植株的第1片叶正处于生长期(图7C、D),而WT植株的第1片叶已经发育成成熟叶片,叶片表面革质化(图7B);扫描电子显微镜观察发现,转基因株系叶脉上分布较多表皮毛(图7D、F),而WT株系叶脉上则少见表皮毛(图7E)。

A.转基因株系和非转基因对照株系的叶片脱落情况;B.非转基因对照白桦的第一片叶;C、D.转基因白桦的第一片叶;E.非转基因对照白桦叶脉的表皮毛;F、G.转基因白桦叶脉的表皮毛。
2.6 35S::BpTOPP1转基因植株生长形状
获得的6个1年生的35S::BpTOPP1转基因株系,可以观察到转基因株系的叶片变小(表3),转基因植株与WT株系差异明显,叶面积平均值为21.32,低于WT叶面积的42.2%(P<0.05,F=298.531),对转基因株系进行叶片长度和宽度调查,转基因株系的叶片长度和宽度也显著低于WT,其叶片长度的平均值是5.74 cm,低于WT叶片长度的30.42%(P<0.05,F=1 519),其叶片宽度的平均值是4.41 cm,低于WT叶片宽度32.31%(P<0.05,F=837.846)(表3)。
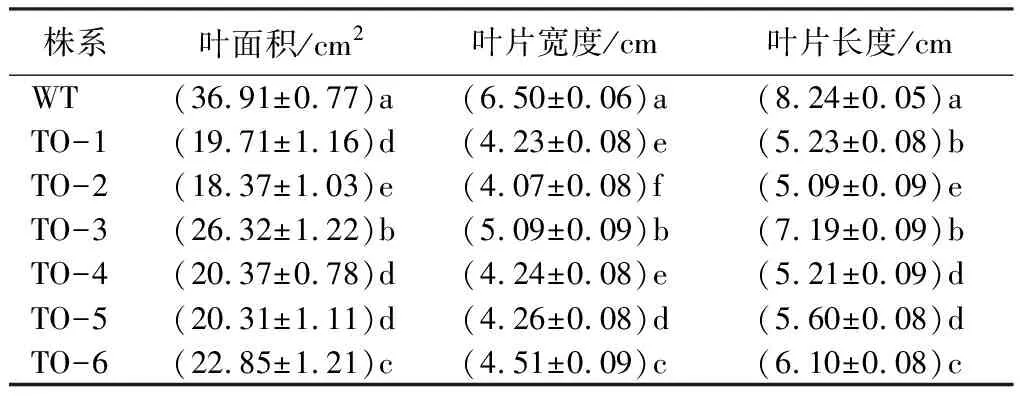
表3 1年生BpTOPP1转基因白桦的叶面积及叶片长宽
注:表中数据是平均值±标准差,数据后同列不同小写字母表示差异显著(P<0.05)。
转基因白桦苗高、地径及叶绿素质量分数比较,对1年生的6个35S::BpTOPP1转基因白桦进行苗高和地径的方差分析,结果显示,2个性状在株系间的差异均达到了显著水平,在苗高生长方面,6个转基因株系均显著低于WT株系,其平均苗高为WT的80.28%,其中转基因株系TO-2的苗高最矮,仅为WT的57.41%(P<0.05,F=118.902);在地径生长方面,除TO-1株系外,其他5个转基因株系地径均显著高于WT株系,其中TO-5株系地径高于WT的12.16%(P<0.05,F=53.424);叶绿素相对质量分数调查显示,转基因株系TO-2、TO-4、TO-5和TO-6等4个转基因株系显著高于WT株系(P<0.05,F=34.319),其均值高于WT的1.05倍,TO-1、TO-3转基因株系与WT株系差异不明显(表4)。

表4 1年生BpTOPP1转基因白桦的苗高地径及叶绿素比较
注:表中数据是平均值±标准差,数据后同列不同小写字母表示差异显著(P<0.05)。
3 结论与讨论
叶片是植物体营养器官中对环境变化最为敏感的器官,是植物进行光合作用和蒸腾作用的主要器官[27-29]。其形态、结构和生理特性易受水分、温度、光照等环境因素的影响,不同环境条件下植物的叶片形态结构差异很大,如:强光生境下,植物叶片小而厚、叶片内部栅栏组织发达;弱光条件下,叶片形态大而薄、比叶质量小;高温环境下,植物体现出叶片较厚、气孔密度大、比叶面积增加等适应特征[30-31]。本研究克隆的BpTOPP1基因,该基因在木本植物中研究较少,在拟南芥研究证明,TOPPS基因参与植物的生长和发育的各个过程,主要在根、莲座叶和花中表达[15],拟南芥TOPP4基因在幼苗中是高表达的,而且该基因在叶片中形成表皮扁平细胞相互交错起到关键作用,通过抑制TOPP4基因的表达量会出现矮化的表型[32-33]。本研究发现,在相同条件下过表达株系中BpTOPP1基因的表达量较非转基因对照有明显的提高;过表达株系的叶片面积、叶长和叶宽均显著小于野生型对照;因此,认为该基因对于白桦叶片的生长发育起到重要的作用。对获得转基因白桦的生长性状进行调查发现,其高生长比较缓慢,显著低于野生型对照植株,BpTOPP1基因在参与叶发育调控的同时是否也参与调控植物的高生长,其调控途径如何,这些还需深入研究。
欧洲白桦和裂叶桦的时空表达分析表明:在分部位表达中,BpTOPP1基因在欧洲白桦L2叶中的表达量显著高于其他组织,其表达量高于对照的103.36%,在裂叶桦中该基因主要在叶脉中呈现上调表达,其平均值为对照的1.97倍;在时序表达中,7月21日时BpTOPP1基因在欧洲白桦中的表达量达到峰值,在5月5日和8月22日时该基因在裂叶桦中的表达量较高。根据该基因在两种桦树时空表达分析推测该基因与叶发育相关。
目前,在植物中已确定了多种蛋白激酶和蛋白磷酸酶,其中蛋白磷酸酶和蛋白激酶一样能对生物体内的有关代谢起重要的调节作用[34]。在拟南芥中研究发现ABA信号转导通路的新的组成部分,即1型蛋白磷酸酶1(TOPP1)及其调控蛋白AtI-2,它们在ABA信号转导通路中起负调控作用,而这种抑制可通过AtI-2加强[17]。本研究发现,随着植物停止生长,转基因白桦出现叶片延迟脱落的现象,因此推测BpTOPP1基因在在ABA信号转导通路中起作用。
本研究主要对BpTOPP1过表达转基因白桦及非转基因对照进行表型分析,探讨BpTOPP1基因与白桦生长发育的关系,为揭示该基因在白桦生长和叶发育中行使的功能提供参考。当然,植物的叶发育过程中涉及到多条基因的调控,基因间的关系也极其复杂,因此我们团队将继续探讨BpTOPP1基因在叶片的生长发育过程中的作用,进一步阐明BpTOPP1基因的功能。
