超高压提取玫瑰花色苷及稳定性研究
2018-08-13张唯严成张曦金叶青段旻燕吴映川
张唯,严成*,张曦,金叶青,段旻燕,吴映川
(1.西南科技大学 生命科学与工程学院,四川 绵阳 621010;2.丽江程海沁香玫瑰庄园有限公司,云南 丽江 674100;3.丽江永胜森源食品有限公司,云南 丽江 674200)
玫瑰(RosarugosaThunb),是蔷薇科蔷薇属植物,是重要的香料植物[1]。我国的玫瑰资源大部分利用于天然香料玫瑰精油的提取上,然而玫瑰花中的花青素、多糖、黄酮类等物质是值得去探索研究的[2-8]。花色苷是广泛存在于植物中的一种活性成分,是一种功能性着色剂,具有改善视觉、抗肥胖症、抗糖尿病、抗癌症、抗心血管疾病等生理功效[9-13]。玫瑰花色苷颜色艳丽、香气馥郁,且含有生理功效,玫瑰花色苷的综合开发利用具有广阔的应用价值。
常用的花色苷提取方法包括有机溶剂提取法[14-16]、酶提取法[17,18]、微波辅助提取法[19,20]、超声波辅助提取法[21,22]、高压脉冲电场法等[23,24]。超高压辅助提取法[25],因其有效成分提取率高,且保留其生理活性,降低能耗,工艺操作简单且安全等特点[26],广泛应用于中药材的提取。
本试验采用超高压法提取玫瑰花色苷,以柠檬酸浓度、压力、保压时间、料液比为主要因素,通过响应面法优化提取工艺;同时探讨了各因素对玫瑰花色苷的稳定性影响,旨在为玫瑰花色苷的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
法国墨红玫瑰:丽江程海沁香玫瑰庄园有限公司;柠檬酸、氯化钠、磷酸二氢钠、过氧化氢、氯化钾、硝酸铝、亚硫酸钠:均为分析纯。
1.2 仪器与设备
DHG-9070A电热恒温鼓风干燥箱 巩义市瑞力仪器设备有限公司;高速粉碎机 陕西盛安医疗器械有限公司;UV1901型紫外可见分光光度计 四川亿科实验设备有限公司;便携式pH计 上海平轩科学仪器有限公司;台式离心机 上海安亭科学仪器厂;HH-2恒温水浴锅 常州澳华仪器有限公司;HPP.L2-800/1型食品超高压设备 天津华泰森淼生物工程技术股份有限公司;DZ-280/2SD小型多功能真空封装机 温州卓越机电源头厂家。
1.3 试验方法
1.3.1 玫瑰花预处理
玫瑰花经挑选除杂,粉碎过80目筛,得玫瑰花干粉。
1.3.2 玫瑰花色苷提取工艺流程
玫瑰花粉→称重(1.00 g)→提取剂溶解→超高压提取→离心→取上清液→稀释→测定吸光值。
1.3.3 玫瑰花色苷含量的测定
采用消光系数法测定玫瑰花色苷含量[27]。将离心得到的花色苷粗提液,在紫外分光光度计300~700 nm范围内扫描,确定玫瑰花色苷的最大吸收波长。根据下列计算玫瑰花色苷提取量:
花色苷提取量(mg/100 g)=[(A×V)/(98.2×M)]×100。
式中:A为吸光值;V为定容体积(mL)×稀释倍数;M为样品重量(g);98.2为花色苷平均消光系数。
1.3.4 单因素试验
分别以不同的提取剂浓度、压力、保压时间和料液比为单因素,以玫瑰花色苷提取量为指标,考察各因素对玫瑰花色苷提取量的影响。
1.3.4.1 提取剂浓度对花色苷提取量的影响
在压力为200 MPa、保压时间为9 min、料液比为1∶25(g/mL)的条件下,柠檬酸浓度分别为0.5%,1%,5%,10%,15%,20%时,考察提取剂浓度对花色苷提取量的影响。
1.3.4.2 压力对花色苷提取量的影响
在柠檬酸浓度为5%、保压时间为9 min、液料比为1∶25(g/mL)的条件下,压力分别为50,100,200,300,400,500 MPa时,考察压力对花色苷提取量的影响。
1.3.4.3 保压时间对花色苷提取量的影响
在柠檬酸浓度为5%、压力为200 MPa、料液比为1∶25(g/mL)的条件下,保压时间分别为3,6,9,12,15,18 min时,考察保压时间对花色苷提取量的影响。
1.3.4.4 料液比对花色苷提取量的影响
在柠檬酸浓度为5%、压力为200 MPa、保压时间为9 min时,料液比分别为1∶15,1∶20,1∶25,1∶30,1∶35,1∶40(g/mL)时,考察料液比对花色苷提取量的影响。
1.3.5 响应面试验设计
在单因素试验的基础上,建立Box-Behnken 中心组合试验,见表 1。
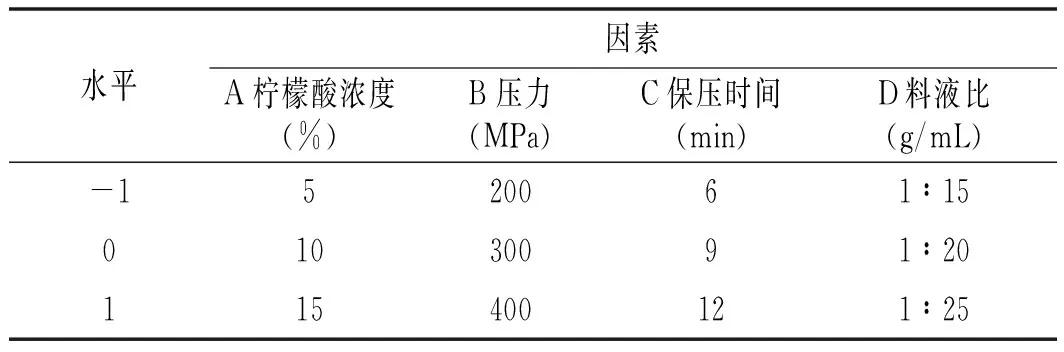
表1 响应面试验设计Table 1 Response surface experimental design
1.3.6 玫瑰花色苷稳定性试验
1.3.6.1 pH对玫瑰花色苷稳定性的影响
将提取液稀释适宜倍数后,加入盐酸溶液和氢氧化钠溶液制成pH 1.0~8.0的花色苷溶液,待溶液颜色稳定后,测定其吸光值。
1.3.6.2 温度对玫瑰花色苷稳定性的影响
将稀释相同倍数的花色苷溶液,分别置于20,40,60,80,100 ℃水浴锅中,每隔1 h测定其吸光值。
1.3.6.3 常见金属离子对玫瑰花色苷稳定性的影响
配制离子浓度为0.1,0.2,0.3,0.4,0.5 mol/L的Na+,K+,Ca2+,Cu2+,Zn2+,Fe2+,Mg2+,Al3+,Fe3+的花色苷溶液,室内避光静置,每隔1 h测定其吸光值。
1.3.6.4 氧化剂和还原剂对玫瑰花色苷稳定性的影响
分别配制质量分数为0.1%,0.2%,0.3%,0.4%,0.5%的亚硫酸钠的花色苷溶液和体积分数为0.2%,0.4%,0.6%,0.8%,1%的过氧化氢的花色苷溶液,以不加亚硫酸钠和过氧化氢的花色苷溶液做对照,室温避光静置,每隔1 h测定其吸光值。
1.3.7 数据处理
试验数据用软件Origin 8.5和Design-Expert 8.0.6.1进行分析。
2 结果与分析
2.1 玫瑰花色苷的最大吸收波长

图1 玫瑰花色苷溶液最大吸收光谱图Fig.1 The maximum absorption spectrum of rose anthocyanins solution
玫瑰花色苷提取液在300~700 nm的吸收光谱图见图1,在514 nm波长处有最大吸收峰。因此,选用 514 nm为玫瑰花色苷的最大吸收波长。
2.2 单因素试验
2.2.1 提取剂浓度对玫瑰花色苷提取量的影响

图2 柠檬酸浓度对花色苷提取量的影响Fig.2 Effect of citric acid concentration on anthocyanins extraction
由图2可知,在提取过程中柠檬酸浓度对花色苷提取量影响较大,随着柠檬酸浓度的增大花色苷提取量呈现先增加后缓慢降低的趋势。柠檬酸浓度达到10%时,花色苷pH值为1.58,提取量达到最高值,为943.24 mg/100 g。当柠檬酸浓度大于10%后,提取量降低。故选择10%柠檬酸溶液的浓度为最佳提取溶剂。
2.2.2 超高压压力对玫瑰花色苷提取量的影响

图3 压力对花色苷提取量的影响Fig.3 Effect of pressure on anthocyanins extraction
由图3可知,在提取过程中花色苷提取量呈现出先上升后下降的变化趋势。超高压压力在300 MPa时提取量最高,达到856.78 mg/100 g。当压力大于300 MPa后,提取量降低,这是因为在压力为300 MPa时,花色苷已经基本达到了溶解平衡状态,再提升压力,可能会使其他杂质释放出来。故选择压力300 MPa时为最佳提取压力。
2.2.3 保压时间对玫瑰花色苷提取量的影响

图4 保压时间对花色苷提取量的影响Fig.4 Effect of dwell time on anthocyanins extraction
由图4可知,花色苷提取量随着时间的延长呈现出先增加后缓慢下降的变化趋势。在保压时间为9 min时提取量达到最高,为803.86 mg/100 g。再增加保压时间,花色苷提取量开始缓慢下降,表明在9 min时花色苷已基本达到溶出的平衡状态,而时间延长会增加能耗和使花色苷产生降解。故选择的最佳保压时间为9 min。
2.2.4 料液比对玫瑰花色苷提取量的影响

图5 料液比对花色苷提取量的影响Fig.5 Effect of solid to liquid ratio on anthocyanins extraction
由图5可知,花色苷提取量随料液比的增加呈现出先上升后下降的明显变化趋势。在料液比为1∶25(g/mL)时,花色苷提取量达到最高值945.14 mg/100 g,若继续增大料液比,花色苷提取量反而降低。从提取效果和溶剂成本的角度综合考虑,选用1∶25(g/mL)为最佳料液比。
2.3 响应面试验结果
2.3.1 响应面试验方案设计与结果
根据单因素试验的结果,响应面试验设计与结果见表 2。

表2 响应面试验设计与结果Table 2 Experimental design and results of response surface analysis

续 表
应用Design-Expert 8.0.6.1软件对表2的试验数据进行多元回归拟合分析,得到超高压提取条件与玫瑰花色苷提取量间的多项式回归方程:
Y=871.25+112.55A+8.61B-37.11C+17.37D-45.96AB-18.41AC+3.97AD-53.94BC+92.89BD+11.25CD-70.33A2+1.73B2+44.08C2-44.57D2。
对回归方程进行了显著性检验分析,结果见表3。

表3 回归方程方差分析Table 3 Regression equation analysis of variance

续 表
注:“**”表示差异极显著(P<0.01);“*”表示差异显著(P<0.05)。
由表3可知,花色苷提取率试验设计该模型整体呈极显著(P<0.0001),能够正确反映玫瑰花色苷提取量(Y)与柠檬酸浓度(A)、压力(B)、保压时间(C)及料液比(D)之间的关系;失拟项不显著(P=0.4008>0.05);一次项A,C,D和二次项A2,C2,D2对响应值的影响均极显著(P<0.01),交互项AB,AC,BC,BD极显著(P<0.01)。该试验模型R2=0.9952,RAdj2=0.9905,表明此模型可以解释99.05%响应值Y的真实变化,试验误差小,表明模型的选择是合理的。各单因素对响应值Y的影响大小顺序为A>C>D>B。
2.3.2 两因素间的交互作用分析
由表3 可知,AB,AC,BC和BD的交互作用呈极显著,其响应曲面图见图6。由图6中2个参数响应面的陡峭曲面程度可知,在固定柠檬酸浓度和保压时间在零水平时,料液比和压力交互作用最显著(图6中a),其次依次是压力和保压时间(图6中b)、压力和柠檬酸浓度(图6中c)、保压时间和柠檬酸浓度(图6中d)。




图6 两因素交互作用对花色苷提取量的影响Fig.6 Response surface plots of variable parameters on anthocyanins extraction
2.3.3 最佳工艺条件
对试验结果进行工艺优化,得到最佳试验条件为:柠檬酸浓度13.2%,提取压力400 MPa,保压时间6 min,料液比为1∶25(g/mL);在此条件下进行验证,花色苷提取量为1089.42 mg/100 g,与预测值相近,说明用Box-Behnken响应面法能较好地反映超高压条件下玫瑰花色苷的提取量。
2.4 玫瑰花色苷稳定性试验结果
2.4.1 pH对玫瑰花色苷稳定性的影响

图7 pH对玫瑰花色苷稳定性的影响Fig.7 Effect of pH on the stability of rose anthocyanins
由图7可知,在玫瑰花色苷溶液pH值为1~8的条件下,为pH值在1~3范围时,吸光值变化不明显,当pH值为4时,吸光值开始呈现下降趋势,在pH值达到5以后,吸光值开始显著下降。玫瑰花色苷在pH值为1~3的条件下稳定性较好,更适合花色苷的加工与储藏。
2.4.2 温度对玫瑰花色苷稳定性的影响

图8 温度对玫瑰花色苷稳定性的影响Fig.8 Effect of temperature on the stability of rose anthocyanins
由图8可知,玫瑰花色苷在20~60 ℃范围时,在温度升高和时间延长的同时,花色苷溶液的颜色和吸光值没有显著的变化,从 80 ℃开始,吸光值变化较为明显,溶液颜色变成浅粉色,到了100 ℃时变化则更加大,溶液几乎变成无色。因此玫瑰花色苷不宜在高温的环境下保存和使用,而在60 ℃内热稳定性良好。
2.4.3 常见金属离子对玫瑰花色苷稳定性的影响

图9 金属离子对玫瑰花色苷稳定性的影响Fig.9 Effect of mental ions on the stability of rose anthocyanins
由图9可知,Na+,K+对花色苷无显著变化,随着离子浓度的增加与时间的延长吸光值略有增加,溶液颜色变成浅红色,Al3+,Ca2+,Cu2+对花色苷有显著增色效应,吸光值明显增加,颜色变为鲜艳的玫瑰红色。Zn2+的吸光值与溶液颜色几乎无变化,Mg2+和Fe3+能够破坏花色苷的结构,使其降解,而含有Fe3+的溶液颜色变为暗绿色。因此,应避免花色苷与Mg2+和Fe3+的接触。
2.4.4 氧化剂和还原剂对玫瑰花色苷稳定性的影响

(a)不同浓度过氧化氢对玫瑰花色苷稳定性的影响

(b)不同浓度亚硫酸钠对玫瑰花色苷稳定性的影响图10 氧化剂和还原剂对玫瑰花色苷稳定性的影响Fig.10 Effects of oxidant and reducing agent on the stability of rose anthocyanins
由图10可知,H2O2和Na2SO3对花色苷的稳定性影响极大。加入Na2SO3溶液的吸光度急剧下降,颜色马上变为无色,加入H2O2溶液的破坏速度相对要迟缓,但加入H2O2浓度较高的溶液4 h后也变为无色。因此,玫瑰花色苷在生产加工和贮藏的过程中应避免与氧化剂和还原剂的接触。
3 结论
本文用响应面法对玫瑰花色苷的超高压提取条件进行优化,并且研究了玫瑰花色苷的稳定性。优化得到花色苷的最佳提取工艺参数为:柠檬酸浓度13.2%,压力400 MPa,保压时间6 min,液料比1∶25(g/mL),此条件下玫瑰花色苷提取量为1089.42 mg/100 g,与常用花色苷提取方法相比,提高了69.52%。稳定性研究的结果表明:玫瑰花色苷在pH为1~3的条件下比较稳定,60 ℃内的稳定性良好;氧化剂和还原剂会显著加快花色苷的降解,Zn2+,Na+,K+对花色苷无显著变化,Mg2+,Fe3+能够破坏花色苷的结构,使其降解,Al3+,Ca2+,Cu2+对花色苷有显著增色效应。因此,对玫瑰花色苷的开发利用,研制出高附加值产品,将会带动玫瑰产业的快速可持续发展。
