产L-丝氨酸谷氨酸棒杆菌诱变后突变基因对生长和产酸的影响
2018-08-10陈紫薇张晓梅史劲松许正宏
陈紫薇,张晓梅,史劲松,许正宏,2*
1(江南大学 药学院,江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)
L-丝氨酸是一种非必需氨基酸,在医药、食品、化妆品等领域有着广泛的应用,年需求量大约是3 000 t[1]。谷氨酸棒杆菌是食品安全级氨基酸生产菌株,广泛应用于L-谷氨酸、L-赖氨酸、L-缬氨酸等氨基酸的生产[2]。然而一般的谷氨酸棒杆菌却不能利用糖质原料发酵生产L-丝氨酸。
目前国内外对谷氨酸棒杆菌产L-丝氨酸的研究集中在其合成和降解途径的分子改造,STOLZ等以不产L-丝氨酸的谷氨酸棒杆菌ATCC13032为出发菌株,构建的重组菌以葡萄糖和果糖为混合碳源时L-丝氨酸产量36.2 g/L[3-4]。来书娟等在谷氨酸棒杆菌ATCC13032中加强表达3-磷酸甘油酸激酶(PGK),增加了L-丝氨酸前体3-磷酸甘油酸的合成,提高了L-丝氨酸的产量[5]。
本课题组前期从自然界中筛选得到1株能利用糖质原料发酵产L-丝氨酸的野生型谷氨酸棒杆菌SYPS-062,以它为出发菌株通过多轮化学诱变获得突变株SYPS-062-33a[6]。该突变株L-丝氨酸产量提高65%,达到11.0 g/L,副产物L-丙氨酸和L-缬氨酸的积累量也明显提高。进一步在突变株上解除L-丝氨酸合成途径关键酶反馈抑制,敲除降解途径,阻断和弱化副产物积累途径,所获得重组菌ΔSSAAI其L-丝氨酸摇瓶产量可以达到26.25 g/L,是野生型菌株的3.9倍。在5 L发酵罐上补料分批发酵,L-丝氨酸的产量达到42.62 g/L[7-8]。然而谷氨酸棒杆菌SYPS-062为什么会积累丝氨酸,突变株SYPS-062-33a高产机制并不清晰。对突变株SYPS-062-33a和野生型菌株SYPS-062进行全基因组测序,解析基因组与表型之间的关系,寻找新的菌株改造的靶点。与SYPS-062相比,SYPS-062-33a有25个基因发生突变,其中12个基因发生了非同义突变,对其中5个突变的基因做回复突变或者敲除的研究,发现其中丙酮酸脱氢酶亚基aceE点突变与突变株SYPS-062-33a丙氨酸、缬氨酸积累量增加有直接关系[9]。本研究在前期基础上,通过在高产L-丝氨酸菌株ΔSSAAI中分别敲除剩余7个发生突变的功能基因,进一步探讨其余7个突变基因对菌株产酸和生长的影响。
1 材料与方法
1.1 材料
1.1.1 菌株和引物
产L-丝氨酸的谷氨酸棒杆菌ΔSSAAI为研究室前期构建并保藏;大肠杆菌JM109为实验室保藏;谷氨酸棒杆菌敲除质粒pK18mobsacB为实验室保藏[10];大肠杆菌-谷氨酸棒杆菌穿梭表达质粒pDXW-10为王小元实验室馈赠[11]。实验涉及引物见表1。

表1 文中所用到的主要引物Table 1 Primers used in this study
注:酶切位点用下划线标注。
1.1.2 试剂
涉及DNA相关操作分子试剂盒均购于上海捷瑞公司;分子操作涉及到的工具酶均购于TaKaRa;蔗糖、磷酸二氢钠、琼脂粉等配制培养基的试剂均购于国药试剂有限公司;脑心浸液(BHI)、原儿茶酸、生物素等购于sigma公司;硫酸卡那霉素购于上海生物工程有限公司。
1.1.3 培养基
(1)LB 培养基(g/L):蛋白胨 10,酵母粉 5,氯化钠 10(固体培养基,琼脂粉 20);121 ℃灭菌20 min;
(2)种子培养基(g/L):脑心浸液 37,葡萄糖 20,(NH4)2SO410,MgSO4·7H2O 0.5,K2HPO40.2,NaH2PO40.3;
(3)发酵培养基(g/L):蔗糖 100,CaCO360,KH2PO43,(NH4)2SO430,MgSO4·7H2O 0.5,FeSO4·7H2O 0.02,MnSO4·H2O 0.02,原儿茶酸 0.03,生物素 5×10-5,盐酸硫胺素 4.5×10-4;115 ℃灭菌7 min;
(4)谷氨酸棒杆菌感受态培养基(g/L):蛋白胨 10,酵母粉 5,氯化钠 10,Tween-80 1,甘氨酸 25;121 ℃灭菌20 min;
(5)谷氨酸棒杆菌电转化培养基(g/L):蛋白胨 5,酵母粉 2.5,氯化钠 5,脑心浸液 18.5,山梨醇 91;121 ℃灭菌20 min;
(6)10%蔗糖筛选培养基(g/L):脑心浸液 37;蔗糖 100;(NH4)2SO410;MgSO4·7H2O 0.5;K2HPO40.2;NaH2PO40.3;琼脂粉 20;灭菌条件:115 ℃,7 min。
1.2 方法
1.2.1 重组质粒的构建
敲除质粒的构建:以敲除基因SD36_RS01255为例,将谷氨酸棒杆菌ΔSSAAI基因组作为模板,利用引物1255-1/2,1255-3/4分别扩增基因SD36_RS01255上下游同源臂片段,然后以扩增得到的同源臂为模板利用引物1255-1/4进行二轮扩增,得到目的基因截短的同源臂。将得到的同源臂和敲除质粒pK18mobsacB用限制性内切酶EcoRI、XbaI双酶切,利用T4 DNA ligase连接,得到重组敲除质粒。
回复突变的重组质粒的构建:基因回复突变是利用质粒pK18mobsacB实现。以SYPS-062的基因组为模板,利用引物1255M-F/R扩增目的基因,目的基因和敲除质粒pK18mobsacB用限制性内切酶EcoRI、XbaI双酶切,利用T4 DNA ligase连接,得到回复突变的重组质粒。
过表达质粒的构建:以谷氨酸棒杆菌ΔSSAAI基因组为模板,利用引物1255-for/rev扩增基因SD36_RS01255,将目的基因片段和质粒pDXW-10用限制性内切酶EcoRI、pstI双酶切,利用T4 DNA ligase连接,得到重组质粒。
1.2.2 重组菌的构建
敲除与回复突变重组菌的构建:制备ΔSSAAI电转化感受态细胞,将相应的重组质粒电转入ΔSSAAI感受态细胞,电转化条件1.8 kV、5 ms,在谷氨酸棒杆菌电转化培养基中加入适量的硫酸卡那霉素(50 mg/mL)筛选阳性转化子,阳性转化子在10%蔗糖培养基进行二次筛选,得到的转化子进行PCR扩增或者测序验证。
过表达重组菌的构建:制备ΔSSAAI电转化感受态细胞,将重组过表达质粒电转入ΔSSAAI感受态细胞,电转化条件1.8 kV、5 ms,在谷氨酸棒杆菌电转化培养基中加入适量的硫酸卡那霉素(50 mg/mL)筛选阳性转化子,最终提取质粒,通过PCR及双酶切验证,得到过表达重组菌。
1.2.3 发酵参数的测定
生物量的测定:发酵液用1 mol/L HCl稀释至一定浓度,紫外分光光度计检测OD562。
L-丝氨酸和糖浓度的测定:采用HPLC测定发酵液中糖及L-丝氨酸产量[8]。
2 结果与分析
2.1 差异基因分析及基因敲除菌株的构建
2.1.1 突变株SYPS-062-33a和野生型菌株SYPS-062差异基因分析
SYPS-062-33a与SYPS-062比较基因组学研究结果表明,有12个基因发生了非同义突变,对其中5个突变的基因做回复突变或者敲除的研究,发现其中丙酮酸脱氢酶亚基aceE点突变与突变株SYPS-062-33a丙氨酸、缬氨酸积累量增加有直接关系[9]。本文对剩余7差异基因进行研究分析。SYPS-062-33a和野生型菌株SYPS-062的7个突变基因见表2。

表2 SYPS-062-33a与SYPS-062差异基因分析Table 2 The variant genes between SYPS-062-33a andSYPS-062
2.1.2 基因敲除菌株的构建
利用pk18mobsacB敲除质粒在ΔSSAAI基因组上分别敲除7个差异基因,构建重组菌ΔSSAAIΔ1,ΔSSAAIΔ2,ΔSSAAIΔ3,ΔSSAAIΔ4,ΔSSAAIΔ5,ΔSSAAIΔ6,ΔSSAAIΔ7。利用PCR扩增验证,结果如图1A所示,泳道1,3,5,7,9,11,13对应ΔSSAAI编号1~7基因扩增的片段明显长于泳道2,4,6,8,10,12,14敲除重组菌编号1~7基因扩增的片段,所以基因敲除重组菌构建成功。
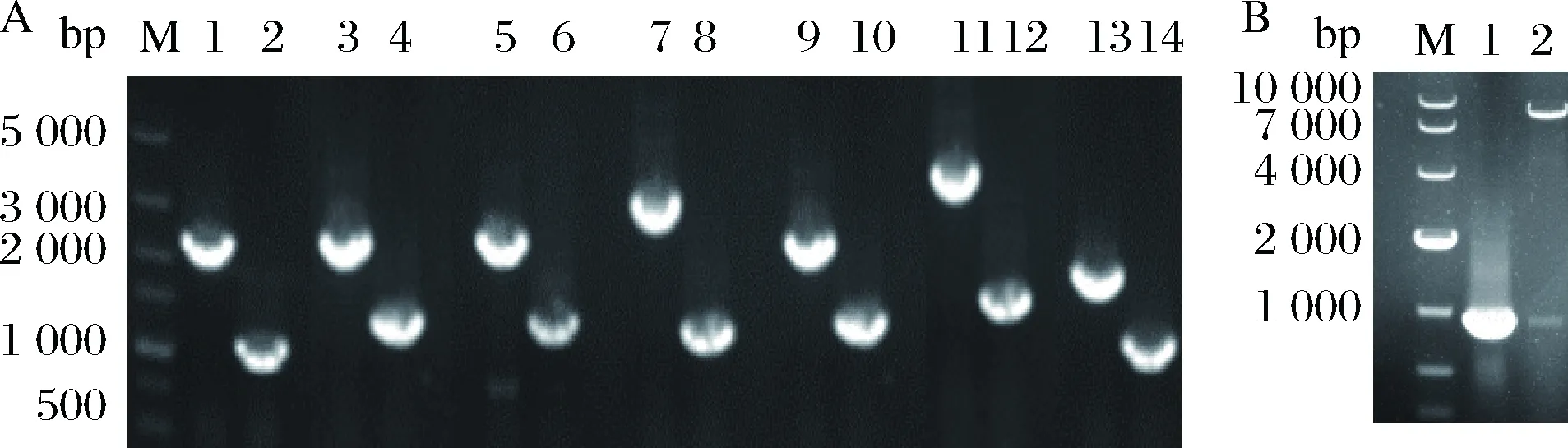
A-敲除重组菌验证:M-marker;1,3,5,7,9,11,13-对照菌株PCR扩增结果;2,4,6,8,10,12,14-敲除菌株PCR扩增结果;B-过表达重组菌验证:M-marker;1-PCR扩增验证;2-双酶切验证图1 重组菌构建结果Fig.1 Verification of recombinant strains
2.2 基因敲除菌株的发酵
在以100 g/L蔗糖为底物的发酵培养基中比较基因敲除菌株和出发菌ΔSSAAI的发酵性能。如图2所示,分别敲除编号为1,4,5基因,发酵120 h时,L-丝氨酸的产量和菌体生长与对照菌株ΔSSAAI相比未见明显变化;敲除基因2后,菌体生长与对照ΔSSAAI相比提高了5.2%,L-丝氨酸的产量无明显变化;分别敲除基因6,7后,L-丝氨酸的产量和菌体的生长都略有降低,说明敲除这几个基因对菌株ΔSSAAI生长和L-丝氨酸产量的影响并不显著。但是敲除基因3后,构建的重组菌株ΔSSAAIΔ3只积累19.52 g/L的L-丝氨酸,与对照菌株相比下降26.4%。在整个发酵阶段,重组菌生长以及糖耗也都有显著下降,对照菌ΔSSAAI在24 h就进入了对数生长期,菌体快速地增长,而ΔSSAAIΔ3在24 h时还处于迟滞期,菌体增长缓慢。发酵到120 h时,其最大生物量OD562为38.70,而对照菌株OD562为52.14,下降25.8%。由此可见敲除基因3后,会引起菌株迟滞期延长,导致重组菌生长缓慢和产酸下降(图3)。
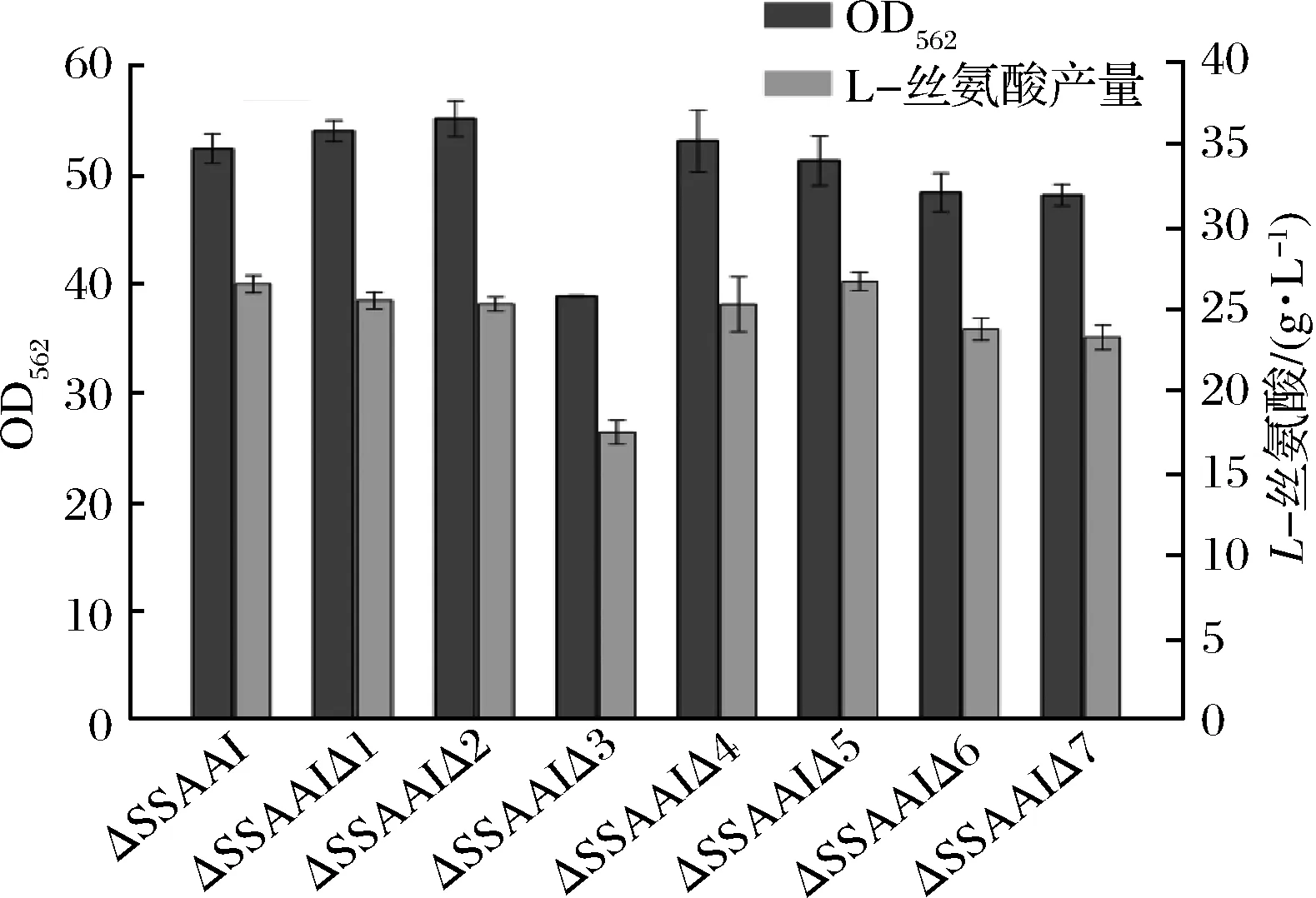
图2 基因敲除重组菌L-丝氨酸的产量和生长Fig.2 L-serine production and cell growth of gene deletion recombinant strains
基因3敲除引起L-丝氨酸的产量、生长以及糖耗都有显著下降,但是单位菌体的产酸量与对照相比并没有显著变化,而氨基酸作为初级代谢产物,产量的积累与生长是呈偶联关系,所以基因3敲除后,很有可能是通过影响菌体的生长,导致L-丝氨酸的产量下降。然而基因3的功能没有注释,无法定位其参与的代谢途径,随后将在ΔSSAAI中对基因3进行回复突变,分析其对生长和产酸的影响。
2.3 回复突变对ΔSSAAI发酵的影响
利用pk18mobsacB质粒,参照1.2.2构建基因3回复突变重组菌ΔSSAAI(3L24P),在发酵培养基中评价其发酵特性。如图3所示,发酵120 h时,ΔSSAAI(3L24P)的OD562为49.40,积累24.62 g/L的L-丝氨酸,与对照相比分别下降5.3%,7.2%。说明基因3的突变对菌株生长和产酸确实有一定的影响,随后将进一步分析基因3编码的蛋白功能,研究加强表达基因3对ΔSSAAI生长及发酵产酸的影响。

A-生长; B-L-丝氨酸产量;C-糖耗图3 基因3敲除与回复突变重组菌发酵特性Fig.3 Fermentation profile of gene three deletion and reverse mutation recombinant strain
2.4 基因3编码的蛋白质理化性质及功能的预测
基因3序列全长897 bp,共编码298个氨基酸,蛋白质分子量为32 839 Da,通过DNAMAN软件预测理论的等电点pI为4.17。DNAMAN软件分析亲水性/疏水性的结果如图4-A所示。由图4-A可知,亲水和疏水性的氨基酸在肽链上分布较为均匀。利用在线工具SOPMA(https://prabi.ibcp.fr/htm/site/web/home)对二级结构进行预测分析,基因3编码的多肽链可以形成α-螺旋,β-折叠,β-转角,无规卷曲4种二级结构,主要以无规卷曲和α螺旋为主,分别占39.93%和35.57%。
利用NCBI网站(https://www.ncbi.nlm.nih.gov/)提供的BLAST在线工具[12],将基因3的蛋白序列与已知的蛋白序列进行比对,初步预测蛋白的功能。基因3编码的蛋白序列经过BLAST比对后得到结果见图4-B。比对的结果显示,基因3编码的蛋白的47~137氨基酸的组成与毛根农杆菌(Agrobacteriumrhizogenes)质粒pRiA4b ORF-3编码的蛋白类似。这个家族的一些蛋白被注释为lexA调节子, 含有与lexADNA结合的结构域。lexA能够阻遏沉默SOS应答,SOS应答与DNA 的修复有关[13],使细菌的分裂受到抑制,影响细菌的生长。同样JOCHMANN等在C.glutamicumATCC13032中敲除lexA,发现菌株生长明显减弱,迟滞期明显延长[13]。由此我们推测基因3的功能与DNA修复有关。

图4 基因3编码蛋白的特性Fig.4 The characteristics of the protein encode by gene 3
2.5 过表达基因3对ΔSSAAI发酵的影响
基因3的敲除导致ΔSSAAI的生长和L-丝氨酸的产量均有下降,继而通过过表达基因3研究其对ΔSSAAI生长及发酵产酸的影响。参照1.2.2构建过表达重组菌ΔSSAAI-3,提取质粒通过PCR扩增和酶切验证表明重组菌构建成功(图1-B),随后在发酵培养基中评价其发酵特性。如图5所示,ΔSSAAI-3与对照相比,其生长、L-丝氨酸的产量以及糖耗未发生显著变化。说明基因3过表达对ΔSSAAI发酵性能没有显著影响,推测其原因是基因3编码蛋白的本底表达量就能满足菌体的需求。

A-生长;B-L-丝氨酸产量;C-糖耗图5 基因3过表达重组菌发酵特性Fig.5 Fermentation profile of gene three overexpression recombinant strain
3 结论
本课题组在前期研究中,以谷氨酸棒杆菌SYPS-062为出发菌,通过诱变得到高产L-丝氨酸的突变株SYPS-062-33a。对突变株SYPS-062-33a和出发菌株SYPS-062进行比较基因组学分析,发现12个基因发生了非同义突变,将其中5个突变的基因做回复突变或者敲除的研究,发现其中丙酮酸脱氢酶亚基aceE点突变与突变株SYPS-062-33a丙氨酸、缬氨酸积累量增加有直接关系。本文对其余7个发生突变的基因进行研究,利用基因敲除的手段在高产L-丝氨酸菌株ΔSSAAI进行7个基因研究,发现敲除基因3构建的重组菌ΔSSAAIΔ3,菌株生长、L-丝氨酸的产量显著下降。对基因3编码的蛋白进行理化性质分析,与NCBI数据库蛋白比对后,发现敲除基因3可能影响菌体DNA修复,从而造成生长缓慢,影响L-丝氨酸的产量。而在ΔSSAAI中采用质粒加强表达基因3,对ΔSSAAI的生长、L-丝氨酸的产量未造成显著影响,今后将对基因3编码的蛋白的功能进行深入研究,探索敲除基因3对菌体生长和产酸影响的机制。
