氯化血红素比色法检测乳制品中土霉素
2018-08-10李咏富吴远根
石 彬,李咏富*,吴远根
(1.贵州省现代农业发展研究所,贵州 贵阳 550006;2.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025)
土霉素(oxytetracycline,OTC)又称5-羟基四环素、地霉素、地灵霉素、氧四环素等[1],作为一种重要的四环素类抗生素,土霉素具有广谱抗生活性[2],对畜禽类疾病的防治和治疗具有很好的效果,在养殖行业使用广泛[3]。但由于利益的驱使,近年来土霉素在养殖行业存在滥用的现象。目前已经有人在水体中检出了土霉素等类四环类抗生素,现有技术无法对其进行有效的处理[4-5]。在我国,每年有数千吨土霉素被用于兽药的生产中。过量的土霉素会残留在动源性食品中,随食物链进入人体,损害人体的皮肤、免疫系统以及造成肝肾损伤等[6],并可能会诱导具有超强抗药性的病菌产生,威胁公共卫生安全,对人类健康造成巨大的威胁[7-10]。为了有效地监管土霉素的残留,许多国家对动源性食品中土霉素的含量都做出了严格规定[11-12]。传统的土霉素检测方法主要有微生物检测法、色谱检测法以及免疫学方法等。这些方法虽然基本上能够满足检测的要求,但是存在着耗时、设备昂贵、需要标准品、特异性差、样品前处理繁琐等不同的缺点[13],因此建立一种快速、简便的新检测方法显得十分重要[14]。
氯化血红素(hemin)是一种由原卟啉IX与铁(II)络合形成的化合物,具有辣根过氧化物酶活性。在以3,3',5,5'-四甲基联苯胺(tetramethylbenzidine,TMB)和双氧水(H2O2)作为底物时,可以通过改变氯化血红素催化活性,使底物因为失电子情况不同而产生不同颜色的产物。有文献报道[15]利用氯化血红素催化活性成功建立了一种水体三价砷的比色检测方法,分别得到0.6 μg/L和0.77 μg/L两组最低检测限度。本研究将氯化血红素的催化特性运用于土霉素的检测,以期建立一种基于氯化血红素检测的土霉素的方法,为快速、简便检测乳制品中土霉素提供思路。
1 材料与方法
1.1 材料与试剂
土霉素、二甲基亚砜(dimethyl sulfoxide,DMSO)、氯化血红素(hemin):上海生工生物有限公司;双氧水、TMB(分析纯):Sigma-Aldrich公司;硫酸链霉素(streptomycin sulfate,STR)、双氯芬酸钠(diclofenac sodium,DIC)、阿莫西林(amoxicillin,AMX)、卡马西平(carbamazepine,CBZ)、硫酸卡那霉素(kanamycin sulfate,KAN)、青霉素钾(ben zylpenicillin potassium,PEN)(均为分析纯):上海阿拉丁生化科技股份有限公司;牛奶样品:内蒙古伊利实业集团股份有限公司。
1.2 仪器与设备
TUS-200P振荡型恒温金属孵育器:上海一恒科技有限公司;Multiskan GO酶标仪:Thermo Fisher Scientific公司;BS124S分析天平:德国Sartorius公司;SP-701 pH计:上海志荣电子科技有限公司;CT14RD高速台式冷冻离心机:上海天美科学仪器有限公司;Eppendorf Research移液枪:德国Eppendorf公司;NJ75-101-3A电热恒温鼓风干燥箱:上海久滨仪器有限公司。
1.3 方法
1.3.1 实验原理
氯化血红素(hemin)是人工合成的一种水溶性血红素的氯化物,在磷酸二氢钠缓冲溶液中,氯化血红素具有辣根过氧化物酶活性,在H2O2存在时可以催化3,3',5,5'-四甲基联苯胺(TMB)产生不同颜色的产物。当氯化血红素过氧化物酶活性较强时,底物TMB失去2个电子,生成黄色产物在波长450nm处展现特征吸收峰。当氯化血红素的过氧化物酶活性较弱时,TMB失去1个电子,生成产物呈蓝绿色,在波长450 nm处左右没有特征吸收峰。研究发现当催化反应体系中存在土霉素(OTC)时,氯化血红素的催化活性受到抑制,导致反应产物在波长450 nm处的吸光度值显著降低,生成蓝绿色产物。且OTC浓度与产物吸光度值下降的幅度(ΔA450nm)成正比,通过观察颜色变化或测定ΔA450nm,实现对OTC的定性和定量检测。实验原理如图1所示。

图1 氯化血红素催化检测土霉素原理示意图Fig.1 Schematic diagram of hemin catalytic for oxytetracycline detection
1.3.2 OTC含量检测条件优化
在1.5 mL离心管中,加入5 μL的待测样品,30℃恒温孵育10 min,随后向体系中加入5 μL不同浓度的氯化血红素溶液(10 μmol/L、15 μmol/L、17.5 μmol/L、20 μmol/L、22.5 μmol/L、25 μmol/L、30 μmol/L)充分混匀,30 ℃继续孵育30 min。随后向体系中加入不同pH值的磷酸二氢钠溶液(pH3.0、pH3.5、pH4.0、pH4.5、pH5.0)定容至500 μL。充分混匀后,向体系中加入10 μL H2O2与10 μL TMB溶液,混匀,然后分别取200 μL标准溶液和空白对照液置于96孔酶标板中,测定波长450 nm处的吸光度值,获得其吸收光谱。计算其在波长450 nm处与空白样品吸光度值差值ΔA450nm,根据标准曲线回归方程计算待测样品中OTC含量。
1.3.3 标准曲线的制作
取18支1.5mL离心管,分别加入5μL不同浓度的OTC标准液,使得整个检测体系中的OTC含量维持在0~400nmol/L,30℃恒温孵育10min,随后向体系中加入5μL优化后的氯化血红素溶液充分混匀,30℃继续孵育30min。随后向体系中加入优化后磷酸二氢钠缓冲溶液至500μL。充分混匀后,向体系中加入10 μLH2O2与10 μLTMB溶液,混匀,然后分别取200μL标准溶液和空白对照液置于96孔酶标板中,测定波长450nm处的吸光度值,获得其吸收光谱。以不同浓度的土霉素测定的ΔA450nm(不同浓度样品的吸光度值-空白样品的吸光度值)作图,做三组平行,取平均值,绘制OTC标准曲线。
1.3.4 牛奶样品预处理
取100mL牛奶样品加入NaOH溶液调节pH至8,充分混匀后超声5min,随后加入2%的三氯乙酸以消除钙离子的影响。混合物加入离心管中,8000r/min、4℃低温离心15min。取上清液,过滤,4℃保存备用。
2 结果与分析
2.1 OTC含量检测条件优化
2.1.1 催化体系检测可行性分析
对氯化血红素检测方法的可行性进行了研究。按照1.3.2的方法,选取5组不同催化条件,检测其在3 min时,波长300~800 nm范围内的吸光度图谱,结果如图2所示。
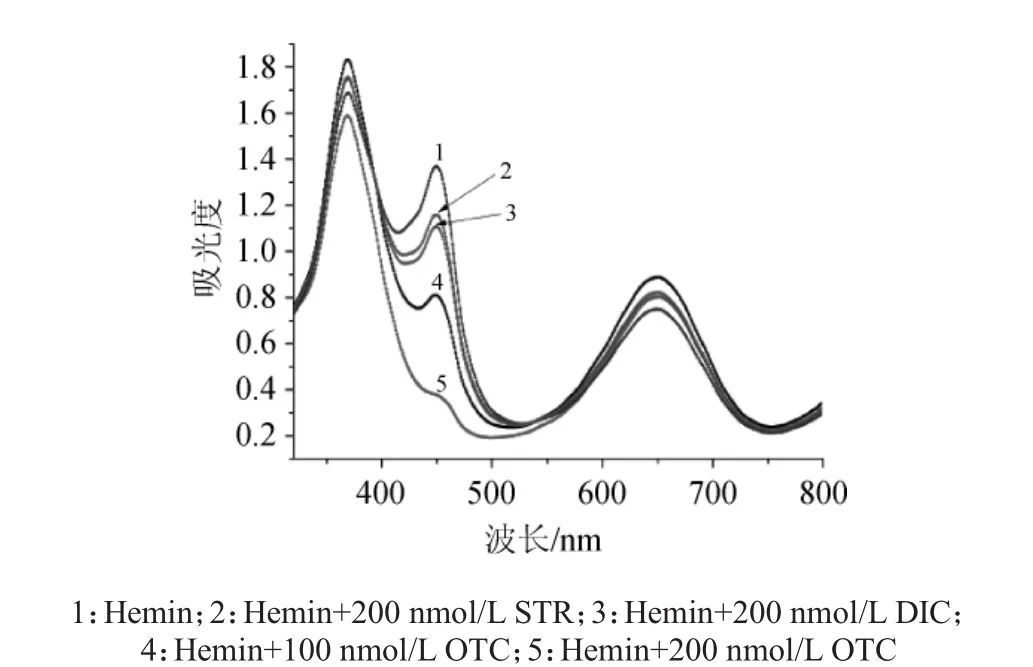
图2 不同催化条件对氯化血红素催化反应的影响Fig.2 Effects of different catalytic conditions on hemin catalytic reaction
由图2可知,当催化体系中不存在抗生素类物质时,氯化血红素的催化能力较强,反应产物在波长450 nm处的吸光度值达到1.4,生成产物颜色呈黄色;当体系中存在硫酸链霉素(STR)和双氯芬酸钠(DIC)时,A450nm显有下降,下降的幅度不明显,生成产物颜色偏黄色。当体系中存在OTC时,A450nm显著降低,生成产物偏蓝绿色。且200 nmol/L OTC体系的A450nm下降幅度明显大于100 nmol/L OTC体系,反应产物颜色也更绿。结果表明OTC能够有效降低氯化血红素的催化活性,且氯化血红素催化活性下降幅度与OTC浓度成正比,反应具有较好的特异性。
2.1.2 氯化血红素浓度的选择
在催化检测体系中,氯化血红素浓度是重要决定因素。通过氯化血红素浓度的优化,能够提高反应检测灵敏度,达到检测差异最大化。按照1.3.2的方法,采用单因素法,固定其他条件不变,分别选择氯化血红素浓度为10 μmol/L、15 μmol/L、17.5 μmol/L、20 μmol/L、22.5 μmol/L、25 μmol/L、30μmol/L,检测并计算各组样品的吸光度值差值ΔA450nm。检测时间间隔1min,检测时间10min,最大吸光度值差值记为ΔA450nmmax,结果如图3所示。
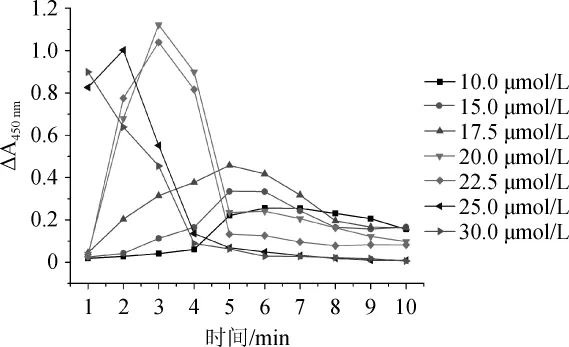
图3 不同氯化血红素浓度对催化反应的影响Fig.3 Effect of different hemin concentration on catalytic reaction
由图3可知,除了浓度30 μmol/L的氯化血红素催化体系外,其他浓度的氯化血红素体系反应产物ΔA450nm均随着时间的延长而先上升,达到峰值ΔA450nmmax后开始下降;当氯化血红素浓度<20 μmol/L时,浓度尚未饱和;随着氯化血红素浓度的升高,ΔA450nmmax的值逐渐增大;当氯化血红素浓度>20 μmol/L时,浓度达到饱和,由于电荷相互影响分子聚集等原因,随氯化血红素浓度升高,ΔA450nmmax的值逐渐减小。当体系氯化血红素浓度为20 μmol/L时,产物ΔA450nmmax的值达到最大,检测差异最明显;30μmol/L的氯化血红素由于浓度过大,导致催化反应产物ΔA450nm在1 min内已经达到峰值;因此最终选择氯化血红素浓度20μmol/L为最优检测浓度。
2.1.3 反应体系pH选择
pH变化对任何反应体系都有很大的影响,直接影响反应体系中分子的电离情况,pH过高或者过低,都不利于催化反应的进行。按照1.3.2的方法,固定其他条件不变,选择pH3.0、pH3.5、pH4.0、pH4.5、pH5.0的磷酸二氢钠缓冲液,检测并计算各组样品的吸光度值差值ΔA450nm。检测时间间隔1min,检测时间10min,最大吸光值差值记为ΔA450nmmax,结果如图4所示。

图4 不同反应体系pH值对催化反应的影响Fig.4 Effect of different pH value on catalytic reaction
由图4可知,随着时间的增加,ΔA450nm的值先升高,达到峰值后开始下降。当pH为3.0时,ΔA450nm在反应8 min左右达到最大值为0.39;当pH为3.5时,ΔA450nm在4 min时达到最大值为1.05;当pH分别为4.0、4.5和5.0时,ΔA450nm分别在反应3 min、3 min和2 min时达到最大值,分别为0.80、0.59和0.21。结果表明,在一定pH范围内,随着体系磷酸二氢钠缓冲液pH的升高,ΔA450nm达到峰值的时间逐渐缩短;pH值为3.5时,ΔA450nmmax达到峰值,催化产物检测差异达到最大。pH值过高或过低时,催化体系中分子基团的电离情况发生变化,催化活性发生改变,检测差异变小。故最终选择pH 3.5为体系最优pH值。
2.2 标准曲线的制作
根据优化的结果,选择氯化血红素浓度为20 μmol/L,磷酸二氢钠缓冲液pH为3.5,在0~400nmol/L范围内选择不同浓度的OTC标准品,按照1.3.3的方法,对其在波长450nm处的吸光度值进行检测。以OTC的浓度(C)为横坐标,ΔA450nm(Y)为纵坐标,绘制OTC标准曲线,结果如图5所示。
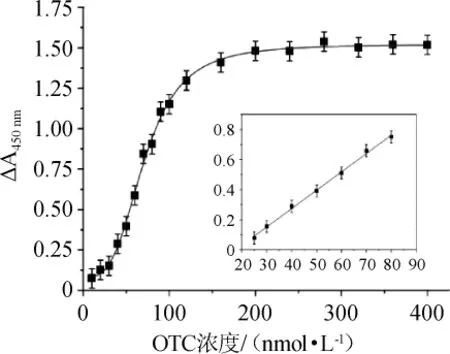
图5 土霉素标准曲线Fig.5 Standard curve of oxytetracycline
由图5可知,在OTC浓度在0~400nmol/L范围内,ΔA450nm与OTC浓度符合Logistic模型,具有良好的相关性,相关系数为0.997。在低浓度25~90 nmol/L的范围内,ΔA450nm与OTC浓度呈良好的线性关系,拟合方程为Y=1.04×10-3C+0.0622。由公式计算出最低检测限度为21.89 nmol/L,远远低于欧盟和美国食品药品监督管理局(food and drug administration,FDA)对牛奶中OTC的最大残留限量。
2.3 检测特异性研究
检测特异性考查检测方法的一个重要指标。为证实氯化血红素催化检测体系对OTC具有特异性的识别能力,即检测的特异性,考查了其他竞争性抗生素土霉素(OTC)、双氯芬酸钠(DIC)、硫酸链霉素(STR)、阿莫西林(AMX)、硫酸卡那霉素(KAN)、青霉素钾(PEN)这6不同种类的抗生素对检测体系的干扰情况。按照1.3.2的方法。分别向检测体系中加入200 nmol/L和100 nmol/L的不同种类的抗生素,测定其与空白样品在波长450 nm处的吸光度值差值ΔA450nm。以4 min时不同样品的ΔA450nm值作柱状图,结果如图6、图7所示。
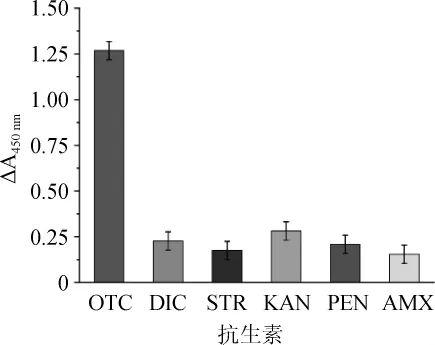
图6 200 nmol/L不同种类抗生素对土霉素检测的影响Fig.6 Effect of different antibiotics with concentration of 200 nmol/L on the detection of oxytetracycline
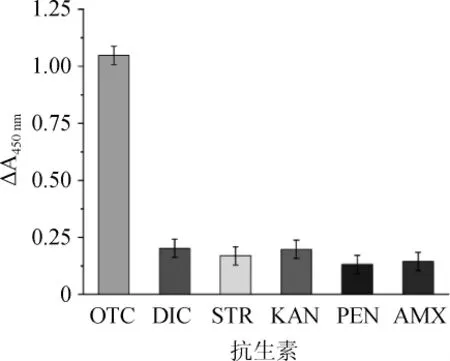
图7 100 nmol/L不同种类抗生素对土霉素检测的影响Fig.7 Effect of different antibiotics with concentration of 100 nmol/L on the detection of oxytetracycline
由图6可知,当OTC存在时,ΔA450nm的值最大,为1.26,显著高于其他抗生素;从反应颜色上判断,当体系加入200 nmol/L OTC时反应产物呈蓝色,而加入其他抗生素时则呈黄色。由图7可知,加入100nmol/LOTC时,产物的ΔA450nm为1.02,低于OTC浓度为200 nmol/L的体系,明显高于其他种类的抗生素。当体系加入100 nmol/L OTC时反应产物呈蓝绿色,而加入100 nmol/L的其他抗生素则呈黄色。表明该体系对OTC检测具有良好的选择性。
2.4 实际样品检测
按照1.3.4的方法对牛奶样品进行前处理,在空白牛奶样品中添加不同浓度的OTC标准液(50 nmol/L、80 nmol/L、100nmol/L、200nmol/L)。在最优条件下,测定4组不同浓度的标准品产物波长450 nm处的吸光度值,每个浓度样品重复测定3次,测定结果见表1。
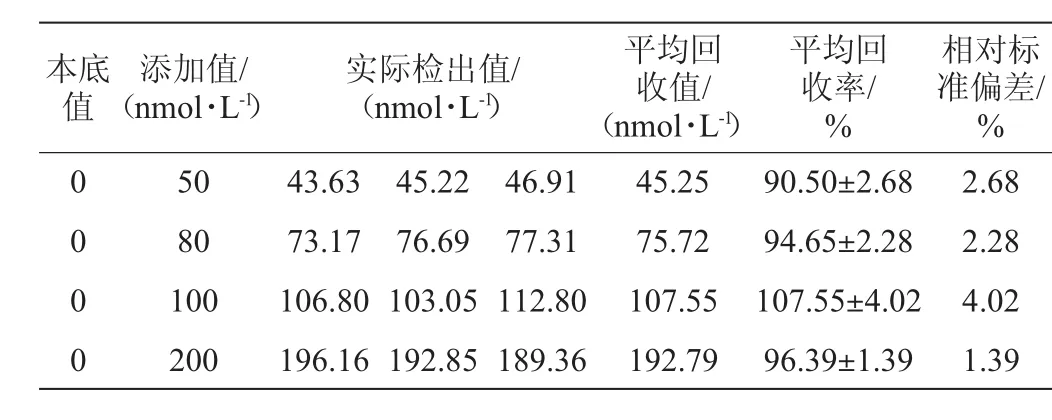
表1 牛奶样品中土霉素加标回收率试验结果Table 1 Results of adding standard recovery rate of oxytetracyclinein milk samples
由表1可知,其平均加标回收率范围为90.50%~107.55%,相对标准偏差(relative standard deviation,RSD)为1.39%~4.02%。实验结果表明,根据实际检测量所计算出的该方法的平均加标回收率和相对标准偏差均在残留实验准则允许的范围之内,具有良好的重复性和准确度,符合抗生素残留量分析和检测标准的技术要求,可以实现对OTC残留有效检测。
3 结论
利用氯化血红素的辣根过氧化物酶活性建立了一种新的OTC的快速检测方法。该方法具有快速、灵敏、操作简便、重复性好的特点,可用于乳制品中OTC的快速比色检测。
在氯化血红素浓度为20 μmol/L,pH值为3.5条件下,反应体系检测差异性达到最大,检测效果最好。最低检测限度为21.89nmol/L,远远低于国际上牛奶中OTC的最大残留限量规定。该方法对其他抗生素的抗干扰能力较强,同时具有良好的准确性和重复性,可以对OTC残留检测进行有效检测。
