灰树花胞外粗多糖脱色工艺优化及对α-葡萄糖苷酶抑制作用的影响
2018-08-10刘力萍吴天祥张宗启
刘力萍,吴天祥,2*,张宗启
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学 明德学院,贵州 贵阳 550025)
灰树花(Grifola frondosa)是一种药食兼用的珍稀菌类,又名贝叶多孔菌[1]。灰树花多糖作为其主要活性成分之一,具有抗肿瘤[2]、降血糖[3-4]、抗氧化[5-6]、免疫调节[7]等药理作用。
传统工艺提取的灰树花胞外多糖杂质多、颜色深,影响其进一步的分离纯化与结构鉴定,也不利于多糖作为功能性产品的研究与开发,因此对其进行脱色处理是极其必要的。多糖的脱色方法有过氧化氢法[8]、活性炭法[9]、树脂法[10]等。其中,过氧化氢法脱色是利用过氧化氢在水溶液中电离出过氧化氢根离子(HO2-)与发色基团作用,使得发色基团被破坏而起到脱色作用,但过氧化氢是强氧化剂,易使多糖结构发生改变,并影响多糖活性。活性炭法脱色是靠范德华力将色素吸附到自身表面,从而达到脱色目的,其在水和空气的净化中已得到广泛应用[11]。但用其脱色后残留的活性炭难以清除,对多糖品质有一定影响[12]。树脂是一种具有吸附性能的脱色剂,其理化性质稳定,反应条件温和,对色素具有较强的吸附力,但对糖类物质的吸附力较弱,因此被广泛应用于食药用真菌多糖的脱色提纯中,如香菇多糖、西洋参粗多糖等利用树脂进行脱色后均具有较为理想的脱色效果[13-14]。
α-葡萄糖苷酶抑制剂是一类通过竞争性抑制小肠粘膜刷状缘上的α-葡萄糖苷酶活性而起到降低餐后高血糖作用的口服药物[15-16]。相关研究表明灰树花多糖可作为一种天然的α-葡萄糖苷酶抑制剂,具有降血糖的作用[17]。
因此,本研究以多糖脱色率和保留率为评价指标,从8种大孔树脂中筛选出对灰树花胞外粗多糖脱色最佳的树脂,通过单因素试验和正交试验优化得到其最佳脱色条件,并探究脱色对多糖的α-葡萄糖苷酶抑制作用的影响,以期为灰树花胞外多糖的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
灰树花(Grifola frondosa)5.404:中国普通微生物菌种保藏管理中心(China general microbiological culture collection center,CGMCC)。
1.1.2 试剂
D315树脂、D914树脂、D208树脂、D303树脂、聚酰胺树脂:郑州勤实科技有限公司;AB-8树脂、D101树脂、D201树脂:天津光复精细化工研究所;α-葡萄糖苷酶(≥10 U/mg)、4-硝基酚-α-D-吡喃葡萄糖苷(4-N-trophenyl-α-D-glucopyranoside,PNPG)(纯度为99%):美国Sigma公司;阿卡波糖:拜耳医药保健有限公司;其余试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L、蛋白胨5 g/L、磷酸氢二钾3g/L、硫酸镁1.5g/L、水1000mL,pH自然。121℃灭菌30 min。
液体种子培养基:葡萄糖20 g/L、玉米粉10 g/L、麸皮10 g/L、KH2PO42 g/L、MgSO4·7H2O 2 g/L、CaCl21 g/L。121 ℃灭菌30 min。
液体发酵培养基:葡萄糖10 g/L、玉米粉5 g/L、麸皮10 g/L、KH2PO42 g/L、MgSO4·7H2O 2 g/L、CaCl21 g/L。121℃灭菌30 min。
1.2 仪器与设备
ZWY-C2112B型双层旋转式可编程恒温恒湿摇床:上海智诚分析仪器制造有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;L5S紫外可见光光度计:上海仪电分析仪器有限公司;SPECTRA MAX 190酶标仪:昆明纳瑞科技有限公司;CTFD-12S冷冻干燥机:青岛永合创信电子科技有限公司。
1.3 方法
1.3.1 灰树花胞外粗多糖的制备
斜面种子培养:从母种试管中切取黄豆粒大小的灰树花菌丝体于PDA斜面中部,25℃恒温培养,至菌丝长满整个斜面,转至4℃保存。
液体种子培养:在斜面菌种管中用接种勺取一勺细小菌丝体,接种于液体种子培养基中,装液量为100mL/250mL,于25℃、150 r/min摇床内培养6 d。
液体发酵培养:按10%(V/V)的接种量将液体种子液接种于发酵培养基中,装液量为100 mL/250 mL,于25℃、150 r/min摇床培养9 d。
灰树花胞外粗多糖的制备:灰树花发酵液经过滤得到上清液,旋转蒸发至总体积的1/5,加入4倍体积体积分数为95%的乙醇溶液,于4℃条件下静置24 h,4 000 r/min离心20 min,收集沉淀,55℃烘干至质量恒定,采用蒸馏水溶解于培养皿中,真空冷冻干燥,得到灰树花胞外粗多糖[18]。
1.3.2 树脂的筛选
树脂预处理:离子交换树脂(D315树脂、D914树脂、D208树脂、D303树脂、聚酰胺树脂)用体积分数为95%的乙醇溶液浸泡12 h,先用蒸馏水洗至流出液用水稀释不浑浊,再用质量分数为4%的NaOH溶液搅拌浸泡4 h(每10 min搅拌一次),使用蒸馏水反复洗至中性,最后再用质量分数为4%的HCl溶液搅拌浸泡4 h(每10 min搅拌一次),使用蒸馏水反复洗至中性。吸附树脂(AB-8树脂、D101树脂、D201树脂)用体积分数为95%的乙醇溶液浸泡12 h,使其充分溶胀,用蒸馏水反复洗至流出液用水稀释不浑浊、无醇味。
树脂的筛选:准确量取5.00 g经预处理的8种树脂于100 mL三角瓶中,分别加入用蒸馏水配制的灰树花胞外粗多糖溶液(10 mg/mL)20 mL,将溶液pH调节为6.0,于25℃、150 r/min摇床振荡24 h,过滤得到上清液,并于波长450 nm处测定其吸光度值并计算多糖脱色率。采用苯酚-硫酸法测定多糖含量[19],计算多糖保留率。筛选出最优树脂。多糖脱色率及保留率计算公式如下:

1.3.3 脱色工艺优化单因素试验
准确称取5.00 g经预处理的最优大孔树脂于100 mL三角瓶中,加入用蒸馏水配制的灰树花胞外粗多糖溶液20mL,采用单因素轮换法,选择树脂脱色时间、粗多糖质量浓度(2 mg/mL、5 mg/mL、10 mg/mL、15 mg/mL、20 mg/mL)、脱色温度(15℃、25℃、35℃、45℃、55℃、65℃)及脱色pH值(4.0、5.0、6.0、7.0、8.0、9.0),于150 r/min、25 ℃的摇床中振荡脱色,双层滤纸过滤得到上清液,计算其脱色率及保留率,考察4个因素对树脂脱色的影响。
1.3.4 脱色工艺优化正交试验
在单因素试验的基础上,以灰树花粗多糖脱色率(Y1)和保留率(Y2)为评价指标,选取脱色时间(A)、脱色温度(B)、脱色pH值(C)、粗多糖质量浓度(D)4个因素进行4因素3水平的正交试验。正交试验因素与水平见表1。

表1 灰树花胞外粗多糖脱色工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for decolorization process optimization of extracellular crude polysaccharides fromGrifola frondosa
1.3.5 灰树花胞外粗多糖对α-葡萄糖苷酶的抑制[20-21]
灰树花胞外粗多糖溶液的配制:用pH6.8的磷酸盐缓冲液(phosphatebuffersaline,PBS)将脱色前后的灰树花胞外粗多糖配成质量浓度分别为10 mg/mL、20 mg/mL、30 mg/mL、40 mg/mL、50 mg/mL的溶液。
α-葡萄糖苷酶活性抑制活性测定:取200μL粗多糖溶液,加入PBS200μL,1U/mL的α-葡萄糖苷酶液10μL,混匀,37℃恒温30 min,然后取出加入底物PNPG(10 mmol/L)200 μL,37℃恒温60 min,取出加入1 mol/L的反应终止液NaCO3溶液200 μL。在波长405 nm处测定其吸光度值。以10 mg/mL的阿卡波糖为阳性对照,测定脱色前后不同质量浓度灰树花胞外粗多糖对α-葡萄糖苷酶抑制率,其计算公式如下:

式中:ODA为粗多糖溶液反应体系的吸光度值;ODB为PBS替代酶液反应体系的吸光度值;ODC为PBS替代粗多糖溶液反应体系的吸光度值;ODD为PBS替代酶液和粗多糖溶液反应体系的吸光度值。
2 结果与分析
2.1 树脂的筛选
8种树脂对灰树花胞外粗多糖的脱色效果见表2。由表2可知,其中D201、D315、D101、D941树脂的脱色率均在80%以上,但D201树脂为强碱性阴离子交换树脂,对灰树花胞外粗多糖的吸附大,使得多糖保留率低,为42.13%。聚酰胺树脂的多糖保留率最高,为77.36%,但其脱色率较低,为47.29%,不适合用于灰树花胞外多糖脱色。而D315树脂在多糖脱色率和保留率两方面均较高,分别为87.83%和74.11%。因此,选择D315树脂进行单因素试验和正交试验。

表2 8种树脂的脱色能力比较Table 2 Comparison of decolorization capability of eight types of resin
2.2 灰树花胞外粗多糖脱色单因素试验
2.2.1 D315树脂的静态吸附色素动力学过程
D315树脂的静态吸附色素动力学曲线如图1所示。由图1可知,随着脱色时间的延长,D315树脂的脱色效果明显增强,脱色时间在300 min时,脱色率为83.13%,之后脱色率增加趋势缓慢,分析原因可能是色素的吸附与解析几乎达到平衡,脱色时间在360 min之后,脱色率基本稳定,为85.29%。因此,灰树花胞外粗多糖的最佳脱色时间为360 min。
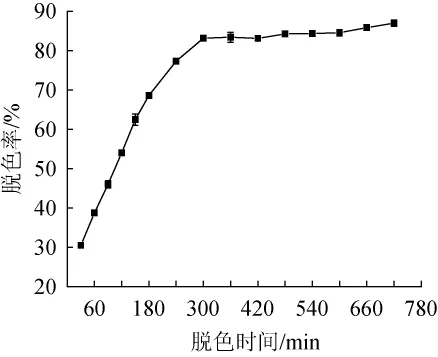
图1 D315树脂的静态吸附色素动力学曲线Fig.1 Kinetic curve of static adsorption of D315 resin on pigments
2.2.2 粗多糖质量浓度对D315树脂脱色的影响
粗多糖质量浓度对D315树脂脱色能力的影响结果如图2所示。由图2可知,随着粗多糖质量浓度的增加,脱色率逐渐降低,而多糖保留率逐渐增加,当质量浓度从2 mg/mL增加至25 mg/mL时,脱色率从85.95%降至73.63%,多糖保留率从79.27%增至86.74%。当样品质量浓度在10 mg/mL时,脱色率与多糖保留率分别为81.34%、83.77%。因此,粗多糖最适质量浓度为10 mg/mL。

图2 粗多糖质量浓度对D315树脂脱色能力的影响Fig.2 Effect of crude polysaccharide mass concentration on decolorization ability of D315 resin
2.2.3 脱色温度对D315树脂脱色能力的影响
脱色温度对D315树脂脱色能力的影响结果如图3所示。由图3可知,随着脱色温度的升高,脱色率逐渐增强,当脱色温度从15℃升至65℃时,脱色率从62.77%提高至83.74%。分析原因可能是温度增加,导致色素分子的扩散速度加快,从而有利于色素被D315树脂吸附;脱色温度在45℃之后,脱色率增加缓慢;并在55℃之后,脱色率趋于稳定,为83.29%。保留率随着温度的升高,变化不明显,温度在15~65℃时,保留率在82.13%~84.21%范围内。因此,选择D315树脂的最佳脱色温度为55℃。

图3 脱色温度对D315树脂脱色能力的影响Fig.3 Effect of decolorization temperature on decolorization ability of D315 resin
2.2.4 脱色pH值对D315树脂脱色能力的影响
脱色pH值对D315树脂脱色能力的影响如图4所示。由图4可知,偏酸性环境更有利于D315树脂的脱色。当溶液为碱性时,脱色率显著下降(P<0.01),当pH>7.0时,脱色率低于75.39%,当pH=9.0时,脱色率仅为64.74%。这可能是由于碱性环境使得色素分子性质发生改变,使得溶液颜色加深,从而脱色率下降。pH值对多糖保留率影响不大,pH值为4.0~9.0时,多糖保留率变化范围为81.61%~83.57%。因此,选择D315树脂的最佳脱色pH值为5.0。

图4 脱色pH值对D315树脂脱色能力的影响Fig.4 Effects of decolorization pH value on decolorization rate and polysaccharide retention rate of D315 resin
2.3 灰树花胞外粗多糖脱色工艺优化正交试验
在单因素试验的基础上,以灰树花粗多糖脱色率(Y1)和保留率(Y2)为评价指标,选取脱色时间(A)、脱色温度(B)、脱色pH值(C)、粗多糖质量浓度(D)4个因素进行4因素3水平的正交试验。D315树脂对灰树花胞外粗多糖脱色正交试验结果与分析见表3。

表3 灰树花胞外粗多糖脱色工艺优化正交试验结果与分析Table 3 Results and analysis of orthogonal experiments for decolorization process optimization of extracellular crude polysaccharides fromGrifola frondosa
由表3可知,各因素对灰树花胞外粗多糖脱色率影响的大小顺序为A>B>D>C,即脱色时间>脱色温度>粗多糖质量浓度>脱色pH值。以粗多糖脱色率为评价指标的最佳脱色条件组合为A3B3C2D2,即脱色时间420min,脱色温度55℃,脱色pH 5.0,粗多糖质量浓度10 mg/mL。在此条件下进行脱色,测得灰树花胞外粗多糖脱色率为90.61%,多糖保留率为78.23%。各因素对多糖保留率影响的大小顺序为D>A>B>C,即粗多糖质量浓度>脱色时间>脱色温度>脱色pH值。以多糖保留率为评价指标的最佳脱色条件组合为A1B3C2D3。在此条件下进行脱色,测得灰树花胞外粗多糖的脱色率为86.37%,多糖保留率为79.64%。
结果表明,灰树花胞外粗多糖脱色的最佳工艺参数为脱色时间420 min、脱色温度55℃、脱色pH值5.0、样品质量浓度10 mg/mL。在此条件下进行脱色,测得灰树花胞外粗多糖的脱色率为90.61%,多糖保留率为78.23%。
2.4 粗多糖对α-葡萄糖苷酶活性抑制作用的测定
脱色前后不同质量浓度的灰树花胞外粗多糖对α-葡萄糖苷酶的抑制作用的影响结果见图5。由图5可知,阳性对照阿卡波糖对α-葡萄糖苷酶具有极强的抑制作用,其质量浓度为10 mg/mL时,抑制率可达66.84%,脱色前后得到的灰树花胞外粗多糖均能一定程度抑制α-葡萄糖苷酶活性,并且灰树花胞外粗多糖浓度在10~50 mg/mL范围内,对α-葡萄糖苷酶的抑制作用与质量浓度呈正相关,脱色前的灰树花胞外多糖对α-葡萄糖苷酶的抑制率从17.72%增至34.62%,脱色后的灰树花胞外多糖对α-葡萄糖苷酶的抑制率从24.48%增至58.53%。脱色后的灰树花胞外粗多糖对α-葡萄糖苷酶的抑制作用显著提高(P<0.05)。这是由于色素等杂质的存在会阻碍灰树花胞外多糖对α-葡萄糖苷酶产生抑制作用。另外,利用大孔树脂处理后的多糖,还能一定程度的去除部分游离蛋白,有利于多糖的提纯[11]。通过D315树脂处理后的灰树花胞外多糖,达到了较满意的脱色率和较高的多糖保留率,同时也能一定程度提高其对α-葡萄糖苷酶的抑制作用。

图5 脱色前后的灰树花胞外粗多糖对α-葡萄糖苷酶的抑制作用的影响Fig.5 Effects ofGrifola frondosaextracellular crude polysaccharide before and after decolorization on α-glucosidase inhibition
3 结论
本研究以多糖脱色率和保留率为考察指标,采用静态吸附法比较D315、D941、D208、D303、聚酰胺、AB-8、D101、D201树脂8种树脂对灰树花胞外粗多糖的脱色效果,筛选出最适合用于灰树花胞外粗多糖脱色的大孔树脂为弱阴离子交换树脂D315。通过单因素试验和正交试验,优化D315树脂对灰树花胞外粗多糖脱色工艺参数为脱色温度55℃、脱色时间420 min、脱色pH 5.0、粗多糖质量浓度10 mg/mL。在此最优脱色条件下,灰树花胞外粗多糖的脱色率为90.61%,多糖保留率为78.23%,较优化前分别提高2.78%、4.12%。脱色前后灰树花胞外粗多糖对α-葡萄糖苷酶的抑制作用结果表明,脱色后的灰树花胞外多糖对α-葡萄糖苷酶抑制作用显著提高(P<0.05)。灰树花胞外多糖脱色的工艺研究为其产品的开发和利用提供一定参考。
