产乳酸乙酯酿酒酵母菌株的构建
2018-08-10任津莹郭庆焕陈叶福郭学武肖冬光
刘 港,李 洁,任津莹,郭庆焕,赵 东,陈叶福*,郭学武,肖冬光
(1.天津科技大学 生物工程学院天津市工业微生物重点实验室,天津 300457;2.中国轻工业浓香型白酒固态发酵重点实验室,四川 宜宾 644000)
白酒的主要成分是酒精和水,约1%~2%为对白酒风味起主导作用的微量成分,其中酯类物质又占这些微量成分的60%~90%[1]。适宜的乳酸乙酯含量对中国白酒的风味和质量至关重要。清香型白酒酯类化合物中乳酸乙酯仅次于乙酸乙酯,而对于老白干香型白酒和米香型白酒来说,乳酸乙酯含量高于乙酸乙酯,其在老白干香型的比例为1.5~2.2∶1,米香型白酒的乳酸乙酯含量≥0.3g/L[2-4]。传统白酒发酵过程中,通常以酿酒酵母(Saccharomyces cerevisiae)作为发酵主体,结合环境和自然制曲提供的产酯前体乳酸菌等微生物产生乳酸等有机酸,并与乙醇发生酯化反应生成酯类物质来提高白酒品质[5]。随着白酒工业的现代化发展,酿造技术的机械化越来越受到人们的关注,清洁生产和良好生产规范(good manufacturing practices,GMP)理念逐步在白酒行业应用,白酒行业将迎来重大的变革[6]。白酒生产机械化对一些传统工艺提出了新的挑战,同时意味着发酵过程中乳酸菌等微生物的带入几率下降,乳酸乙酯的生成量下降,严重影响白酒风味。因此,白酒机械化必须与发酵微生物的研发同步[7]。构建具有一定产乳酸进而生成乳酸乙酯能力的酿酒酵母菌株,不仅可以使发酵易于控制,而且可以增加乳酸乙酯的产量,弥补白酒的风味的不足,在特征饮料酒的酿造中大有用武之地。酵母改造产乳酸多应用于工业上聚乳酸生产,2003年COLOMBIÉ S等[8]将植物乳酸杆菌(Lactobacillus planetarium)的乳酸脱氢酶基因ldhL1整合到酿酒酵母基因组中,对发酵条件进行优化后重组菌株的L-乳酸产量达50g/L,为聚乳酸的生产提供大量的L-乳酸前体。2009年TOKUHIRO K等[9]在酿酒酵母中增加乳酸脱氢酶基因LDH的拷贝数至四拷贝,突变株的L-乳酸产量达74.1g/L,乳酸对葡萄糖的产率明显提高,达0.69g/g。国内尚未见酿酒酵母过表达乳酸脱氢酶生产L-乳酸进而产乳酸乙酯应用于白酒工业的研究报道。
本研究利用同源重组[10-11]技术,用植物乳杆菌的乳酸脱氢酶基因ldhL1替换酿酒酵母丙酮酸脱羧酶基因PDC1获得产L-乳酸进而生成乳酸乙酯的能力的重组菌株。并分别模拟液态白酒发酵和外源添加乳酸进行发酵,研究产乳酸菌株与出发株外源添加乳酸发酵产乳酸乙酯的差异。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
实验所用的菌株和质粒见表1。其中植物乳杆菌(Lactobacillus plantarum)用以乳酸脱氢酶基因ldhL1的扩增模板,pUG6质粒为筛选标记loxp-KanMX-loxp的扩增模板,pGAPza质粒用以筛选标记KanMX的丢除。
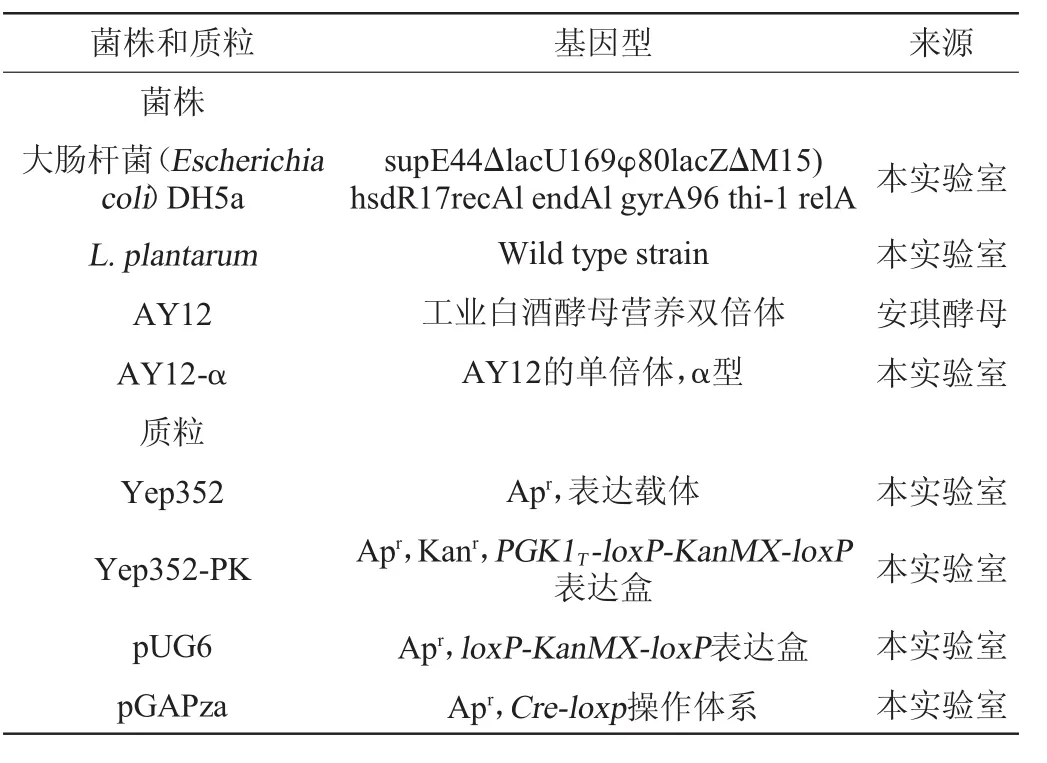
表1 菌株和质粒基因型以及来源Table 1 Genotype and sources of strains and plasmids
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖20.0 g/L,酵母粉10.0 g/L,蛋白胨20.0 g/L。
乳酸细菌培养基(MRS):蛋白胨10.0g/L,牛肉膏10g/L,酵母膏5.0 g/L,柠檬酸氢二铵2.0 g/L,葡萄糖20 g/L,吐温80 1.0mL/L,乙酸钠5.0g/L,磷酸氢二钾2.0g/L,硫酸镁0.58g/L,硫酸锰0.25 g/L,调节pH至6.2~6.6。
LB(Luria-Bertani)培养基:葡萄糖10 g/L,酵母粉5 g/L,蛋白胨10 g/L。
上述培养基配制固体培养基时加2%琼脂,121℃灭菌15 min。
半乳糖诱导液态培养基:半乳糖20.0 g/L,蛋白胨20.0 g/L,酵母浸粉10.0 g/L,121℃灭菌15 min。
一级种子培养基和二级种子培养基分别由糖度为8°Bx和12°Bx的玉米水解液加5 mg/L的酵母浸粉构成;发酵培养基为糖度为18°Bx的玉米水解液加适量营养盐组成。种子培养基及发酵培养基105℃灭菌15 min备用。
1.1.3 试剂
PrimeSTAR Max高保真脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(2×)、rTaq聚合酶(5 U/μL)、DNA连接酶SolutionI(350 U/μL)、限制性内切酶XbaI(5 U/μL)和BamHI(5 U/μL):大连宝生物工程有限公司;卡那霉素(kanamycin,Kan):美国Amreco公司;遗传霉素(G418):美国Merck公司;耐高温糖化酶(2×104U/mL)、液化酶(1×105U/mL)、酸性蛋白酶(1×105U/mL):丹麦Novozymes公司。质粒提取试剂盒、DNA纯化回收试剂盒、切胶回收试剂盒:北京Solarbio科技有限公司。
1.2 仪器与设备
PCT-200聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪、DYY-4c型电泳仪:美国BIO-RAD公司;AgilentGC7890气相色谱仪(gas chromatography,GC)、Agilent 1100型高效液相色谱仪(high performance liquid chromatography,HPLC):美国安捷伦科技有限公司。
1.3 方法
1.3.1 产乳酸乙酯菌株的构建
纯种酿酒酵母自身没有乳酸代谢的能力,不能进一步产乳酸乙酯。因此,本研究利用酿酒酵母PGK终止子和筛选标记KanMX,并用植物乳杆菌的乳酸脱氢酶基因ldhL1替换酵母的丙酮酸脱氢酶基因PDC1,以获得一株产乳酸进而具有产乳酸乙酯能力的菌株。
(1)引物设计
根据GenBank报导的PDC1、ldhL1基因的核苷酸序列,本实验所用到的PCR反应引物见表2。用Primer 5.0对引物进行设计,所有引物均由苏州金唯智有限公司合成,酶切位点加下划线表示。

表2 PCR引物及序列Table 2 PCR primers and their sequences
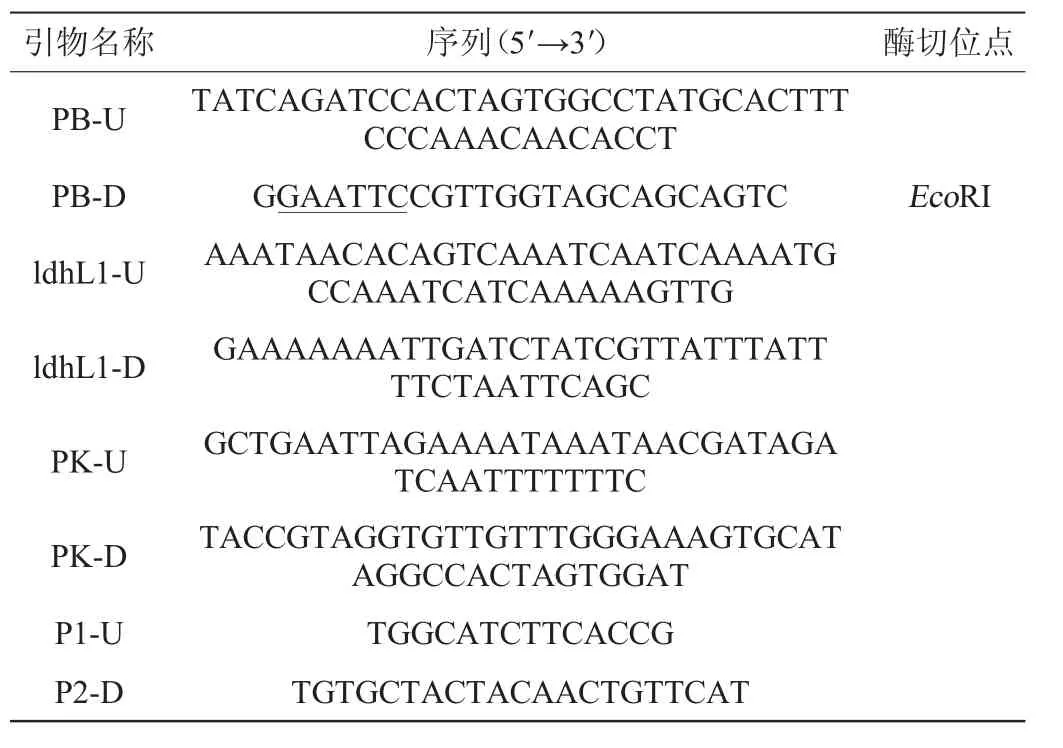
注:“U”表示上游引物,“D”表示下游引物。
(2)DNA提取及纯化
基因组DNA提取及DNA纯化回收参见文献[12];质粒提取方法参见文献[13]。
(3)重组质粒Yep352-PK的构建
以出发菌株AY12-α的基因组和质粒pUG6作为模板,分别扩增得到终止子PGK1T和筛选标记KanMX片段,将纯化的PGK1T和KanMX片段融合,得到融合片段PGK1T-KanMX。将纯化的PGK1T-KanMX片段和Yep352质粒分别用XbaI和BamHI酶切,回收后进行连接得到重组质粒Yep352-PK。构建的质粒Yep352-PK用以带乳酸脱氢酶基因IdhL1和下同源臂侧翼序列的PGK1T-KanMX片段的大量扩增,构建过程见图1。
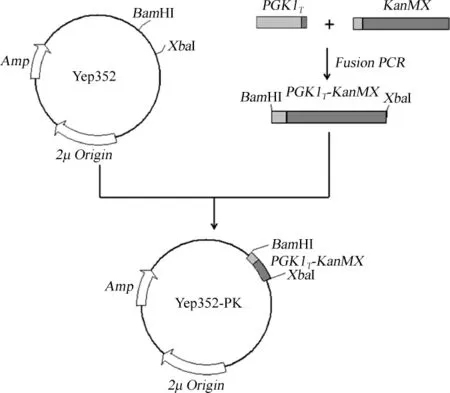
图1 重组质粒Yep352-PK的构建Fig.1 Construction of recombinant plasmid Yep352-PK
(4)醋酸锂化学转化[14]与重组菌株的鉴定
以酿酒酵母AY12-α的基因组作为模板,PCR扩增得到启动子兼上同源臂的PA及下同源臂PB片段;以植物乳杆菌的基因组作为模板,PCR扩增得到乳酸脱氢酶基因ldhL1片段;以质粒Yep352-PK作为模板,PCR扩增得到PGK1TKanMX片段。将纯化的片段:PA、ldhL1、PGK1T-KanMX和PB利用醋酸锂化学转化法导入酵母细胞AY12-α中。转化后的细胞涂布于终浓度为300 μg/mL G418的YEPD培养基上进行筛选,挑取转化子,提取基因组进行PCR验证。
(5)转化子筛选标记的去除
用醋酸锂化学转化法将PGAPza质粒导入突变株中,通过Cre-Lxop系统将整合到基因组上的抗性基因KanMX去除。
1.3.2 生长曲线绘制
分别从斜面上挑取1环菌株AY12-α和P接种于5 mL YEPD液体培养基中,30℃、180 r/min培养12 h。每隔1 h取相应量的活化菌体接入对应体积的新鲜YEPD液体培养基中,以不加菌液的空白培养基作为对照,在生长曲线测定仪中测定其波长600 nm处的吸光度值。以培养时间为横坐标,吸光度值为纵坐标,绘制菌株AY12-α和P生长曲线。
1.3.3 乳酸耐受性实验
从斜面刮取一环AY12-α菌株接种于5 mL的YEPD液体培养基中,30℃、180r/min过夜培养,高速离心收集菌体,并用无菌水洗两次。测定菌液的浓度并调节菌液的OD600nm值为1.0,同时对菌液进行10倍梯度稀释,依次取2 μL分别点滴于添加有1.0%、2.0%、2.5%、3.0%、3.5%、4.0%、6.0%乳酸的YEPD平板上,30℃静置培养2~3d,观察菌落形态。
1.3.4 发酵性能测定
(1)玉米液态白酒发酵:分别从4℃保藏的固体斜面挑取1环出发菌株AY12-α和重组菌株P接入装有5 mL一级种子玉米水解液培养基中,30℃静置培养至稳定期(约24 h)。将一级培养物全部转入装有45 mL二级种子玉米水解液培养基中,30℃静置培养16 h,测定菌液的OD600nm值,取相应的体积换算成相同的菌体数量接种到配制好的135 mL发酵培养基中。30℃培养箱静置发酵,每隔12 h称质量一次,发酵结束后分别测定CO2总质量损失、乙醇、乳酸、还原糖及酯类含量。
(2)外源添加乳酸发酵实验:一、二级种子的培养与(1)中一致,依据出发菌株AY12-α对乳酸的耐受性,确定乳酸的添加浓度,在发酵培养基中添加相应浓度的乳酸进行发酵。30℃培养箱静置发酵,每隔12 h称质量一次,发酵结束后分别测定CO2总质量损失、酒精度、还原糖及酯类含量。
1.3.5 测定方法
(1)CO2总质量损失、还原糖含量、酒精度测定:按照参考文献[15]的方法进行。
(2)乳酸含量的测定
采用高效液相色谱法(HPLC)测定发酵液中乳酸的含量。HPLC的检测条件:HPX-87H色谱柱(300mm×7.8mm),流动相为5 mmol/L稀硫酸,流动相流速为0.6 mL/min,柱温65℃,检测器温度45℃,采用示差折光检测器检测。用流动相对样品进行稀释后,用0.22 μm的滤膜进行过滤,采用外标法对发酵液进行定量。制作标准曲线的标准偏差达0.999以上方可用于数据的分析。
(3)酯类含量的测定
气相色谱法:根据利用气相色谱检测白酒的文献[16],气相色谱仪条件:AT.LZP-930白酒专用色谱柱(50 m×320 μm×1 μm);火焰离子化检测器(flame ionization detector,FID),检测器温度200 ℃;载气为高纯氮(N2),流速5 mL/min;检测条件:程序升温,50℃保持8 min,5℃/min升至120℃,保持8 min;进样口温度200℃;进样量1.0 μL;分流比为10∶1。
2 结果与分析
2.1 产乳酸菌株的构建及鉴定
2.1.1 重组质粒Yep352-PK的构建
使用1.3.1的方法,构建表达质粒Yep352-PK。对构建的Yep352-PK质粒进行PCR验证,其结果如图2所示。
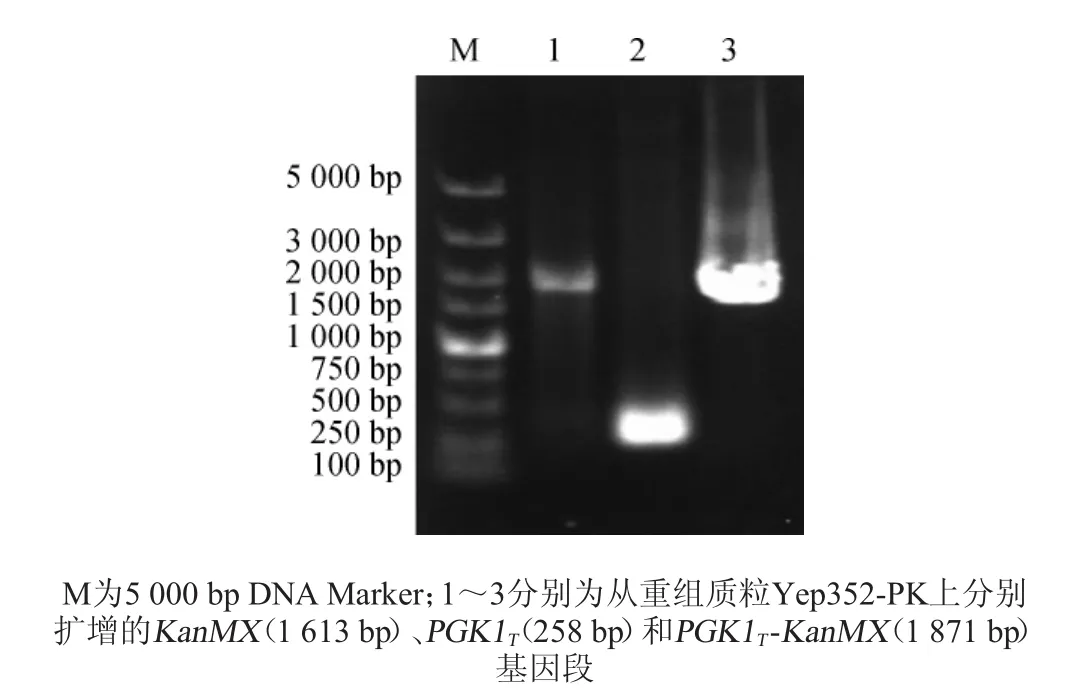
图2 重组质粒Yep352-PK的PCR扩增结果Fig.2 Results of PCR amplification of recombiant plasmid Yep352-PK
由图2可知,以Yep352-PK为模板,扩增得到1 871 bp的PGK1T-KanMX片段、258 bp的PGK1T片段和1 613 bp的KanMX片段。PCR验证结果与理论预期相符,说明PGK1TKanMX基因片段成功插入Yep352的多克隆位点处,Yep352-PK质粒构建成功。
2.1.2 过表达ldhL1重组菌株的构建
将转化片段PA、ldhL1、PGK1T-KanMX和PB用醋酸锂化学转化法导入酵母细胞AY12-α中。通过PA和PB片段与酵母基因组上PDC1基因两侧的同源序列发生同源重组,从而实现了ldhL1基因的过表达盒整合到酿酒酵母染色体上,同源重组过程如图3所示。

图3 转化片段的重组过程Fig.3 Homologous recombination process of converted fragments
在上同源臂PA上游设计引物P1-U,结合ldhL1-D以验证上游片段的整合;设计引物ldhL1-U/Kr-D以验证中游片段的整合;在下同源臂PB下游设计引物P2-D,结合Kr-U以验证下游片段的整合。PCR扩增结果用0.8%琼脂糖凝胶电泳结果见图4。

图4 不同引物的PCR扩增结果Fig.4 Results of PCR amplification using different primers
由图4可知,提取转化子的基因组作为模板进行PCR验证,上游引物P1-U/ldhL1-D的PCR产物可看到一条2 800 bp左右的特异性条带;中游引物ldhL1-U/Kr-D的PCR产物经0.8%的琼脂糖凝胶电泳,可看到一条2 900 bp左右的特异性条带;下游引物Kr-U/P2-D的PCR产物经0.8%的琼脂糖凝胶电泳,可看到一条4 000 bp左右的特异性条带,出发菌株AY12-α型单倍体的阴性对照无条带,说明重组盒PA-ldhL1-PGK1T-KanMX-PB片段已成功重组到酿酒酵母AY12-α基因组中,并且重组位置也正确。
2.1.3 转化子筛选标记的去除
去掉突变株基因组上的KanMX抗性基因后,得到遗传霉素抗性丢失的重组菌株P并进行后续实验。
2.2 重组菌株P的生长性能测定
出发菌株AY12-α和重组菌株P的生长曲线测定结果见图5。

图5 出发菌株AY12-α和重组菌株P生长性能的比较Fig.5 Comparison of growth performance of original strain AY12-α and recombinant strain P
从图5可以看出,与出发菌株AY12-α相比,重组菌株P的整体生长趋势与出发菌株基本保持一致(P<0.05),生物量最终能够达到与出发菌株AY12-α相同的水平,到达稳定期时重组菌株P的生物量略低。结合发酵实验确定乳酸产生,结果表明,重组菌株P代谢产生的乳酸对菌株的生长基本没有影响。
2.3 重组菌株P的基本发酵性能测定
将亲本AY12-α与重组菌株P同时进行玉米水解液发酵。发酵结束后测定各菌株的基本发酵性能,结果见表3。

表3 出发菌株AY12-α和重组菌株P的发酵性能比较Table 3 Comparison of fermentation performance of original strain AY12-α and recombinant strain P
由表3可知,过表达ldhL1基因的重组菌株P与出发菌株AY12-α在相同条件下CO2总质量损失、还原糖含量等主要发酵性能没有明显变化(P<0.05),乙醇产量稍有降低但不是很明显(P>0.05),表明过表达ldhL1基因对菌株的发酵性能没有太大影响。
同时,过表达ldhL1基因的重组菌株P的L-乳酸产量达12.64 g/L,而乙醇的产量有所降低,这是由于乳酸脱氢酶代谢途径的引入,使得糖酵解产生的丙酮酸在厌氧发酵过程中部分分流流向了L-乳酸。最大理论值为每克葡萄糖发酵产生0.51g乙醇,最大理论值为每克葡萄糖发酵产生1.0 g乳酸,实验测得发酵培养基的葡萄糖含量为172.30 g/L,亲本菌株AY12-α和重组菌株P的乙醇对葡萄糖产率分别为0.47 g/g和0.42 g/g,乙醇产率结果差异不显著(P>0.05),同时重组菌株P的L-乳酸对剩余葡萄糖产率为0.41 g/g。实验结果支持了COLOMBIE S等[18]在酿酒酵母中整合过表达植物乳杆菌ldhL1基因可以达到积累L-乳酸的结论。
2.4 产乳酸菌株与外源添加乳酸发酵产乳酸乙酯的差异
为了比较出发菌株AY12-α与重组菌株P对乳酸的利用能力,在出发菌株AY12-α可以耐受乳酸的浓度范围下对其进行了添加乳酸的发酵实验。由前述可知重组菌株P的乳酸产量达12 g/L,为不加乳酸发酵的阴性对照。
2.4.1 乳酸添加量的确定
用无菌水调节菌液浓度为OD600nm=1.0,10倍梯度稀释,依次取2 μL分别点滴于添加1.0%、2.0%、2.5%、3.0%、3.5%、4.0%、6.0%乳酸的YEPD平板。结果如图6所示。

图6 出发菌株AY12-α的乳酸耐受性Fig.6 Lactic acid tolerance of original strain AY12-α
由图6可知,乳酸添加量为1.0%~3.0%时,菌株AY12-α的菌落形态正常,基本不影响菌体的生长;当乳酸添加量提高至3.5%时,菌浓较低时菌落形态明显发生变化,因此菌株AY12-α对乳酸的耐受浓度为3.5%。因此添加与产乳酸菌株相同水平的乳酸(添加量为1.0%,质量浓度为12g/L)基本不会影响菌株的生长。
2.4.2 添加乳酸发酵性能比较
以不加乳酸的出发菌株AY12-α和重组菌株P作为对照,对出发株AY12-α添加12g/L的乳酸进行发酵实验。发酵结束后测定各菌株的基本发酵性能,结果见表4。
由表4可知,添加12 g/L的乳酸进行发酵,与重组菌株P的CO2总质量损失和乙醇产量差异不显著(P>0.05),说明乳酸的添加没有明显影响酵母菌株的生长。同时,发酵液中菌株AY12-α的乳酸含量基本保持不变,表明外源添加的乳酸大部分以游离的形式存在。

表4 添加乳酸后发酵性能比较Table 4 Comparison of fermentation performance after adding lactic acid

表5 添加乳酸对高级醇和酯含量的影响Table 5 Effect of adding lactic acid on the contents of higher alcohols and esters mg/L
由表5可知,产乳酸的重组菌株P其乳酸乙酯产量为162.75 mg/L,乳酸到乳酸乙酯的转化率为1.04%;菌株AY12-α不添加乳酸进行发酵检测不到乳酸乙酯的产生;添加与重组菌株P产量相同的乳酸含量(12 g/L),出发株AY12-α的乳酸乙酯产量达115.47 mg/L,仅为产乳酸菌株P的71%,结果差异显著(P<0.05),表明重组菌株P胞内乳酸较胞外添加乳酸对乳酸乙酯的合成更具优势。结果表明过表达ldhL1基因使发酵的代谢流由乙醇部分流向了L-乳酸,胞内产生的L-乳酸作为一种次级代谢产物,在酵母的胞内发生化学反应生成乳酸乙酯。酿酒酵母本身对乳酸具有一定的化学作用,但是这种效果较自身产乳酸的重组菌株P低,这可能是由于外源乳酸进入胞内部分被细胞膜所阻碍,胞内自身产生的乳酸浓度高且更容易被胞内酶所催化使重组菌株P的乳酸乙酯含量较高。同时重组菌株P的总高级醇(正丙醇、异丁醇、异戊醇和苯乙醇)的含量降低至118.11 mg/L,而出发菌AY12-α的总高级醇含量为225.79 mg/L,降低了约47.7%。
3 结论
与添加相同浓度乳酸的出发菌株AY12-α发酵相比,实验得到产L-乳酸酵母菌株,其乳酸乙酯的产量明显提高(P<0.05),达162.75mg/L。可以进一步结合启动子工程,代谢工程等操作技术,进一步协调乳酸与乙醇、乳酸与乳酸乙酯的比例,为米香型白酒机械化生产技术革新提供了一种新型酵母菌,有效避免窖泥微生物代谢产生的异味物质对白酒风味不利的影响。
产乳酸酵母的构建也为进一步提高乳酸乙酯产量奠定了物质基础,由此可以进一步构建乳酸到乳酸乙酯的酶催化反应通路,得到高产乳酸乙酯酵母菌株以用于白酒工业生产。
