CO2浓度对大豆叶片气孔特征和气体交换参数的影响
2018-08-10王清涛郭丽丽郝立华张茜茜梁伟佳郑云普
李 菲 刘 亮 张 浩 王清涛 郭丽丽 郝立华,* 张茜茜 曹 旭 梁伟佳 郑云普,*
CO2浓度对大豆叶片气孔特征和气体交换参数的影响
李 菲1刘 亮1张 浩2王清涛3郭丽丽1郝立华1,*张茜茜1曹 旭1梁伟佳1郑云普1,*
1河北工程大学水利水电学院, 河北邯郸 056038;2邯郸学院生命科学与工程学院, 河北邯郸 056005;3河北工程大学园林与生态工程学院, 河北邯郸 056038
利用可精准控制CO2浓度的大型气候箱设置7个CO2浓度处理(400、600、800、1000、1200、1400和1600 μmol mol–1), 对大豆进行CO2浓度富集的室内培养试验。结果表明, CO2浓度升高显著减小大豆叶片近轴面的气孔密度和远/近轴面的气孔面积指数。当CO2浓度为400 μmol mol–1时, 远轴面气孔分布最规则, 提高CO2浓度导致远轴面气孔的不规则分布; 与远轴面相反, CO2浓度升高导致近轴面气孔的空间分布更加规则, 即在较高CO2浓度处理下的Lhat(d)最小值均低于对照组。不同叶面(远/近轴面)气孔特征对大气CO2浓度变化的响应存在明显差异, 但大豆可以通过调整气孔形态特征和气孔空间分布格局进一步改变叶片的气体交换参数。研究结果有助于从气孔特征响应的角度深入理解CO2浓度对大豆叶片气体交换过程产生的影响。
CO2浓度; 大豆; 气孔结构特征; 气孔空间分布; 气体交换参数
自18世纪中后期西方工业革命以来, 由于大量化石燃料的使用、森林的大面积砍伐、土地利用方式的转变, 导致大气CO2浓度以平均每年约2 μmol mol–1的速度显著上升, 以致于当前全球的大气CO2浓度已经从1960年的310 μmol mol–1快速升高到400 μmol mol–1 [1]。最新的IPCC第5次评估报告指出, 若人类不采取有效措施严格控制CO2的排放量, 预计21世纪末全球的大气CO2浓度可能达到1000 μmol mol–1, 甚至到22世纪末期将接近于2000 μmol mol–1 [1]。全球范围内的大气CO2浓度升高不仅能够引起气候变暖, 而且还极有可能对世界或区域内的农业生产造成巨大影响。CO2作为一种重要的温室气体, 对全球温室效应的贡献率高达70%[1]; 同时, CO2也是农作物相关生物化学过程所必需的反应物, 细胞内光合反应位点的CO2浓度直接决定着作物的光合效率[2]。因此, 未来大气CO2浓度升高可能通过气候变暖间接影响全球的农作物种植区域范围[3-5]。
气孔是分布在植物表皮上的微小孔隙, 是植物吸收大气CO2和散失水分的主要门户[6-7]。气孔通过调节CO2和水汽进出叶片控制植物的光合作用和蒸腾作用, 而光合作用是陆地生态系统生产力形成与演化的基础[8-9], 且蒸腾作用是水分在SPAC (Soil- Plant-Atmosphere-Continuum)体系运移的驱动力, 直接决定生态系统的水热平衡过程[10]。因此, 植物气孔在调节生态系统碳、水循环过程中起着极其关键的作用[11-13]。植物不仅通过改变气孔开口大小控制外界环境CO2进入叶片的数量, 还能够调整气孔密度和气孔的空间分布格局来优化气体交换效率[14-16]。目前, 有关CO2浓度升高对叶片气孔密度和气孔开口大小等特征的影响尚无定论。Polly等[17]的研究表明, 在700 μmol mol–1CO2浓度下, 银杏叶片的气孔长度、宽度、周长和面积均明显高于对照, 而气孔密度变化不大; 另有研究发现, 将冬小麦分别在不同的CO2浓度下培养(400、600、800、1000和1200 μmol mol–1), 叶片近轴面和远轴面的气孔密度均随CO2浓度升高而减小, 气孔长度则出现先增大后减小的“钟形”变化, 其近轴面和远轴面气孔长度的最高值均出现在770 μmol mol–1CO2浓度时, 而气孔导度随CO2浓度升高而逐渐减小[18]。然而, 潜在的最大气孔导度不仅受气孔数量、气孔大小和形状的影响, 还由气孔在叶片上的空间分布格局所决定[19-21]。徐明[18]研究发现, 当CO2浓度由400 μmol mol–1升高至800 μmol mol–1时, 冬小麦叶片气孔在小尺度的分布变得更加规则, 从而显著提高冬小麦的气体交换效率。
大豆((L.) Merr.)不仅是重要的粮食作物[22], 还是一种常用的油料作物。开展大气CO2浓度升高对大豆气孔特征及气体交换过程影响的相关研究, 能够预测未来CO2浓度升高对全球大豆产量的影响, 以期提前采取有效措施保证全球的粮食和油料供应安全[23]。尽管目前已经开展了CO2浓度升高对大豆影响的相关研究, 但大多数研究基于大气CO2浓度倍增的情景, 而继续增加CO2浓度究竟如何影响大豆叶片气孔性状和气体交换效率, 这一关键科学问题仍鲜有报道。本研究利用可精准控制CO2浓度的大型人工气候箱设置7个不同的CO2浓度, 对大豆进行为期90 d的CO2加富培养, 探讨不同CO2浓度对大豆叶片不同轴面的气孔特征和气体交换参数的影响机制。
1 材料与方法
1.1 试验材料与设计
2016年在河北工程大学农业水土资源综合管理与调控重点实验室, 采用华北平原粮食产区主栽大豆品种周豆16。挑选籽粒饱满、大小均匀的大豆种子, 以盆栽的方式种植,栽植基质为蛭石和珍珠岩(3∶1配比)。待大豆出苗定植后, 保留每盆3株, 每个人工气候箱内放置6盆。大豆播种之前将7个人工气候箱的CO2浓度分别设定为400 (对照)、600、800、1000、1200、1400和1600 μmol mol–1, 温度设定为25℃/21℃(昼/夜), 光照强度设定为1000 μmol m–2s–1, 光照周期为8:00–20:00 (昼)/20:00–8:00 (夜), 相对湿度控制在60%~75%。待人工气候箱的环境参数稳定后, 进行大豆CO2浓度的处理期间每7 d为大豆浇水(每盆500 mL)和Hoagland营养液(每盆30 mL)。为了避免人工气候箱本身的差异对试验结果产生影响, 在整个试验培养期间内,每7 d随机调换1次各个人工气候箱的CO2浓度, 同时也对人工气候箱内相应的盆栽大豆进行调换。
1.2 测定项目与方法
1.2.1 气孔取样和观察方法 待大豆植株在不同CO2浓度人工气候箱中培养90 d, 利用印迹法采集大豆叶片的气孔样品。先在每个植株冠层的中上部(从顶端往下第3个成熟叶片)随机选取3个叶片, 使用无色透明的指甲油分别涂于叶片远轴面和近轴面的中间部位, 等待约30 min, 叶片表面指甲油变干后, 使用镊子轻轻采集面积约为5 mm × 15 mm的气孔印迹置载玻片上, 再利用盖玻片和胶水封片, 用于叶片气孔参数的测量和分析。将气孔印迹玻片置装备有照相机(DFC300-FX, Leica Corp, Germany)的莱卡光学显微镜(DM2500, Leica Corp, Germany)下观察并拍照。在显微镜下随机选择5个视野, 每个视野下拍3张照片, 即得到15张气孔的显微照片(面积为0.30 mm × 0.45 mm), 再从15张照片中随机选取6张来计算气孔的密度(以单位叶面积分布的气孔个数表示, No. mm–2)。然后, 从上述图片中随机选取4张照片, 利用AutoCAD 2010软件分别测量气孔的长、宽、周长、面积以及计算面积指数和形状指数。气孔面积指数是指叶片单位面积的气孔孔径面积; 气孔形状指数是指通过计算单一气孔形状与相同面积的圆之间的偏离程度来测量其形状的复杂程度。当气孔为圆形时, 其形状指数即为1; 若气孔的形状越扁长, 则气孔形状指数的值就越大。
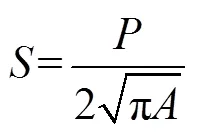
式中,为气孔周长,为气孔面积。
1.2.2 扫描电镜观察 从叶片中部随机采集3个2 mm×2 mm大豆叶片样品, 固定于2.5% (v/v)的戊二醛溶液(0.1 mol L–1磷酸缓冲液, pH 7.0), 并于4℃冷藏保存。然后, 利用磷酸缓冲液冲洗6次, 1.0% (v/v)锇酸固定3 h, 再用相同磷酸缓冲液冲洗干净。将组织进行不同酒精浓度梯度的脱水和临界点干燥后固定于观察台, 利用高压涂膜装置喷金处理。对单个气孔在Quanta 200扫描电子显微镜(FEI Corp, USA)下观察和拍照。
1.2.3 气孔空间分布格局分析 分别从不同处理大豆叶片的光学显微镜照片中随机选取4张(放大5倍), 用于探讨不同CO2浓度对叶片气孔空间分布格局的影响。在本项分析中, 认为每一个气孔都是叶片表面上分布的单点, 气孔开口的中心为该单点的位置。首先, 利用空间分布软件ArcGIS10.0将所选的显微照片在相同的坐标系下进行数字化处理, 得到所选照片的每一个气孔的坐标值。然后, 利用空间统计分析方法Ripley’s K-Function对数字化处理后表征气孔分布状况的点进行空间分析。Ripley’s K-Function是一个分布累加函数, 该函数利用所有单点距离的二阶矩阵探究这些点在不同尺度上的二维分布格局[24]。分析结果由Lhat()值来表达。
Lhat()= K()/πd() (2)
当该分布格局为随机分布时, 所有的值到Lhat()的距离均相等。为了确定95%的可信任区间, 采用蒙特卡洛算法模拟随机分布点1000次。叶片表面的气孔在给定空间尺度d下为随机分布, 则计算出来的Lhat()值应该位于95%可信任区间之内。Lhat()值大于95%可信任区间, 则气孔在该尺度为簇状分布; 否则, 当Lhat()值大于95%小于可信任区间时, 气孔在该尺度为规则分布[24]。
1.2.4 气体交换参数测定 从植株顶端往下选取第3个成熟叶片, 利用Li-6400便携式光合仪(LI-COR Inc. Lincoln, Nebraska, USA)测定净光合速率(n)、蒸腾速率(r)、气孔导度(s)等气体交换参数。叶室内的光照强度设定为1000 μmol m–2s–1, 水蒸汽压亏缺(VPD)控制为2.0 kPa, CO2浓度为400 μmol mol–1, 温度为25℃。叶片尺度的水分利用效率(WUE)利用公式WUEn/r计算。
1.3 数据统计
利用单因素方差分析的方法分析CO2浓度升高对气孔特征的影响, 利用Duncan’s multiple range test比较处理间的显著性差异。利用SPSS 13.0 (Chicago, IL)统计分析, 利用Microsoft Excel 2010作图。
2 结果与分析
2.1 CO2浓度对气孔密度的影响
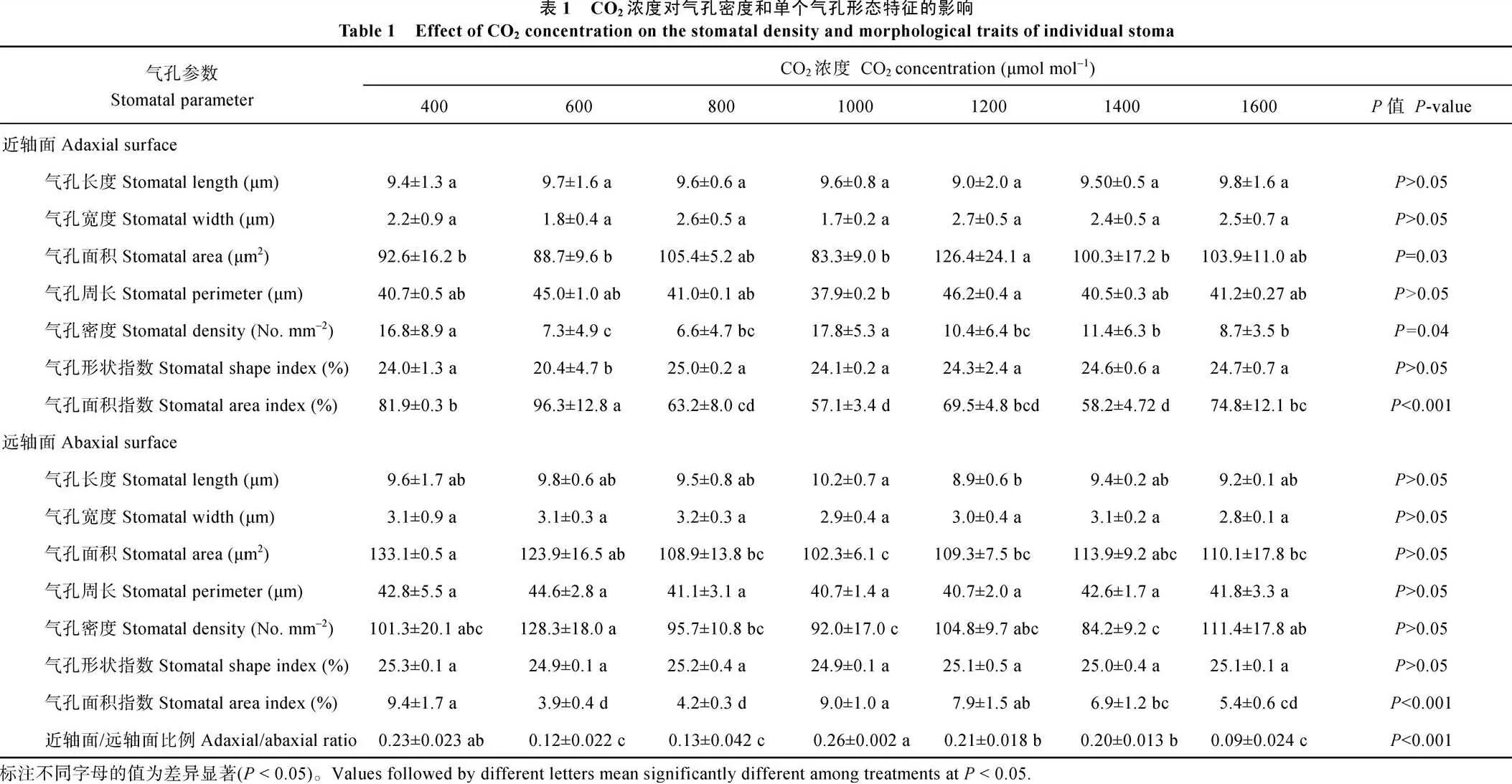
由表1可以看出, CO2浓度升高显著降低大豆叶片近轴面气孔密度(=0.04), 且不同浓度间存在较大差异。与对照组(400 μmol mol–1)相比, CO2浓度分别升高至600、800、1200、1400、1600 μmol mol–1条件下, 大豆近轴面气孔密度分别减少56.5% (=0.010)、60.7% (=0.013)、38.1% (=0.025)、32.1% (=0.026)、48.2% (=0.003)。然而, 在1000 μmol mol–1CO2浓度环境下, 大豆近轴面气孔没有发生显著变化(>0.05)。CO2浓度对远轴面气孔密度并没有产生显著影响。近轴面/远轴面的比值随着CO2浓度的升高而降低, 1600 μmol mol–1CO2浓度下比对照降低60% (<0.001)。
2.2 CO2浓度对气孔大小和形状的影响
CO2浓度升高不仅改变气孔密度, 还对气孔大小产生影响。CO2浓度升高至1000 μmol mol–1时, 远轴面气孔长度由9.4 μm增加到10.2 μm, 但对近轴面气孔长度没有显著影响(>0.05), 升高至1000 μmol mol–1时, 近轴面气孔面积没有显著变化, 但升高至1200 μmol mol–1时, 近轴面气孔面积显著增加36.5%。近轴面气孔周长也在CO2浓度为1200 μmol mol–1时出现最大值, 且最小值出现在1000 μmol mol–1。与之相反, CO2浓度升高减小了叶片远轴面的气孔面积, 而没有对大豆叶片远轴面气孔周长产生显著影响(表1)。由表2可以看出, 大豆叶片近轴面和远轴面气孔大小和形状对CO2浓度升高的响应存在极显著的差异(<0.001)。当CO2浓度升高至1200 μmol mol–1时, 大豆近轴面气孔开口最大, 但远轴面气孔大小却随着CO2浓度的升高而逐渐减小(图2)。CO2浓度升高对大豆叶片近轴面和远轴面的气孔面积指数均产生显著影响(<0.001)。随着CO2浓度的升高, 大豆近轴面和远轴面的气孔面积指数均显著降低, 且在CO2浓度为600 μmol mol–1时, 气孔面积指数降至最低。
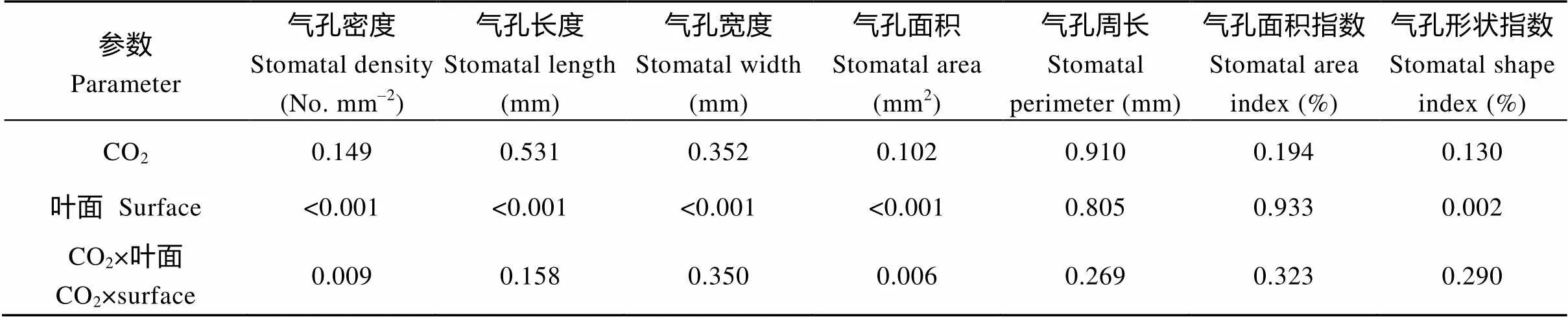
表2 CO2浓度对大豆不同叶面气孔参数的交互作用
2.3 CO2浓度对气孔空间分布格局的影响
从图1可以看出, 不同CO2浓度下, 大豆叶片近轴面气孔在70~170 μm尺度范围内均呈规则分布, 对照组在90 μm尺度处由规则分布转换为随机分布, 而高于对照组的CO2浓度处理在90~180 μm尺度范围内分别转换为随机分布。CO2浓度升高导致Lhat()的最小值均低于对照组, 当CO2浓度为600 μmol mol–1时, Lhat()最小, 比对照组降低约2倍, 暗示叶片近轴面的气孔分布更加规则, 尤其是CO2浓度为600 μmol mol–1时, 气孔分布最为规则。同时, 不同CO2浓度处理下, 大豆叶片远轴面气孔在小尺度范围内为规则分布(<100 μm), 而在大尺度范围内呈随机分布, 但对照组在160 μm空间尺度上由规则分布转换为随机分布, 即CO2浓度升高导致远轴面叶片气孔在更小尺度上呈规则分布。另外, CO2浓度分别为1000 μmol mol–1和1400 μmol mol–1时, Lhat()的最大值(-2.36)和最小值(-3.22)分别比对照增加约30%和3%, 表明对照组(400 μmol mol–1)大豆叶片远轴面的气孔分布最规则, 而CO2浓度升高导致其规则程度降低。此外, 当CO2浓度升高至800 μmol mol–1时, 最小的Lhat(d)最小值出现在约40 μm空间尺度上, 即CO2浓度升高减小了大豆叶片远轴面气孔规则分布的空间尺度范围。另外, 相同空间尺度下近轴面的Lhat()值比远轴面小, 即大豆叶片近轴面气孔分布比远轴面更加规则。
2.4 CO2浓度对气孔导度和蒸腾速率的影响
CO2浓度主要通过改变气孔个数、单个气孔形态特征及其空间分布格局, 从而显著影响叶片的气孔导度和蒸腾速率(<0.05)。不同CO2浓度均导致大豆叶片的气孔导度(s)和蒸腾速率(r)的显著降低, 尤其是CO2浓度为1200 μmol mol–1时,s和r分别比对照降低约66% (<0.001)和49% (<0.001)。大豆光合作用水分利用效率随CO2浓度的增加呈现先升高而后降低的变化趋势, 当CO2浓度为600 μmol mol–1时, 水分利用效率最大, 比对照增加36%, 但随着CO2浓度的继续升高却降低, 在CO2浓度为1000 μmol mol–1时, 水分利用效率值最低, 比对照降低约56% (图3-c)。
3 讨论
有关CO2浓度对植物影响的研究主要集中在大气CO2浓度倍增对植物生物量、农作物产量、气体交换参数等方面[25-28]。关于大气CO2浓度对气孔特征及气体交换过程影响的研究还鲜有报道, 尤其是CO2浓度通过改变叶片气孔个数、单个气孔形态特征和气孔空间分布格局, 从而影响叶片气的体交换过程。本研究借助可精确控制CO2浓度的人工气候箱深入探讨了不同CO2浓度对大豆叶片气孔特征和气体交换参数影响的潜在机理。结果表明, 大豆叶片远轴面的气孔分布数量明显高于近轴面, 且CO2浓度主要通过减少近轴面气孔个数从而显著降低近轴面/远轴面的比率(<0.01)。另外, 大豆叶片远轴面气孔面积指数的最大值出现在600 μmol mol–1, 而该CO2浓度处理下, 近轴面的气孔面积指数却最小, 表明CO2浓度对气孔面积指数的影响在近轴面和远轴面之间存在着明显的差异。因此, 本研究结果表明, 大豆叶片不同轴面的气孔形态特征对CO2浓度的响应不一致, 而这种非对称性响应可能受遗传性信号和环境因子的共同调控。

图1 CO2浓度对大豆叶片气孔空间分布格局的影响
大豆叶片近轴面(a)和远轴面(b)气孔空间分布格局。
The spatial distribution pattern of stomata on the adaxial surface (a) and abaxial surface (b) of soybean leaves.

图2 不同CO2浓度下大豆叶片近轴面和远轴面气孔扫描电子显微照片
CO2浓度为400、600、800、1000、1200、1400和1600 μmol mol–1环境下大豆近轴面(a~g)和远轴面的气孔形态特征(A~G)。
The morphological traits of stomata on the adaxial surface (a–g) and abaxial surface (A–G) of soybean under different CO2concentrations (400, 600, 800, 1000, 1200, 1400, and 1600 μmol mol–1).
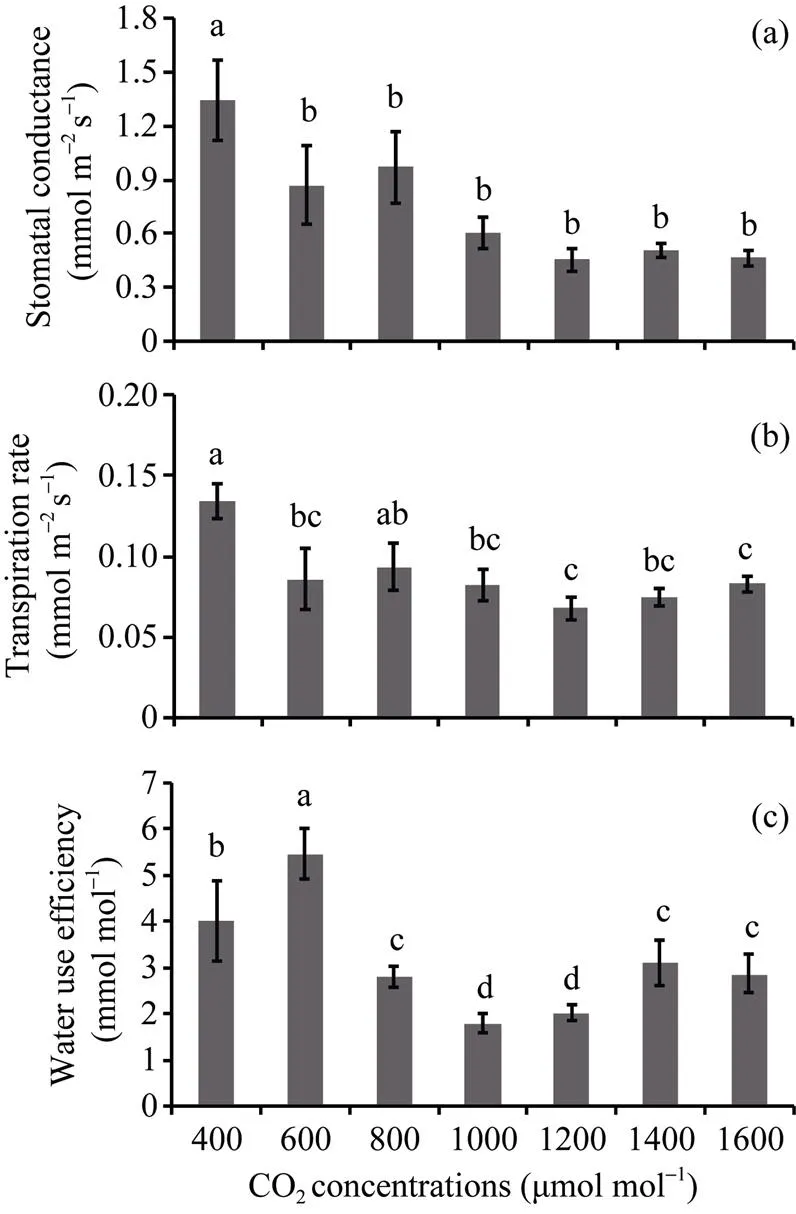
图3 CO2浓度对大豆叶片气孔导度、蒸腾速率和水分利用效率的影响
(a)大豆叶片气孔导度; (b)蒸腾速率; (c)水分利用效率。
(a) the leaf stomatal conductance; (b) transpiration rate; (c) water use efficiency of soybean.
植物叶片的气体交换效率不仅同气孔频度和气孔开口大小存在密切的联系, 通常还受气孔空间分布状况的影响。以往的相关研究探讨了高温对蓝莓气孔特征和气体交换参数的影响, 结果发现, 高温使蓝莓叶片的气孔空间分布变得更加规则, 从而显著提高了蓝莓叶片的气体交换效率[29]。郑云普等[30]利用农田原位增温的方法研究玉米叶片气孔特征和气体交换过程对气候变暖的响应, 结果表明, 增温不仅改变了玉米叶片的气孔频度和气孔形状, 同时还使气孔在叶片上分布的更加均匀, 最终显著提高了玉米叶片的净光合速。本研究发现, 不同CO2浓度处理下, 气孔在大豆叶片上分布的空间格局存在差异, 且近轴面和远轴面气孔响应也有所不同。提高CO2浓度导致气孔在远轴面分布的规则程度降低, 但使近轴面分布的规则程度明显增加。尽管600 μmol mol–1CO2浓度时, 近轴面气孔面积指数最低, 但空间分布却最为规则, 这与大豆叶片气孔导度与蒸腾速率均低于对照有很大关联, 表明CO2浓度升高至600 μmol mol–1时, 近轴面的气孔面积指数比气孔的分布格局对气孔导度和蒸腾速率具有更大的影响。
大量的对照试验已经证实, 植物生长在较高的CO2浓度环境导致叶片气孔导度的下降[31-35]。气孔导度对CO2浓度的响应随物种和环境CO2浓度条件的不同而变化。相关研究结果显示, CO2浓度倍增条件下, 大豆和白桦的气孔导度分别降低25%和21%[36-37]。相似地, 本研究发现, 大豆叶片的气孔导度在CO2浓度倍增环境下(800 μmol mol–1)显著减小约28%, 但在1200 μmol mol–1CO2浓度条件下的气孔导度降低约66%。Levine等[37]的研究结果显示, 长期生长在1200 μmol mol–1CO2浓度的大豆叶片气孔导度减小38%, 也有研究结果表明, 提高环境CO2浓度并未降低海棠和刺叶栎的气孔导度[38]。CO2浓度与叶气孔密度具有较好的相关性, 推测植物可能通过减小气孔密度来调控气孔导度, 以适应外界环境CO2浓度的变化[39-41], 本研究发现, 高CO2浓度条件下大豆的气孔密度和气孔导度明显降低, 其结果直接支持了上述结论。另外, 大豆叶片远近轴面气孔对外界CO2浓度变化做出的响应有所不同而又彼此联系, 即当外界CO2浓度升高时, 叶片近轴面主要通过改变气孔数量、面积指数来适应环境变化, 而远轴面则通过改变气孔的空间分布来优化气体交换效率。大豆叶片气孔形成和发育过程对高CO2浓度的响应机制极其复杂, 关于CO2浓度改变气孔的形态特征和分布状况进一步影响大豆生理和生长的机理将是未来该领域的重要研究方向。
4 结论
本研究探讨了CO2浓度对大豆叶片气孔特征及其气体交换参数的影响, 得到如下结论, 较高CO2浓度条件下, 大豆叶片近轴面和远轴面均主要通过调整气孔的密度和分布来优化叶片的气体交换过程; 当CO2浓度升高至600 μmol mol–1时, 大豆叶片远轴面气孔面积指数抵消了气孔分布规则和密度升高的正效应; 大豆叶片近轴面和远轴面气孔对CO2浓度升高的响应存在较大差异, 但远轴面和近轴面气孔特征在优化气体交换效率过程中相互协调和补充。本研究结果有助于从气孔特征角度深入理解大豆叶片对高浓度CO2响应的潜在机制。
[1] IPCC. Intergovernmental panel on climate change (2013) summary for policymakers. In: Stocker T F, Qin D, Plattner G K, Tignor M, Allen S K, Bo-schung J, Nauels A, Xia Y, Bex V, Midgley P M, eds. Climate Change 2013: The Physical Science Basis, Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press, pp 225–248.
[2] Kim H Y, Lieffering M, Kobayashi K, Okada M, Shu M. Seasonal changes in the effects of elevated CO2on rice at three levels of nitrogen supply: a free air CO2enrichment (FACE) experiment., 2003, 9: 826–837
[3] 李萍, 郝兴宇, 杨宏斌, 林而达. 大气CO2浓度升高对绿豆生长发育与产量的影响. 核农学报, 2011, 25: 358–362 Li P, Hao X Y, Yang H B, Lin E D. Effects of air CO2enrichment on growth and yield of mung bean., 2011, 25: 358–362 (in Chinese with English abstract)
[4] 于显枫, 张绪成, 王红丽. 高浓度CO2下氮素对小麦叶片干物质积累及碳氮关系的影响. 核农学报, 2012, 26: 1058–1063 Yu X F, Zhang X C, Wang H L. Effects of nitrogen on the dry matter accumulation, carbon and nitrogen metabolism of wheat leaves under elevated atmospheric CO2concentration., 2012, 26: 1058–1063 (in Chinese with English abstract)
[5] Bowes G. Facing the inevitable: plants and increasing atmospheric CO2., 1993, 44: 309–332
[6] Woodward F I. Stomatal numbers are sensitive to increases in CO2from preindustrial levels., 1987, 327: 617–618
[7] Hetheringto A M, Woodward F I. The role of stomata in sensing and driving environmental change.2003, 424: 901–908
[8] 王慧, 周广胜, 蒋延玲, 石耀辉, 许振柱. 降水与CO2浓度协同作用对短花针茅光合特性的影响. 植物生态学报, 2012, 36: 597–606 Wang H, Zhou G S, Jiang Y L, Shi Y H, Xu Z Z. Interactive effects of changing precipitation and elevated CO2concentration on photosynthetic parameters of., 2012, 36: 597–606 (in Chinese with English abstract)
[9] 孙谷畴, 赵平, 彭少麟, 曾小平. 在高CO2浓度下四种亚热带幼树光合作用对水分胁迫的响应. 生态学报, 2001, 21: 738–746 Sun G C, Zhao P, Peng S L, Zeng X P. Response of photosynthesis to water stress in four saplings from subtropical forests under elevated atmospheric CO2concentration.2001, 21: 738–746 (in Chinese with English abstract)
[10] 王建林, 温学发, 赵风华, 房全孝, 杨新民. CO2浓度倍增对8种作物叶片光合作用、蒸腾作用和水分利用效率的影响. 植物生态学报, 2012, 6: 438–446 Wang J L, Wen X F, Zhao F H, Fang Q X, Yang X M. Effects of doubled CO2concentration on leaf photosynthesis, transpiration and water use efficiency of eight crop species., 2012, 6: 438–446 (in Chinese with English abstract)
[11] Farquhar G D, Von Caemmerer S, Berry J A. Models of photosynthesis., 2001, 125: 42–45
[12] Reeves D W, Rogers H H, Prior S A, Wood C W, Runion G B. Elevated atmospheric carbon dioxide effects on sorghum and soybean nutrient status., 1994, 17: 1939–1954
[13] 翟志席, 郭玉海, 马永泽, 柏长青. 植物生态生理学. 北京: 中国农业大学出版社, 1997, pp 60–66 Zhai Z X, Guo Y H, Ma Y Z, Bai C Q. Plant Ecophysiology. Beijing: China Agricultural University Press, 1997. pp 60–66 (in Chinese)
[14] Apple M E, Olszyk D M, Ormrod D P, Lewis J, Southworth D, Tinqey D T. Morphology and stomatal function of douglas fir needles exposed to climate change: elevated CO2and temperature., 2000, 161: 127–132
[15] Kouwenberg L L R, Kurschner W M, Mcelwain J C. Stomatal frequency change over altitudinal gradients: prospects for paleoaltimetry., 2007, 66: 215–241
[16] Fraser L H, Greenall A, Carlyle C, Turkington R, Friedman C R. Adaptive phenotypic plasticity of: response of stomatal density, leaf area and biomass to changes in water supply and increased temperature., 2009, 103: 769–775
[17] Polly H W, Johnson H B, Mayeux H S. Carbon dioxide and water fluxes of C3and C4perennials at subambient CO2concentrations., 1992, 6: 693–703
[18] Xu M. The optimal atmospheric CO2concentration for the growth of winter wheat., 2015, 184: 89–97
[19] Croxdale J L. Stomatal patterning in angiosperms., 2000, 87: 1069–1080
[20] Shpak E D, Mcabee J M, Pillitteri L J, Ku T. Stomatal patterning and differentiation by synergistic interactions of receptor kinases., 2005, 309: 290–293
[21] 孙成明, 庄恒扬, 杨连新, 杨洪建, 黄建晔, 董桂春, 朱建国, 王余龙. FACE水稻生育期模拟. 生态学报, 2007, 27: 613–619 Sun C M, Zhuang H Y, Yang L X, Yang H J, Huang J Y, Dong G C, Zhu J G, Wang Y L. A simulation of growth duration FACE rice., 2007, 27: 613–619 (in Chinese with English abstract)
[22] 蒋跃林, 张庆国, 岳伟, 姚玉刚, 王公明. 大气CO2浓度升高对大豆生长和产量的影响. 中国农学通报, 2005, 21: 355–357 Jiang Y L, Zhang Q G, Yue W, Yao Y G, Wang G M. Effects of elevated atmospheric CO2concentration on growth and yield of soybean.2005, 21: 355–357 (in Chinese with English abstract)
[23] 王修兰, 徐师华. CO2浓度倍增对大豆各生育期阶段的光合作用及干物质积累的影响. 作物学报, 1994, 20: 520–527 Wang X L, Xu S H. Effect of CO2concentration doubling on photosynthesis and dry matter production in different growth stages of soybean plant., 1994, 20: 520–527 (in Chinese with English abstract)
[24] Zheng Y P, Xu M, Hou R X, Shen R C, Qiu S, Ou-Yang Z. Effects of experimental warming on stomatal traits in leave s of maize (L.)., 2013, 3: 3095–3111
[25] 张绪成, 于显枫, 高世铭. 高大气CO2浓度下氮素对小麦叶片光能利用的影响. 植物生态学报, 2010, 34: 1196–1203 Zhang X C, Yu X F, Gao S M. Effects of nitrogen application rates on photosynthetic energy utilization in wheat leaves under elevated atmospheric CO2concentration., 2010, 34: 1196–1203 (in Chinese with English abstract)
[26] 张绪成, 于显枫, 马一凡, 上官周平. 高大气CO2浓度下小麦旗叶光合能量利用对氮素和光强的响应. 生态学报, 2011, 31: 1046–1057 Zhang X C, Yu X F, Ma Y F, Shang-Guan Z P. The responses of photosynthetic energy use in wheat flag leaves to nitrogen application rates and light density under elevated atmospheric CO2concentration., 2011, 31: 1046–1057 (in Chinese with English abstract)
[27] Teng N J, Wang J, Chen T, Wang Y, Lin J. Elevated CO2induces physiological, biochemical and structural changes in leaves of., 2006, 172: 92–103
[28] Kruse J, Hetzger I, Mai C, Polle A, Rennenberg H. Elevated CO2affects N-metabolism of young poplar plants () differently at deficient and sufficient N-supply., 2003, 157: 65–81
[29] 朱玉, 黄磊, 党承华, 王贺新, 姜国斌, 李根柱, 张子川, 娄鑫, 郑云普. 高温对蓝莓叶片气孔特征和气体交换参数的影响. 农业工程学报, 2016, 32(1): 218–225 Zhu Y, Huang L, Dang C H, Wang H X, Jiang G B, Li Y Z, Zhang Z C, Lou X, Zheng Y P. Effects of high temperature on leaf stomatal traits and gas exchange parameters of blueberry., 2016, 32(1): 218–225 (in Chinese with English abstract)
[30] 郑云普, 徐明, 王建书, 王贺新. 气候变暖对华北平原玉米叶片形态结构和气体交换过程的影响. 生态学报, 2016, 36: 1526–1538 Zheng Y P, Xu M, Wang J S, Wang H X. Effects of future climate warming on the morphology, structure, and gas exchange of maize leaves in the North China Plain., 2016, 36: 1526–1538 (in Chinese with English abstract)
[31] Amthor J S. Effects of atmospheric CO2concentration on wheat yield: review of results from experiments using various approaches to control CO2concentration., 2001, 84: 1–34
[32] Cotrufo M F, Ineson P, Scott A. Elevated CO2reduces the nitrogen concentration of plant tissues., 1998, 4: 43–54
[33] Donohue R J, Roderick M L, McVicar T R, Farquhar G D. Impact of CO2fertilization on maximum foliage cover across the globe’s warm arid environments., 2013, 40: 3031–3035
[34] Field C B, Jackson R B, Mooney H A. Stomatal responses to increased CO2: implications from the plant to the global scale., 1995, 18: 1214–1225
[35] JablonskiL M, Wang X, Curtis P S. Plant reproduction under elevated CO2conditions: a meta-analysis of reports on 79 crop and wild species., 2002, 156: 9–26
[36] Valle R M. Transpiration rate and water use efficiency of soybean leaves adapted to different CO2environments., 1985, 25: 47–482
[37] Levine L H, Richards J T, Wheeler R M. Super-elevated CO2interferes with stomatal response to ABA and night closure in soybean ()., 2009, 166: 903–913
[38] Bunce J A. Stomatal conductance, photosynthesis and respiration of temperate deciduous tree seedlings grown outdoors at an elevated concentration of carbon dioxide., 1992, 15: 541–549
[39] Assmann S M, Shimazaki K I. The multisensory guard cell: stomatal responses to blue light and abscisic acid., 1999, 119: 809–815
[40] Kolla V A, Vavasseur A, Raghavendra A S. Hydrogen peroxide production is an early event during bicarbonate induced stomatal closure in abaxial epidermis of Arabidopsis., 2007, 225: 1421–1429
[41] Morison J I L. Intercellular CO2concentration and stomatal response to CO2. In: Zeiger E, Cowan I R, Farquhar G D, eds. Stomatal Function. California:Stanford University Press, 1987. pp 229–512
Effects of CO2Concentrations on Stomatal Traits and Gas Exchange in Leaves of Soybean
LI Fei1, LIU Liang1, ZHANG Hao2, WANG Qing-Tao3, GUO Li-Li1, HAO Li-Hua1,*, ZHANG Xi-Xi1, CAO Xu1, LIANG Wei-Jia1, and ZHENG Yun-Pu1,*
1School of Water Conservancy and Hydroelectric Power, Hebei University of Engineering, Handan 056038, Hebei, China;2School of Life Science and Engineering, Handan University, Handan 056005, Hebei, China;3School of Landscape and Ecological Engineering, Hebei University of Engineering, Handan 056038, Hebei, China
Seven concentrations treatments (400, 600, 800, 1000, 1200, 1400, and 1600 μmol mol–1) were designed to investigate the effects of atmospheric CO2concentrations on the stomatal traits and leaf gas exchange of soybean. We found that elevating CO2concentrations significantly decreased the stomatal density of adaxial side and the stomatal area index of both the adaxial and abaxial sides. Meanwhile, the spatial distribution pattern analysis of stomata with the Ripley’s K function showed that the spatial distribution pattern of stomata on leaf surfaces of soybean was highly scale-dependent. The most regular distribution pattern of stomata on the abaxial surface was found under the CO2concentration of 400 μmol mol–1, and the increase of CO2concentration resulted in irregular distribution pattern of stomata on the abaxial surface of soybean leaves. In contrast to the abaxial surface, elevating CO2concentrations made the spatial distribution pattern of stomata more regular on the adaxial leaf surface, which was evidenced by lower minimal Lhat(d) values under elevated CO2concentrations than those under CO2concentration of 400 μmol mol–1. Although the response of stomatal traits to atmospheric CO2concentration was obviously different between the adaxial and abaxial surfaces of leaves, soybean plants could alter leaf gas exchange through adjusting the morphological traits and the spatial distribution pattern of stomata. These results may be helpful for further understanding potential mechanisms concerning about the elevating CO2effect on the leaf gas exchange of soybean plants from the view of stomatal traits.
CO2concentration; soybean plants; stomatal structure and function; stomatal distribution pattern; leaf gas exchange
本研究由国家自然科学基金项目(31400418), 河北省自然科学基金项目(C2016402088, E2016402098), 河北省创新能力提升计划科技研发平台建设专项“河北省水资源高效利用工程技术研究中心”(18965307H), 河北省高等学校青年拔尖人才计划项目(BJ2016012), 河北省引进留学人员资助项目(CN201702), 中国博士后科学基金项目(2014M561044, 2016T90128)和河北省教育厅青年科学基金项目(QN2015253)资助。
This study was supported by the National Natural Science Foundation of China (31400418), the Natural Science Foundation of Hebei Province (C2016402088, E2016402098), the Innovation Capability Upgrading Plan of Hebei Province (Research Center for High-efficiency Utilization of Water Resources, No. 18965307H), the Young Outstanding Innovative Talents of Hebei Province (BJ2016012), the Foundation for Returnees of Hebei Province (CN201702), China Postdoctoral Science Foundation Funded Projects (2014M561044, 2016T90128), and the Science and Technology Research Project of Hebei Colleges and Universities (QN2015253).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180508.1831.008.html
2018-04-11;
2018-05-11.
10.3724/SP.J.1006.2018.01212
郝立华, E-mail: haolihua_000@sina.com, Tel: 0310-8579025; 郑云普, E-mail: zhengyunpu_000@ sina.com, Tel: 0310-8573126.
E-mail: lifei19931027@163.com
2017-12-22;
