利用FBP7::iaaM转基因材料同步改良短季棉品种晋棉11纤维产量和品质
2018-08-10丁晓艳钱山山阎星颖
丁晓艳 赵 娟 钱山山 阎星颖 裴 炎
利用转基因材料同步改良短季棉品种晋棉11纤维产量和品质
丁晓艳 赵 娟 钱山山 阎星颖 裴 炎*
西南大学生物技术中心, 重庆 400716
棉花在我国国民经济中具有举足轻重的地位。短季棉品种有利于提高土地利用率, 对于人多地少的中国来说, 发展短季棉对棉花的可持续发展具有重要意义。因此, 提高短季棉品种的产量和品质成为当前棉花育种的重要课题。前期工作中我们通过时空精确调控基因, 适当增加生长素在棉花胚珠种皮中的水平, 获得了纤维产量和细度同步改良的转基因棉花材料IF1-1 ()。本文通过回交育种, 将基因导入低衣分、高马克隆值的短季棉品种晋棉11, 获得了衣分提高、马克隆值降低、同时保留早熟特点的回交后代JBC4。连续2年的田间试验表明, JBC4的衣分比回交亲本提高了12.8%, 小区纤维产量增加56.3%, 马克隆值降低10.7%。说明该转基因性状能在杂交和回交过程中稳定遗传, 可用于棉花产量和马克隆值的定向改良。
生长素; 转基因; 短季棉; 回交; 衣分; 马克隆值
棉花是重要的经济作物, 棉花产量关系着我国2000万棉农的生计和纺织工业的健康发展。我国人多地少, 在保证国家粮食安全的情况下, 棉花产业的可持续发展必须依靠科技协作与技术创新[1]。发展短季棉可充分利用温光水等资源, 解决茬口矛盾[2],同时有利于避开虫害, 提高植棉效益。但短季棉普遍存在产量较低、品质较差的缺点, 限制了其推广应用。因此, 培育丰产优质的短季棉新品种, 已成为我国棉花育种的重要目标[3]。
于实验室利用种皮特异启动子, 在开花当天的胚珠表皮精确时空调控生长素合成基因, 通过遗传转化获得了棉花纤维产量与品质同步改良的转基因材料[4]。该材料能够显著提高棉花衣分, 降低棉花的马克隆值, 且对其他产量性状以及纤维品质性状无负面影响。为了评估该转基因材料在棉花品种改良中的应用价值及验证转基因性状的稳定性, 我们以早熟但衣分低、马克隆值高的短季棉品种晋棉11[5]为对象, 通过杂交和连续回交将导入晋棉11, 获得了衣分提高、马克隆值下降、同时保留晋棉11早熟特性的新材料。
1 材料与方法
1.1 试验材料
抗病轮回亲本短季棉晋棉11由河北农业大学马峙英教授提供, 供体为高产优质的转基因材料IF-1株系。
1.2 回交转育方法
以转基因材料为父本与晋棉11杂交, 再与轮回亲本晋棉11回交。通过GUS染色和PCR分子检测在回交后代鉴定带有目的基因的植株,以之为父本与晋棉11杂交。为加快育种速度, 每年冬季于温室繁殖和回交。连续回交4次, 在其自交后代中鉴定出转基因不分离的纯合植株, 隔离繁殖后得到回交株系JBC4。2013年将纯合株系种植于西南大学试验田, 按常规方法进行田间管理, 观察表型。于2014—2015年进行田间随机区组试验。
1.3 阳性植株的筛选
取回交后代幼苗叶片放入96孔板, GUS染液浸染过夜, 保留蓝色阳性植株, 舍去阴性植株, 再利用Aidlab植物基因组DNA快速提取试剂盒提取阳性植株的DNA, 用上海Novoprotein公司2×Master MIX (Quick Load)进行基因PCR扩增筛选。总反应体系为20 μL, 包含DNA模板2 μL、2×Master Mix 10 μL、上下游引物各1 μL、ddH2O 6 μL。温度循环参数为95℃预变性5 min; 95℃变性30 s, 56℃退火30 s, 72℃延伸30 s, 35次循环; 72℃延伸10 min。基因PCR筛选上下游引物为, iaaMup: 5¢-ATGAATTGGACCGCAGGGTT-3¢和iaaMdn: 5¢-A TTTCGGCCACGACACTAGG-3¢。扩增后取10 μL电泳。
1.4 定量PCR反应
按照EASYspin植物RNA快速提取试剂盒(艾德莱生物公司, 北京)操作说明书提取开花当天胚珠的总RNA。参照TaKaRa公司PrimeScript RT reagent Kit with gDNA Eraser试剂盒说明书合成cDNA。用实时荧光定量PCR仪(Bio-Rad, CFX96型)进行定量PCR。反应体积为20 μL, 包含10 μL 2×SYBR Green Supermix、0.5 μL上下游特异引物、4 μL H2O、5 μL cDNA模板。扩增条件为95℃预变性3 min; 95℃变性20 s, 56℃退火20 s, 72℃延伸30 s, 40次循环。检测基因所用的引物为iaaMRTup: 5¢-GGCGCGGGCAACAGTGAGT-3¢和iaaMRTdn: 5¢-GAAATGCCAGCGCCAATGACC-3¢。内参基因(AF024716)引物为GhHIS3RTup 5¢-GAA GCCTCATCGATACCGTC-3¢, GhHIS3RTdn 5¢-CTA CCACTACCATCATGGC-3¢, 目的基因和内标的比值即为目的基因在开花当天胚珠中的相对表达量。
1.5 IAA激素含量的测定
参照Zhang 等[4]的方法提取IAA, 取开花当天胚珠在液氮中研磨成粉, 称取0.1 g 装于10 mL离心管, 加5 mL激素提取液(80%的甲醇含10 ng13C6-IAA作为内标), 于-20°C 浸提过夜。混合物于9600×, 4℃离心15 min, 取上清液于40℃旋转蒸发干燥。用5 mL 0.1 mol L–1醋酸溶液复溶残渣。用5 mL甲醇活化Sep-Pak Plus tC18 cartridge, 经0.1 mol L–1醋酸溶液平衡。将溶解的样品缓慢上柱, 经4 mL 17%甲醇(0.1 mol L–1醋酸稀释)漂洗后, 以6 mL 40%甲醇(0.1 mol L–1醋酸稀释)缓慢洗脱样品并收集。通过减压蒸馏将纯化后样品溶于1.5 mL甲醇, 浓缩干燥后待用。检测方法参考Zeng等[6], 用100 μL 10%甲醇溶解干燥样品, 16 200×离心15 min, 上样20 μL于4000 Q TRAP LC/MS/MS系统(AB sciex, USA)用Zorbax Eclipse XDB-C18分析柱(2.1 mm×150.0 mm, 粒径3.5 μm, Agilent, USA)分离。流动相程序为以0.16 mL min–1的流速, 用10%甲醇(0.01%醋酸稀释)维持5 min, 30 min时将流动相A浓度提高到85%, 之后进行清洗和平衡程序。质谱以选择离子检测正离子方式检测IAA (m/z=176)和13C6-IAA (m/z=181), 并通过峰面积定量分析。
1.6 开花当天胚珠电镜扫描
参照Zhao等[7]的方法, 略有改动。取开花当天早上的花朵, 于S-3400N (Hitachi, Japan)电镜扫描仪上检测样品和野生型子房靠近中部的胚珠, 选取纤维细胞密度最高的胚珠中部位置扫描, 在300倍下照相, 用Photoshop软件画出电镜照片相同部位相同面积, 在每个突起上计数。统计每植株4个花朵, 每朵花1个胚珠, 取平均值作为单位面积的突起数目。
1.7 成熟纤维统计
参照Zhang等[4]的方法, 略有改动, 测定种子成熟纤维数量。随机取20粒棉花子棉, 手工脱绒, 称取全部纤维重量(W1)。从中取5束重约1.5 mg的纤维。理顺后, 称取每束纤维重量(W2)。将纤维束用沸水煮10 min, 然后冷却至室温, 置水中备用。用无尘滤纸吸去纤维束水分, 从中剪取3个约1~2 mm长的截段。分别将每段纤维均匀分散于6滴水中, 于显微镜下观察并照相。利用Photoshop计数每个液滴中的纤维段数量, 计算出每束纤维的平均纤维数量(N2)。每粒棉籽成熟纤维数目N1 = (W1/20)/(W2/ N2)。统计数据时, 去除极大值和极小值。
1.8 田间性状统计
按照《国家棉花品种区域试验方案》, 设计随机区组田间试验。以轮回亲本为对照组, 回交后代纯合子JBC4为试验组, 种植于重庆市西南大学试验地中。小区面积20 m2, 行距1 m, 间距0.33 m, 每行15株, 每小区60株, 重复3次。
于105 DAS (播种后天数,days after sowing), 从每小区随机选取5株棉花, 测定株高。130 DAS从每小区随机选取5株统计单株果枝数及棉铃数。8月中旬至9月中旬所收棉花考种。铃重=子棉重量/铃数。衣分=纤维重量/子棉重量100%。子指=100粒棉花种子的重量。衣指=单铃重/单铃种子数×100-子指。单株子棉产量=铃重×铃数。小区子棉产量=单株子棉产量×60。皮棉产量=子棉产量×每区衣分。在河南安阳农业部棉花品质监督检验测试中心检测棉花纤维样品上半部平均长度、整齐度、马克隆值、伸长率和断裂比强度。
2 结果与分析
2.1 回交后代的分子鉴定
2010年至2013年, 以轮回亲本晋棉11为母本,转基因材料供体亲本为父本杂交并连续回交。回交后代经GUS染色, 筛选出阳性植株, 再提取阳性植株DNA, 以此为模板扩增目的基因(图1)。以扩出基因片段的阳性植株为父本再同轮回亲本回交, 在回交第4代中选择含目的基因的阳性植株自交, 自交后代出苗后取棉花子叶进行GUS染色, 统计其阳性植株与阴性植株数量, 卡方检测结果显示, 其后代阳性植株与阴性植株符合孟德尔遗传定律3︰1的分离比例(表1)。
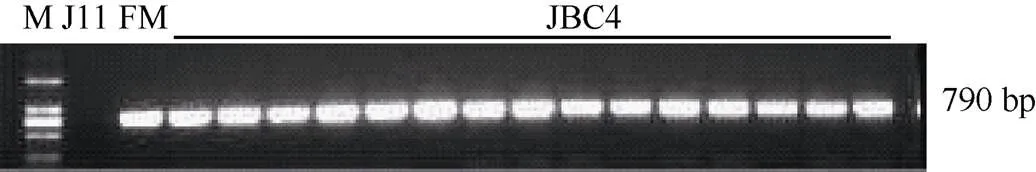
图1 回交后代iaaM基因PCR扩增部分筛选图
M: marker 2000; J11: 晋棉11; FM:; 其余泳道为回交后代植株JBC4。
M: marker 2000; J11: Jinmian 11; FM:; the rest lanes are progenies ofbackcross.
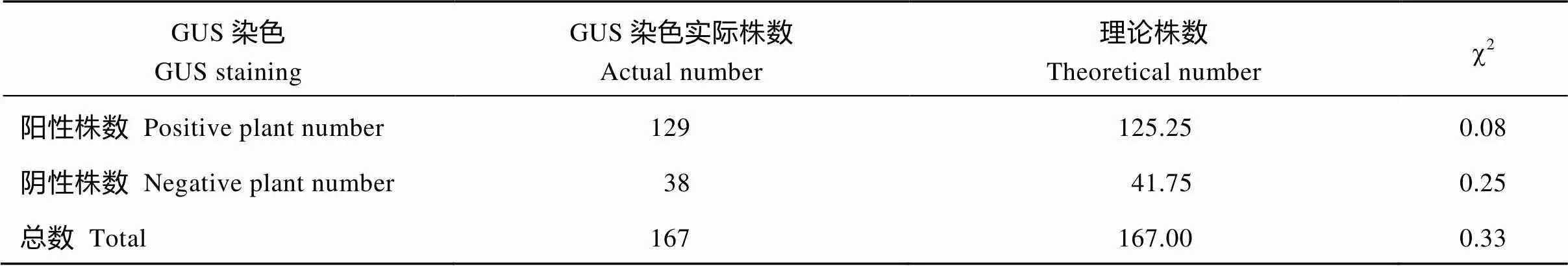
表1 回交4代转基因阳性植株自交后代的GUS分离比例
c20.05,1=3.84
2.2 转基因回交导入系的表型
转基因回交导入系JBC4与轮回亲本晋棉11相比, 株高、株型和叶片等外观表型无明显差异(图2, 图3)。且JBC4的始花期提前, 从出苗到吐絮的时间与晋棉11一致(约115 d), 吐絮较IF-1株系及其供体亲本冀棉14提前了2周左右。基因能在回交导入系中正常转录(图4-A)。JBC4开花当天胚珠的IAA含量比晋棉有所提高(图4-B), 电镜扫描观察表明, JBC4相比母本开花当天胚珠表面突起显著增加(图4-C)。JBC4回交导入系的单粒种子表面的成熟纤维数量明显增多(图4-D)。这表明转基因材料在晋棉11的遗传背景下行使了其合成IAA的功能。
2.3 田间比较试验结果
为了进一步评估转基因性状的效果, 验证其遗传稳定性, 2014―2015年将纯合的JBC4与晋棉11进行田间区组试验。结果表明(表2), 与晋棉11相比, 晋棉回交后代的马克隆值分别下降了12.68%和8.70%; 衣分分别增加25.40%和19.13%; 其单株铃数、单铃种子数、衣指明显提高。虽然子指有所下降(表3), 但最终子棉产量以及纤维产量均有明显提高(表2), 这与转基因棉花表型一致。观察发现, JBC4的开花时间同晋棉11一致, 比亲本转基因株系及其受体冀棉14提前1周左右。表明利用杂交的方式导入转基因性状, 通过回交使转基因置于回交亲本的遗传背景下, 在提高回交后代的产量和品质的同时, 保留了回交亲本短季棉的优点, 实现了高产优质的定向改良。
图2 晋棉11与JBC4株高比较

图3 晋棉11与JBC4田间表型比较
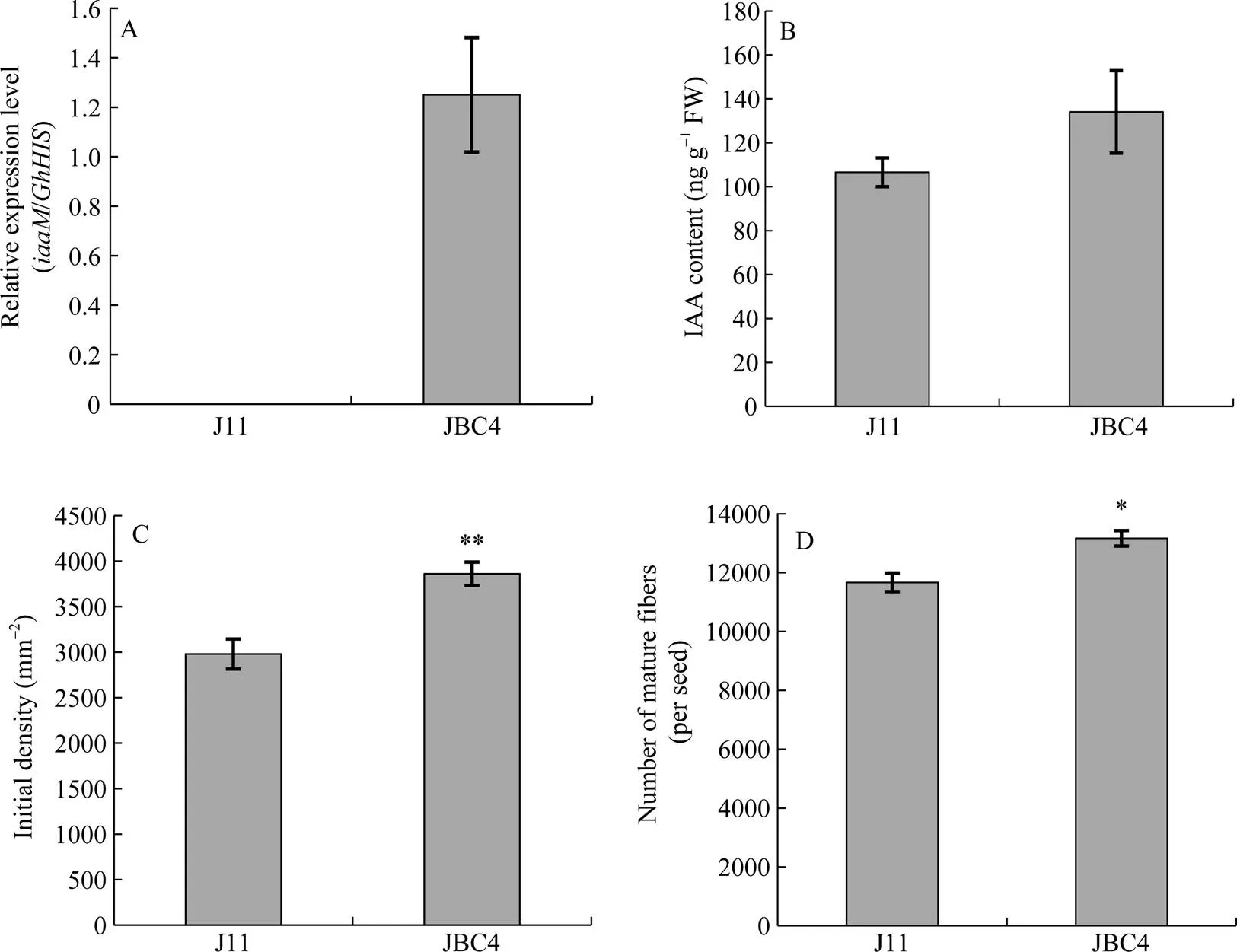
图4 晋棉11与JBC4的iaaM基因转录水平、IAA含量、胚珠表面突起和成熟纤维数量比较
A:相对表达量; B: 开花当天胚珠中IAA激素含量; C: 开花当天胚珠表面纤维细胞突起数量; D: 棉花单粒种子成熟纤维数目。J11: 晋棉11; JBC4: 晋棉11与回交4代纯合后代。采用Student'stest检验分析数据; *和**分别表示在0.05和0.01水平上差异显著。
A:relative expression ofgene; B: the content of IAA in 0 DPA ovule; C: the initial density of fiber in 0 DPA ovule; D: number of mature fibers per seed. J11: Jinmian 11; JBC4: the fourth generation of homozygous progenies ofbackcross. The significant difference was analyzed by Student’s-test. * Significant at the 0.05 probability level.** Significant at the 0.01 probability level.
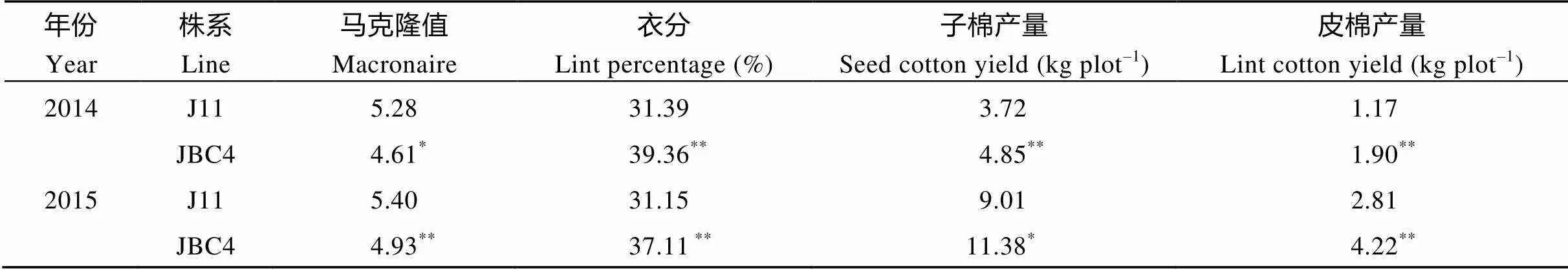
表2 2014–2015年晋棉11和回交后代JBC4纤维品质以及产量比较
J11: 晋棉11; JBC4: 晋棉11与回交4代纯合后代。利用单因素方差分析,*和**分别表示在0.05和0.01水平上差异显著。
J11: Jinmian 11; JBC4: the fourth generation of homozygous progenies ofbackcross. The significant difference was analyzed by one-way ANOVA.*Significant at the 0.05 probability level.**Significant at the 0.01 probability level.
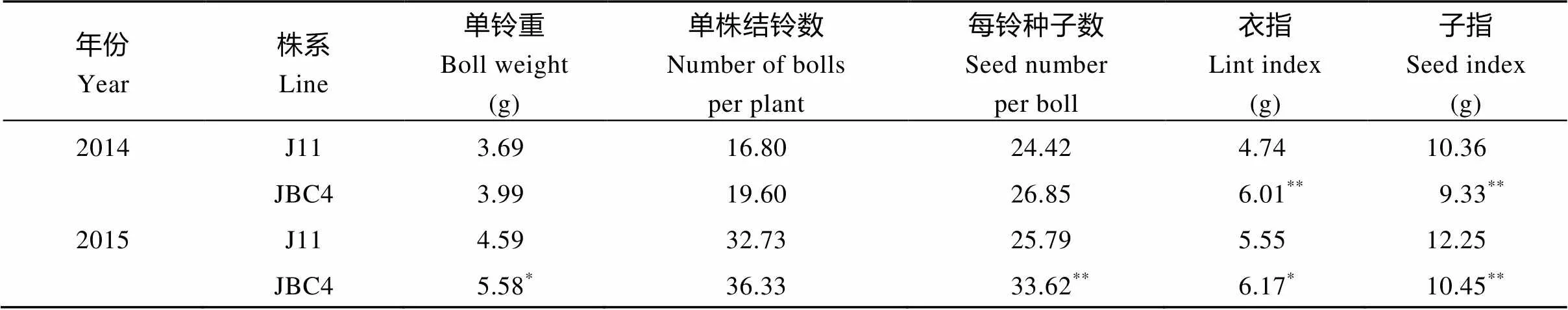
表3 2014–2015年晋棉11和回交后代JBC4产量因子比较
J11: 晋棉11; JBC4: 晋棉11与回交四代纯合后代。利用单因素方差分析,*和**分别表示在0.05和0.01水平上差异显著。
J11: Jinmian 11; JBC4: the fourth generation of homozygous progenies ofbackcross. The significant difference was analyzed by one-way ANOVA.*Significant at the 0.05 probability level.**Significant at the 0.01 probability level.

表4 2015年珂字100和回交后代KBC4纤维品质以及产量比较
K100: 珂字100; KBC4: 珂字100与回交4代。数据分析采用Student’stest检验,*和**分别表示在0.05和0.01水平上差异显著。
K100: Coker 100; KBC4: the fourth generation of progenies ofbackcross. The significant of the difference was analyzed by Student’s-test.*Significant at the 0.05 probability level.**Significant at the 0.01 probability level.
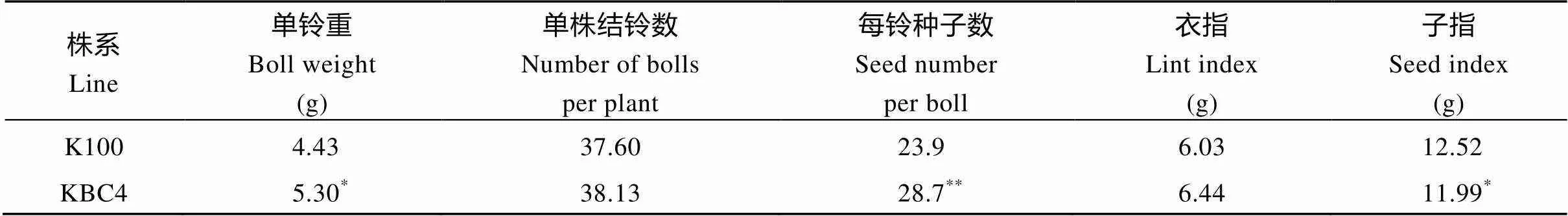
表5 2015年珂字100和回交后代KBC4产量因子比较
K100: 珂字100; KBC4: 珂字100与回交4代。数据分析采用Student’stest检验,*和**分别表示在0.05和0.01水平上差异显著。
K100: Coker 100; KBC4: the fourth generation of progenies ofbackcross. The significant difference was analyzed by Student’s-test.*Significant at the 0.05 probability level.**Significant at the 0.01 probability level.
3 讨论
棉花主要的经济性状均属于数量性状, 受微效多基因控制。其产量与纤维品质之间表现遗传上的紧密负相关[8]。传统育种同步改良棉花纤维产量及品质难度大。Zhang等[4]利用种皮启动子, 在胚珠表皮中表达来源于细菌的生长素合成基因, 使开花当天纤维突起数目增多, 成熟纤维数量增加, 同时其马克隆值也显著下降, 棉花纤维产量以及品质得到同步改良, 获得了纤维产量和细度同步改良的转基因棉花材料IF1-1 (FBP7::iaaM); 刘存敬等[9]利用IF1-1材料, 同16个陆地棉杂交, 利用杂种优势获得了新的高衣分种质, 实现了该种质的育种应用。针对短季棉品种晋棉11衣分低、马克隆值高的缺点, 本研究以此转基因材料为供体亲本, 通过杂交导入转基因性状, 再经连续回交使该性状在晋棉11的遗传背景下表达, 其回交纯合后代在短季棉早熟性和株型等性状上和晋棉11基本一致, 且衣分提高、马克隆值降低, 实现了转基因性状的定向转移。的表达可提高胚珠表皮生长素的含量。检测结果表明, 回交纯合株系JBC4开花当天的胚珠IAA激素含量提高。与晋棉11相比, 回交后代开花当天的胚珠纤维突起数量增加了29.65%; 成熟纤维数量增加了12.8%。2015的田间试验数据显示, 回交纯合株系JBC4的衣分提高到37.1%, 比回交亲本(31.2%)提高了18.9%, 纤维产量提高了50.2%, 马克隆值从5.4下降到4.9, 这同基因在以冀棉14为受体的遗传背景下表达的结果相近(衣分从40.6%提高到48.0%以上, 马克隆值从5.2下降到4.5)。说明在晋棉11的遗传背景下同样能正常行使其功能。同时我们还以从美国引进的珂字100为回交亲本进行了转育, 珂字100的特点是种子大, 纤维马克隆值为B级, 但衣分较低。2015年田间试验数据显示, 回交4代KBC4的衣分提高了7.5%, 纤维产量提高了30.5%。值得一提的是, 珂字100的马克隆值为4.93, 而KBC4为4.63, 马克隆值降低了4.2% (表4和表5), 说明在珂字100的背景下,的表达同样提高了衣分, 降低了马克隆值。刘宏伟等[10]利用该材料通过回交手段改良“华杂棉H318”, 转入基因后, “华杂棉H318”纤维马克隆值显著下降, 但衣分并未提高, 推测其原因为“华杂棉H318”本身是综合性状优良, 高产的棉花品系, 在高衣分的基础上, 进一步提高衣分比较困难。的表达在增加纤维的数量的同时使纤维变细, 会在一定程度上抵消纤维数量增加对提高纤维产量的效应, 尤其是对衣分已经较高的品种更是如此。此外, 导入后可能导致棉花种子变小、子指下降、种子萌发率降低。因此, 在利用该材料改良品种时, 选择衣分低、马克隆值高、且种子较大的品种为对象, 更能发挥该转基因性状的潜力, 避免其缺点。同时, 考虑到衣分提高往往伴随着种子变小, 在转育过程中, 要注意检测目的基因的表达, 防止高衣分后代的丢失。
4 结论
通过将基因导入晋棉11及回交, 在提高其衣分的同时降低了纤维的马克隆值、保留了晋棉11早熟等优良性状。说明利用转基因能够对短季棉品种的产量和品质定向改良。
[1] 喻树迅, 张雷, 冯文娟. 棉花生产规模化, 机械化, 信息化, 智能化和社会服务化发展战略研究. 中国工程科学, 2016, 18(1): 137–148 Yu S X, Zhang L, Feng W J. Study on strategy of large scale, mechanization, informationization, intelligence and social services for cotton production., 2016, 18(1): 137–148 (in Chinese with English abstract)
[2] 詹先进, 陈全求, 张胜昔, 蓝家样, 黄云, 符家平. 当前湖北省早熟棉育种的相关问题与对策. 湖北农业科学, 2009, 48: 2685–2687 Zhan X J, Chen Q Q, Zhang S X, Lan J Y, Huang Y, Fu J P. Problems and countermeasures on breeding technology of cotton earliness in Hubei province., 2009, 48: 2685–2687 (in Chinese with English abstract)
[3] 喻树迅, 宋美珍, 范术丽. 我国短季棉遗传育种研究进展. 棉花学报, 2007, 19: 331–336 Yu S X, Song M Z, Fan S L. Advances of genetics and breeding of short season cotton in China., 2007, 19: 331–336 (in Chinese with English abstract)
[4] Zhang M, Zheng X L, Song S Q, Zeng Q W, Hou L, Li D M, Zhao J, Wei Y, Li X B, Luo M, Xiao Y H, Luo X Y, Zhang J F, Xiang C B, Pei Y. Spatiotemporal manipulation of auxin biosynthesis in cotton ovule epidermal cells enhances fiber yield and quality.2011, 29: 453–458
[5] 刘惠民, 焦明臻. 从晋棉 11号特性探讨育种目标的改进. 山西农业科学, 1990, (11): 7–9 Liu H M, Jiao M Z. Discussion on improvement of breeding target based on characteristics of Jinmian 11., 1990, (11): 7–9 (in Chinese)
[6] Zeng Q W, Qin S, Song S Q, Zhang M, Xiao Y H, Luo M, Hou L, Pei Y. Molecular cloning and characterization of a cytokinin dehydrogenase gene from upland cotton (L.)., 2012, 30: 1–9
[7] Zhao J, Bai W Q, Zeng Q W, Song S Q, Zhang M, Li X B, Hou L, Xiao Y H, Luo M, Li D M, Luo X Y, Pei Y. Moderately enhancing cytokinin level by down-regulation of, expression in cotton concurrently increases fiber and seed yield., 2015, 35: 60
[8] Meredith W R, Bridge R R. Breakup of linkage blocks in cotton,L., 1971, 11: 695–698
[9] 刘存敬, 江振兴, 张建宏, 唐丽媛, 张素君, 田海燕, 李兴河, 师树新, 崔瑞敏, 张香云. 转高衣分棉花种质IF1-1杂种优势分析及育种应用. 河北农业科学, 2016, 20(3): 70–74 Liu C J, Jiang Z X, Zhang J H, Tang L Y, Zhang S J, Tian H Y, Li X H, Shi S X, Cui R M, Zhang X Y. Heterosis analysis and application for the high percentage cotton germplasm IF1-1 with., 2016, 20(3): 70–74 (in Chinese with English abstract)
[10] 刘宏伟, 李南南, 苗玉焕, 柳仕明, 聂以春, 朱龙付, 张献龙. 利用改良华杂棉H318产量与纤维品质研究. 石河子大学学报(自然科学版), 2016, 34: 133–140 Liu H W, Li N N, Miao Y H, Liu S M, Nie Y C, Zhu L F, Zhang X L. Study on yield and fiber quality improvement of ‘Huazamian H318’ with.(Nat Sci Edn), 2016, 34: 133–140 (in Chinese with English abstract)
Improving Fiber Yield and Quality in the Short Season Cotton Variety Jinmian 11 by Introducing
DING Xiao-Yan, ZHAO Juan, QIAN Shan-Shan, YAN Xing-Ying, and PEI Yan*
Biotechnology Research Center, Southwest University, Chongqing, 400716, China
Short season cotton is of particular importance for sustainable development of cotton production in China where has a huge population and limited arable land resources. Usually, early maturity is associated with lower yield and poor quality. We previously developed a novel transgenic cotton material with improved fiber yield and quality by spatiotemporal manipulation of auxin biosynthesis in cotton ovule epidermal cells. In this study, we introducedinto a short season cotton variety Jinmian 11, which has low lint percentage and high macronaire value, through backcross breeding. A consecutive two-year field experiment indicated that the transgenic-homozygous backcrossed progeny (JBC4) exhibited a significant improvement in fiber yield and fiber fineness. Compared with Jinmian 11, lint percentage and lint yield of JBC4 increased by 12.8% and 56.3%, respectively, and meanwhile, the micronaire value decreased by 10.7%. Our data demonstrate a significant potential of thetransgenic in the yield and quality improvement for short season cotton.
auxin;transgene; short season cotton;backcrosse; lint; macronaire
2018-06-12;
2018-06-19.
10.3724/SP.J.1006.2018.01152
裴炎, E-mail: peiyan3@swu.edu.cn
E-mail: DXYWORK2012@sina.cn
2017-10-20;
本研究由国家育种重大专项(2016YFD0100505), 国家转基因生物新品种培育科技重大专项(2016ZX08005-003-004)和国家自然科学基金项目(31130039)资助。
This study was supported by National Major Project of Breeding (2016YFD0100505), the National Major Project for Developing New GM Crops (2016ZX08005-003-004), and the National Natural Science Foundation of China (31130039).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180619.0954.002.html
