多重RT-PCR方法对人肺炎链球菌菌种、血清型及耐药性的鉴别检测
2018-08-09程弘夏秦文英周策凡唐景峰
程弘夏,付 敏,周 立,秦文英,周策凡,4,唐景峰,4*
(1.武汉华夏理工学院,湖北 武汉430223;2. 武汉大学 动物实验中心/ABSL-III实验室,湖北 武汉430072; 3.湖北工业大学 生物工程学院/生物医药研究院,湖北 武汉 430068; 4.基因诊断与肿瘤个性化治疗湖北工程研究中心,湖北 武汉 430070)
0 引言
社区获得性肺炎(CAP)在全球范围内影响着各个年龄人的健康.每年约有140万儿童因该病死亡,5岁以下儿童占18%,且大部分分布在发展中国家[1-3].引起CAP的主要病原体是肺炎链球菌(Streptococcuspneumoniae,SP)感染,其次是肺炎支原体(Mycoplasmapneumoniae,MP)和肺炎衣原体(Chlamydiapneumoniae,CP)等病原体的混合感染.由于上述病原体会引起相同的疾病体征,临床很难准确快速诊断出引起CAP感染的病原体.因此,临床上建立准确且快速鉴别肺炎链球菌及其他菌种感染的检测方法已迫在眉睫.肺炎链球菌,旧称肺炎双球菌或肺炎球菌(Pneumococci),为革兰氏阳性双球菌,属链球菌的一种.肺炎链球菌根据其荚膜特异性多糖抗原分型,目前丹麦分84型(丹麦血清研究所为被WHO认可的唯一抗血清来源),美国分86个血清型.我国曾在20世纪80年代进行全国范围致病菌型调查,从血、脑脊液和中耳分泌物分离的菌株以5型最多,其次为6、1、19、23、14、2、3型等,以第3型毒力最强,儿童则多为6、14、19及23型.肺炎链球菌可引起大叶肺炎、脑膜炎和中耳炎等23种疾病,气候骤变时机体抵抗力降低,发病较多,冬春季多见,可能与呼吸道病毒感染流行有一定关系.目前,临床上主要以注射肺炎疫苗来预防此病,现使用疫苗主要针对肺炎链球菌优势血清型而设计的.肺炎链球菌血清型的疫苗尚在推广之中,如国内7价肺炎球菌结合疫苗尽管在2008年上市但还没有用于儿童免疫计划,而10价和13价肺炎结合疫苗的使用情况还不清楚.有建议提出肺炎球菌疫苗的选择应建立在血清型分布的基础上,而血清型分布又与年龄、地域等因素有关.因此,准确系统地确定肺炎链球菌的血清型分布对于CAP疫苗的选择及防治具有非常重要的意义.
临床上对于CAP有效治疗是基于快速诊断出感染病原体并给予合适的抗生素.然而近年来对大环内酯类抗生素的耐药性逐年上升,特别是肺炎链球菌的耐药最为严重,影响了治疗效果.肺炎链球菌耐药性主要是由编码膜蛋白的mefA和编码核糖体甲基化酶ermB基因引起[4,5].mefA编码的的外排泵膜相关蛋白构成外排泵,该外排泵主动外排进入细菌体内的抗生素而产生耐药.对14和15元环的药物如红霉素、阿奇霉素、克拉霉素有较低的抗药性,而ermB介导的MLSB表型则对大环内酯类、林可酰胺类显示出较强抗药性[6,7].因此,快速鉴别检测肺炎链球菌的菌种、血清型及耐药性对临床CAP的有效治疗非常关键.目前,临床上常用的诊断方法有培养法、平板凝集法(Plate agglutination method, PAT)、酶联免疫吸附法(Enzyme linked immunosorbent assay, ELISA)等.培养法费时费力且阳性检出率只有10%~30%,甚至更低.平板凝集法中荚膜肿胀实验需基于致病菌的提取与培养,因此耗时长花费大,且对实验操作者要求高[8,9].而基于肺炎球菌抗体的ELISA方法同样面临检测耗时长不能同时鉴别多个血清型的问题.多重实时PCR技术(Multiplex real-time PCR, MRT-PCR)中多色荧光检测系统可以在同一个反应管中同时采集和区分6个荧光信号,在反应管中监控6个PCR扩增反应,灵敏度高、特异性强,现已广泛应用于各种传染病病原体的快速精准检测.本研究建立肺炎链球菌的菌种鉴别、血清型分析及耐药基因检测的多重RT-PCR方法,并对其特异性和灵敏度进行评价.
1 材料
1.1 样本
CAP患者痰液或咽拭子标本512份(自2008年1月至2014年7月),武汉大学人民医院、武汉大学中南医院、湖北妇幼保健院采集.诊断标准:1)患者有发热、咳嗽、脓痰、白细胞增多或减少;2)胸部X线片表现有片状、叶状肺泡高密度浸润性病变等;3)患者有呼吸道以外的症状(≥65岁).
1.2 菌株
不同血清型的肺炎链球菌标准:1 (ATCC 12213), 2 (ATCC 11733), 3 (ATCC 6303), 4 (ATCC 6304), 5 (ATCC 6305), 6B (ATCC 6326), 7F (ATCC10351), 8 (ATCC 6308), 9V (ATCC 10368), 9N (ATCC 6309), 10A (ATCC 8334), 11A (ATCC 10343), 12F (ATCC 6312), 14 (ATCC 6314), 15B (ATCC 10354), 17F (ATCC 6317), 18C (ATCC 10356), 19A (ATCC 10357), 19F (ATCC 6319), 20 (ATCC 6320), 22F (ATCC 6322) , 23F (ATCC 6323), 33F (ATCC 10370);耐药菌株(ATCC 49619);支原体标准株FH(ATCC 15531)和M129-B7(ATCC 29342);衣原体标准株AR-39(ATCC 53592);阴性菌株:肺炎克雷伯菌(ATCC 31488) 、金黄色酿脓葡萄球菌(ATCC 13565)、嗜肺军团军(ATCC 33152)、绿脓杆菌(ATCC 35096)、化脓性链球(ATCC 19615).购自美国菌种保藏中心.
1.3 主要试剂及仪器
SAP酶、EXO I酶、Taq酶等PCR扩增体系相关试剂,宝生物工程公司,大连;琼脂平板,Oxoid公司,英国;痰酶,Kyokuto制药工业公司,日本;QIAamp DNA Mini 试剂盒,QIAGEN公司,德国;引物,英骏生物技术公司,上海;TaqMan探针,生工生物股份公司,上海;TaqMan MGB探针,基康生物技术公司,上海; ABI7500荧光定量PCR仪,ABI公司,美国;P360型IMPLEN超微量分光光度计,IMPLEN公司,德国;ABI3130型基因分析仪,ABI公司,美国.
2 方法
2.1 微生物的培养与细菌鉴别
临床样本混悬于1.5 mL胸膜炎类 PPLO肉汤培养基内.痰液样本用含有痰酶PPLO稀释至1.5 mL,取5 μL接种到羊血琼脂平板和巧克力琼脂平板并置于37 ℃,5% CO2培养箱的条件下进行培养.孵育20 h 以后,平板上菌落使用标准化方法[10]进行鉴定.
2.2 肺炎菌株DNA的提取
取4%NaOH液化处理的痰液或咽拭子0.5 mL,加入等量4%NaOH,室温放置10 min,5000 r/min 离心20 min.弃上清,沉淀加入1 ×TE缓冲液1 mL,混匀,5000 r/min 离心20 min,重新洗涤1次.离心后的沉淀依照QIAamp DNA Mini 试剂盒说明书进行DNA提取,并用1 ×TE缓冲液稀释至200 μL备用.标准株及空白对照均按上述方法进行处理.
2.3 引物及TaqMan探针
针对肺炎链球菌菌种鉴别、血清型分析及耐药检测设计了多组引物及探针.① 菌种鉴别:针对CAP致病的肺炎链球菌LytA基因、肺炎支原体P1基因和肺炎衣原体ompA基因设计特异的引物及探针,见表1.② 血清型分析:针对肺炎链球菌cps基因座序列,在NCBI进行Blast比对分析,设计出用于检测肺炎链球菌的23种血清型的特异引物及探针,见表2.③ 耐药性检测:针对肺炎链球菌mefA和ermB基因设计多对引物及探针(表3)进行耐药性检测.以上靶序列均通过NCBI数据库进行BLAST(在线)和MEGA 4.0(离线)比对分析,分析后的最佳靶序列进一步通过Beacon Designer 7.0软件进行引物及探针设计.所有探针3'端均由BHQ或MGB标记,5'端由不同的荧光染料标记.

表1 引物和TaqMan探针用于肺炎链球菌、肺炎支原体、肺炎衣原体检测及扩增序列Tab. 1 Primers and probes used for amplification and detection of S. pneumoniae, M. pneumoniae and C. pneumoniae

表2 肺炎链球菌血清型分析的引物与TaqMan探针序列Tab. 2 Primers and probes used for amplification and detection of serotypes of S. pneumoniae.
续表2

PCR组血清型名称序列 (5'→3')标记GenBank编号长度/bp619F正向引物GGCTTTATTCCATGGGATGATG22619F反向引物GCAATGCAACGTATCACAGTATTGHEX-BHQCR931678.124619F探针TCGCTGTCCCTCGTGAAGCATACGAC26620正向引物TGGAGAAGGGTAGTATAGGTGTTGC25620反向引物TGGATGGACATACATCGTTGAATCROX-BHQCR931679.124620探针CCGATTTATGCTAATGGAACAATATGGAGGAA32722F正向引物GCGCGAATCAAGAGCACTTTA21722F反向引物ACCCGCAATGCTAAGTAGGTATTAGFAM-BHQCR931682.125722F探针TATCCAAGTCGGATCATAGTTGGAACAGATT31723F正向引物CCGATAAAGCTAATAAATAATCTCAGTGA29723F反向引物GCGTCATATTTTCTGCTGACATATAGHEX-BHQCR931685.126723F探针TTGCTGTAGAGGGAATTGGCTTTTCATATGG31733F正向引物ATGGGATAATAAATCTGGAACTGG24733F反向引物GTTCAATGGTTCTAAGACCGTCTGROX-BHQCR931702.124733F探针CAGCAACTATACGCTTTGATGATTATAAGGCTG33

表3 肺炎链球菌耐药性扩增和检测引物和MGB探针序列Tab. 3 Primers and probes used for amplification and detection of the resistance of S. pneumoniae
2.4 单重RT-PCR对肺炎链球菌菌种的鉴别检测
将肺炎链球菌、肺炎支原体及肺炎衣原体特异性基因片段扩增,克隆至PTA-2载体,产物转化至感受态大肠埃希菌DH5ɑ.重组质粒用QIAamp试剂盒纯化保存至-80 ℃,浓度采取 UV-vis测定A260/A280值.根据测定的浓度及目的片段的大小,计算重组质粒拷贝数.重组质粒分别经10倍梯度稀释后用于RT-PCR检测.ddH2O为阴性对照,标准株DNA为阳性对照.单重RT-PCR反应体系包括:样本或标准株DNA 50 μL,1.0 × PCR buffer,3.0 mmol/L MgCl2,0.2 mmol/L dNTPs,2.5 U Hot Start Taq DNA聚合酶.三个PCR扩增管中肺炎链球菌、肺炎衣原体、肺炎支原体PCR引物终浓度分别为0.30、0.35、0.25 μmol/L,各探针终浓度为0.20 μmol/L.最终用ddH2O稀释至50 μL.反应条件为:94 ℃ 5 min,随后94 ℃ 15 s,54 ℃ 30 s,72 ℃ 30 s共40个循环.扩增曲线结果分析:Ct值≤35为阳性扩增.Ct值>35的为阴性扩增.无扩增曲线的为试验失败,需重新提取样本或菌种进行扩增.同时,采用测序法和培养法作对比实验.
2.5 多重RT-PCR对肺炎链球菌菌种的鉴别检测
依据2.4制备和稀释重组质粒,以ddH2O为阴性对照,标准株DNA为阳性对照.多重RT-PCR反应体系包括:样本或标准株DNA 1 μL,1.0 × PCR buffer,3.5 mmol/L MgCl2,0.2 mmol/L dNTPs,2.5 U Hot Start Taq DNA聚合酶.肺炎链球菌、肺炎衣原体和肺炎支原体PCR引物终浓度分别为0.35、0.45、0.35 μmol/L,各探针终浓度为0.25 μmol/L.最终用ddH2O稀释至50 μL.反应条件为:94 ℃ 10 min,随后94 ℃ 30 s,55 ℃ 60 s,72℃ 35 s共40个循环.扩增曲线结果分析:Ct值≤35为阳性扩增.Ct值>35的为阴性扩增.无扩增曲线的为试验失败,需重新提取样本或菌种进行扩增.同时,采用测序法和培养法作对比实验.
2.6 多重RT-PCR对肺炎链球菌血清型的鉴别检测
基于cps基因座序列信息,鉴别肺炎链球菌血清型.根据序列的信息,23种与致病有关的肺炎链球菌血清型被分为7组:①血清型1-5;②血清型6B,7F;③血清型8,9N/V,10A;④血清型11A,12F,14;⑤血清型15B,17F,18C;⑥血清型19A,19F,20;⑦血清型22F,23F,33F.将上述分组,在荧光定量扩增板上进行分组,采用多重RT-PCR对肺炎链球菌血清型进行分析.反应体系50 μL包括:样本或标准株DNA 1 μL、1.0 × PCR buffer,3.5 mmol/L MgCl2,0.2 mmol/L dNTPs,2.5 U HotStart Taq DNA聚合酶,引物的最终浓度分别为0.15 μmol/L 和0.4 μmol/L,探针浓度为0.25 μmol/L.PCR反应条件为:94 ℃ 10 min,随后94 ℃ 30 s,55 ℃ 60 s共40个循环.扩增曲线结果分析:Ct值≤35为阳性扩增.Ct值>35的为阴性扩增.无扩增曲线的为试验失败,需重新提取样本或菌种进行扩增.采用荚膜肿胀试作为对比实验.
2.7 多重RT-PCR对肺炎链球菌耐药基因的检测
选用临床样本中的耐药肺炎链球菌在37 ℃培养,采用琼脂稀释法测定其红霉素、阿奇霉素、万古霉素、克拉霉素、交沙霉素、泰利霉素、青霉素、左氧氟沙星的最小抑菌浓度,用SPSS软件对试验结果进行分析.
设计针对耐药基因的特异TaqMan探针,采用多重RT-PCR法对肺炎链球菌耐药基因进行检测.50 μL反应体系包括:1.0 × PCR buffer,4.5 mmol/L MgCl2,0.3 mmol/L dNTPs,2.5U HotStart Taq DNA聚合酶.0.4 μmol/L肺炎链球菌ermB基因特异性引物,0.45 μmol/L 的肺炎链球菌mefA特异性引物,0.35 μmol/L 的肺炎链球菌ermBTaqMan探针,0.3 μmol/L 的肺炎链球菌mefATaqMan探针,和1μL肺炎链球菌DNA.PCR反应条件为:94 ℃ 10 min,随后94 ℃ 30 s,55 ℃ 60 s共40个循环.扩增曲线结果分析:Ct值≤35为阳性扩增.Ct值>35的为阴性扩增.无扩增曲线的为试验失败,需重新提取样本或菌种进行扩增.
3 结果
3.1 多重RT-PCR特异性及灵敏度
研究结果显示,在对3种致病菌检测中,多重RT-PCR特异性好,5种阴性菌株均无扩增.与单重RT-PCR检测结果一致性好,见图1.

图1 多重RT-PCR致病菌拷贝对数(纵坐标)和单重RT-PCR致病菌拷贝对数(横坐标)检测临床阳性样本相关性Fig. 1 Correlation between multiplex FQ-PCR and simplex FQ-PCR for detecting the three pathogens positive clinical specimens
(a) 32例临床肺炎衣原体(CP)阳性样本DNA滴度性; (b) 83例临床肺炎支原体(MP)阳性样本DNA滴度;(c) 189个肺炎链球菌(SP)临床阳性样本DNA的滴度;(d) 肺炎链球菌两种测定方法相关性,r=0.990;(e)肺炎支原体P两种测定方法相关性,r=0.988 ;(f) ;肺炎衣原体两种测定方法相关性,r=0.987
3.2 多重RT-PCR对肺炎链球菌菌种鉴别
对512个临床样本分别采用测序、培养和多重RT-PCR方法分析,采用SPSS(17.0)进行的统计学分析,结果显示多重RT-PCR与测序法有很好的一致性,统计学比较无差异(P> 0.05),与细菌培养比较有显著差异(P< 0.01),测序和多重RT-PCR较培养法具有更好的灵敏度.
304个阳性临床样本经过多重RT-PCR检测,45例样本拷贝数在102~103copies/mL,59例样本拷贝数在103~104copies/mL,122例样本拷贝数在104~106copies/mL,62例样本拷贝数在106~107copies/mL,16例样本拷贝数在超过107copies/mL.304例临床阳性样本其中189例(62.2%)为肺炎链球菌阳性,83例(27.3%)为肺炎支原体阳性,32例(10.5%)为肺炎衣原体阳性,具体见表4.
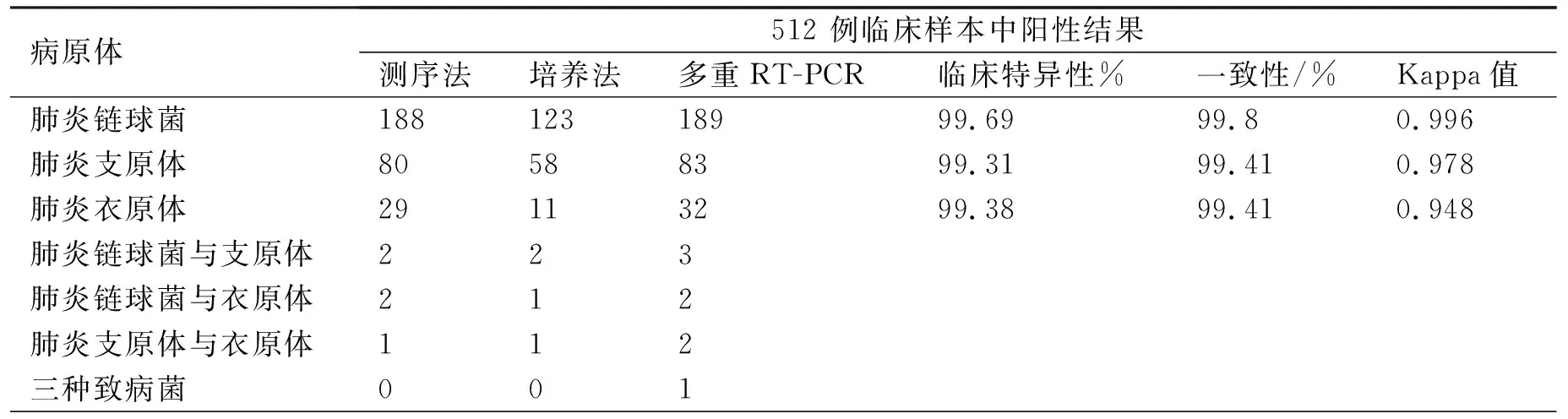
表4 测序法、培养法与多重RT-PCR对临床样本测定结果Tab. 4 Comparison of multiplex RT-PCR with sequencing and culture for detecting the three pathogens in clinical specimens
3.3 多重RT-PCR对肺炎链球菌菌种血清型分析
通过多重FQ-PCR方法对189 例肺炎链球菌阳性样本血清型分析,结果显示:19 (19.58%, 37/189),23 (15.87%, 30/189),6 (13.23%, 25/189),14 (6.3%, 12/189),其他血清型 (22.75%, 43/189),其他血清型 (22.22%, 42/189).具体见表5.所得结果与荚膜肿胀试验结果一致,从肺炎链球菌血清型分析可以看出优势血清型为6,14,19和23.

表5 多重RT-PCR对阳性临床样本肺炎链球菌血清型研究结果Tab. 5 The result of S. pneumoniae serotypes in the positive samples by multiplex RT-PCR
3.4 多重RT-PCR对肺炎链球菌菌种耐药性分析
通过多重FQ-PCR方法对189 例肺炎链球菌阳性样本的耐药性检测分析显示:115例(60.85%)耐药性与基因ermB有关,56(29.63%)例耐药性与基因mefA有关,15例(7.94%)耐药性与上述2种基因均有关.根据MIC试验分析113例(59.79%)耐药性与基因ermB有关,56(29.63%)例耐药性与基因mefA有关,14例(7.41%)耐药性与上述2种基因均有关.测序结果显示115例(60.85%)耐药性与基因ermB有关,56(29.63%)例耐药性与基因mefA有关,14例(7.41%)耐药性与上述2种基因均有关,具体见表6.

表6 肺炎链球菌阳性样本耐药性检测结果Tab. 6 The results of resistance in S. pneumoniae positive samples
4 讨论
肺炎链球菌是CAP疾病的主要致病菌,其不同血清型分布随地域及患者年龄不同而不同,因此WHO推荐了解血清型分布是给药合适疫苗防治该疾病的关键.多重RT-PCR方法对临床304例疑似阳性样本检测分析结果显示,CAP主要致病菌的结果与日本和美国相似[11].同时肺炎支原体是CAP致病的又一常见病原体,本实验结果的阳性率高于美国学者的研究结果[12].多重RT-PCR方法对肺炎链球菌血清型分析结果与中国的血清型分析一致[8,9].多重RT-PCR对肺炎链球菌耐药基因分析结果与日本的研究数据相似,但耐药性与ermB基因相关的比例高于美国[13,14].
5 结论
多重RT-PCR方法可在一次PCR扩增检测中,快速区分引起社区获得性肺炎的肺炎链球菌、肺炎支原体和肺炎衣原体等3种致病菌,快速检测患者感染肺炎链球菌血清型和耐药性.该方法特异性好、灵敏度高及方便快速.多重RT-PCR方法可用于肺炎链球菌菌种鉴别、血清型分型及耐药性分析,检测准确,快速方便,适合临床CAP的快速诊断,具有很高的应用推广意义,对提高CAP的病原体和流行病学研究及指导临床用药具有很好的推动作用.
