香茅醛肟及其烷基醚的合成及抑菌活性研究
2018-08-08肖转泉王宗德范国荣
黄 晶, 肖转泉, 王宗德*, 范国荣
(1.江西农业大学 林学院;国家林业局/江西省樟树工程技术研究中心, 江西 南昌 330045; 2.江西师范大学 化学化工学院, 江西 南昌 330027)
山苍子是我国南方重要的经济树种,其很多部位(花、叶、果实)都可以提取出山苍子油[1],我国的山苍子油年产量和出口量长期以来都居世界首位[2]。但是目前我国对山苍子油的利用尚处在初级阶段,以加工成半成品和原料直接出口为主,经济效益低,需对其进行精深加工利用,而众所周知山苍子油中含柠檬醛高达70%[3],因此,对山苍子油的精深加工利用应当主要考虑对柠檬醛的利用。肟及肟醚类化合物具有良好的生物活性[4-5],是制作农药的重要成分,具有相当强的杀虫、抗菌作用[6],且低毒、安全,符合现代化学对农药的要求,具有很大的发展前景。直接以柠檬醛为原料合成的柠檬醛肟类化合物及其活性测试已有了相关报道[7-8],且较为系统全面,为进一步研究并得到更多新型化合物,考虑以柠檬醛为原料先合成其中间体再加以利用。柠檬醛在催化剂作用下能选择性合成香茅醛,而且转化率高[9],香茅醛本身就具有较好的抑菌及杀虫等活性[10],且能进一步合成肟及肟醚类化合物。因此,本研究以柠檬醛合成得到的香茅醛为原料与盐酸羟胺肟化制备香茅醛肟,接着在氢氧化钠饱和液提供的碱性环境下与卤代烷反应合成了4种香茅醛肟烷基醚,并以百菌清为阳性对照,采用菌丝生长速率法测定了这5种化合物对11种植物病原真菌的抑制作用,以期为山苍子油的高值化应用提供一个新方向,并有望为多种植物病原菌所引起的植物疾病的防治提供新的防治方案。
1 实 验
1.1试剂、菌种与仪器
香茅醛,GC纯度95%;盐酸羟胺、溴乙烷、溴丙烷、溴代正丁烷、溴代正戊烷、氢氧化钠、碳酸钠等试剂均为市售化学纯。
植物病原真菌:油茶炭疽病菌(Glomerellacingulata)、层出镰刀菌(Fusariumproliferatum)、梨链格孢菌(Alternariakikuchiana)、辣椒菌核病菌(Sclerotiniasclerotiorum)、水稻纹枯病菌(Rhizoctoniasolani)、辣椒疫霉病菌(Phytophthoracapsici)、毛竹枯梢病菌(Ceratosphaeriaphyllostachydis)、猕猴桃果实拟茎点霉菌(Botryisphariadothide)、葡萄炭疽病菌(Colletorichumgloeosporioides)、莴苣菌核病菌(Lettucesclerotinia),七叶树壳孢菌(Fusicoccumaeculi)均由江西农业大学林学院森保教研室提供。
福立GC9790型气相色谱仪,浙江温岭福立分析仪器有限公司;HW-2000色谱工作站,上海千谱软件有限公司;Nicolet iS10红外光谱仪,美国赛默飞世尔科技公司;Bruker AVANCE 400型核磁共振仪,瑞士Bruker公司;Agilent 5977A型质谱仪、Agilent 7980B型气相色谱仪,美国Agilent公司。
1.2合成方法
香茅醛(1)与盐酸羟胺反应,合成得到香茅醛肟(2),再在氢氧化钠饱和液提供的碱性环境下[11]与4种溴代烷反应合成了4种香茅醛肟烷基醚(3a~3d),合成路线见图1。
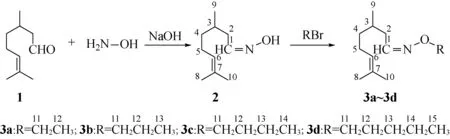
图1 香茅醛肟(2)及其烷基醚(3a~3d)的合成路线Fig. 1 The synthesis route of citronellal oxime(2) and its alkyl ethers(3a-3d)
1.2.1香茅醛肟(2)的合成 在150 mL磨口锥形瓶内依次放入磁力搅拌子、0.1 mol香茅醛、0.06 mol碳酸钠和20 mL水,置于磁力加热搅拌器上,安装回流冷凝管,开始搅拌。将0.12 mol盐酸羟胺溶于15 mL水中,通过小滴液漏斗以每3秒钟1滴的速度滴加至反应瓶内。加完后开始加热,以40 ℃反应15 min,加热至50 ℃再反应15 min,加热至65 ℃反应2 h后,取反应液中的油层用石油醚稀释后经洗涤、干燥,做气相色谱分析。当反应液中不再含有香茅醛时停止加热,搅拌下冷却至室温,分出水层。油层经饱和食盐水洗涤和无水硫酸钠干燥后,真空蒸馏出产品香茅醛肟[11]。
1.2.2香茅醛肟烷基醚(3a~3d)的合成 在150 mL锥形瓶内依次加入0.05 mol香茅醛肟(2),石油醚(60~90 ℃)20 mL,溴代烷0.15~0.2 mol,四丁基溴化铵0.5 g,40%氢氧化钠水溶液6 g,搅拌下加热回流。反应8 h后开始取有机层液体做气相色谱分析,如仍有香茅醛肟,则继续反应,每隔2 h取样分析,至反应液中香茅醛肟的含量不再降低时,即停止反应,冷却,分出水层,有机层经食盐水洗涤、无水硫酸钠干燥、蒸馏回收石油醚,最后真空蒸馏得到化合物3a~3d(不同的溴代烷对应不同的产物)[8]。
1.3样品测试
1.3.1红外光谱分析 通过液膜法制备红外分析样品,在红外光谱仪上分析。
1.3.2核磁共振分析 以TMS为内标,CDCl3为溶剂在核磁共振仪上分析,1H NMR观测频率为400 MHz,13C NMR观测频率为100 MHz。
1.3.3GC-MS分析 分析所用仪器色谱部分为Agilent 7890B型气相色谱仪, 质谱部分为Agilent 5977A 型质谱仪, 色谱柱采用Agilent HP-5MS型毛细管柱。试样溶解于甲醇,每次进样量约为5 μL,气化室温度240 ℃,质谱接口温度250 ℃,EI离子源,EI电离电压70 eV,离子源温度230 ℃,四极杆温度150 ℃。采用程序升温法进行组分的分离:80 ℃保持2 min后以升温速率8 ℃/min升温至180 ℃,再以升温速率10 ℃/min升温至240 ℃,在240 ℃保持15 min后降温,测试结束。
1.4抑菌活性测试
采用菌丝生长速率法[12],将所合成的5个化合物(2和3a~3d)对11种植物病原真菌进行抑菌活性测试。操作如下:在无菌条件下,将化合物配制成质量浓度为5 g/L的溶液,按一定的比例加入到经灭菌处理的马铃薯葡萄糖琼脂培养基中,得到最终质量浓度为500 mg/L的含药培养基平板。取已活化且培养好的植物病原真菌菌饼(直径5 mm),接到上述含药培养基上,每个培养皿上接一个菌饼,菌饼位于培养皿正中央,重复3次。以未加任何化合物的马铃薯葡萄糖琼脂(PDA)培养基平板作为空白对照组,百菌清为阳性对照。当空白对照组平板的菌落直径长到培养皿的2/3左右,用十字交叉法测量所有培养的真菌菌落直径,取平均值,分别得到每个培养皿中真菌菌落平均直径,按下述公式计算出对照组菌落直径、处理组菌落直径以及菌丝生长抑制率:
菌落直径=菌落平均生长直径-菌饼直径
菌丝生长抑制率=(空白对照组菌落直径-处理组菌落直径)/空白对照组菌落直径×100%
2 结果与讨论
2.1化合物的结构分析






2.2化合物的抑菌活性
对化合物2和3a~3d对11种植物病原菌的抑菌性能进行测定,抑制率结果见表1。
由表可以看出:在药液质量浓度为500 mg/L时,5种化合物对11种植物病原真菌都有一定的抑制作用,化合物2的抑制作用特别优良,对梨链格孢菌、辣椒菌核病菌、水稻纹枯病菌、辣椒疫霉病菌、毛竹枯梢病菌和猕猴桃果实拟茎点霉菌的抑制率均高达100%,对层出镰刀菌和油茶炭疽病菌的抑制率达到95%及以上,均优于同等浓度下百菌清的抑制作用;化合物3a对莴苣菌核病菌的抑制率高达100%,优于同等浓度下百菌清的抑制作用;化合物3b对葡萄炭疽病菌的抑制率高达100%,优于同等浓度下百菌清的抑制作用;化合物3c对毛竹枯梢病菌的抑制率高达87.7%,优于同等浓度下百菌清的抑制作用,对七叶树壳孢菌稍有促进作用;化合物3d对莴苣菌核病菌的抑制率达到96.2%,优于同等浓度下百菌清的抑制作用。
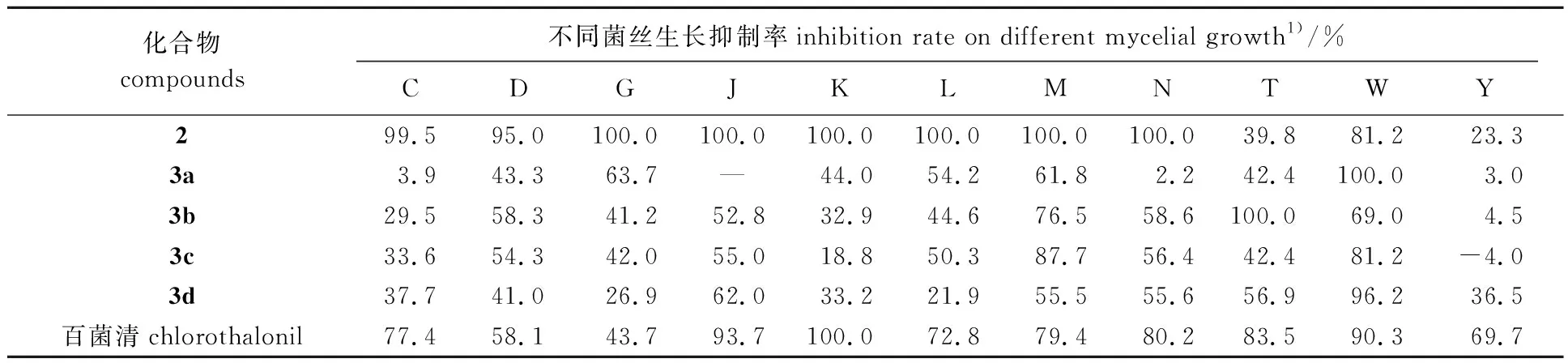
表1 化合物在500 mg/L下对11种植物病原真菌菌丝生长的抑制率
1)C:油茶炭疽病菌G.cingulata;D:层出镰刀菌F.proliferatum;G:梨链格孢菌A.kikuchiana;J:辣椒菌核病菌S.sclerotiorum;K:水稻纹枯病菌R.solani;L:辣椒疫霉病菌P.capsici;M:毛竹枯梢病菌C.phyllostachydis;N:猕猴桃果实拟茎点霉菌B.phariadothide;T:葡萄炭疽病菌C.gloeosporioides;W:莴苣菌核病菌L.sclerotinia;Y:七叶树壳孢菌F.aeculi
3 结 论
3.1由香茅醛和盐酸羟胺合成得到香茅醛肟(2),再与4种溴代烃反应制得了4个香茅醛肟烷基醚(3a~3d),并采用红外光谱(FT-IR)、核磁共振(1H NMR、13C NMR)、气质联用(GC-MS)对其结构进行表征,从表征结果可以看出3a~3d的结构与理论目标化合物结构相吻合。
3.2抑菌活性测试结果表明香茅醛肟(2)对所选植物病原真菌的抑制能力更为优良且范围较广。化合物2对梨链格孢菌、辣椒菌核病菌、水稻纹枯病菌、辣椒疫霉病菌、毛竹枯梢病菌和猕猴桃果实拟茎点霉菌的抑制率均高达100%,对层出镰刀菌和油茶炭疽病菌的抑制率达到95%及以上;化合物3a对莴苣菌核病菌的抑制率高达100%;化合物3b对葡萄炭疽病菌的抑制率高达100%;化合物3c对毛竹枯梢病菌的抑制率高达87.7%;化合物3d对莴苣菌核病菌的抑制率达到96.2%;以上所提均高于百菌清对这几种植物病原真菌的抑制率。香茅醛肟及其烷基醚在抑制植物病原真菌方面有着较好的应用价值,说明由香茅醛合成香茅醛肟等有着重要的意义。
