颅内HPC的MRI影像学特征研究
2018-08-07河南省驻马店市第一人民医院磁共振室河南驻马店463500
河南省驻马店市第一人民医院磁共振室 (河南 驻马店 463500)
孟志霞 魏 林 潭卫锋
颅内血管外皮细胞瘤(hemangiopericytoma,HPC)临床较为少见,因其与脑膜瘤具有相似MRI影像学特征,故而本病术前定性诊断较为困难[1]。但由于颅内HPC血运较为丰富,术中出血较难控制,导致无法完全切除肿瘤,进而增加肿瘤转移和复发的概率,因而,术前颅内HPC的早期诊断显得具有重要意义。影像学检查是术前诊断颅脑HPC的主要方法[2],但目前对MRI多功能成像在HPC诊断中的研究尚不全面。故而,本研究深入探讨了颅内HPC的MRI影像学特征,旨在为临床颅内HPC的诊断提供参考,现报道如下。
1 资料与方法
1.1 一般资料选取2013年1月至2018年1月在我院治疗的HPC患者23例(HPC组),同时选取血管瘤型脑膜瘤患者70例作为对照(脑膜瘤组),两组患者性别、年龄比较差异无统计学意义(P>0.05),见表1。纳入标准:(1)均经手术病理确诊;(2)术前MRI影像资料保存完整;(3)患者及家属知情同意。排除标准:(1)MRI检查前已接受过放化疗等治疗;(2)既往有脑卒中、颅脑其他类型肿瘤性疾病者。
1.2 病理检查肿瘤标本甲醛(4%)24h固定后,常规制片分别进行HE染色和Ki63染色;免疫组化标记是用EnVision法进行,DAB显色,苏木精复染,每次染色均行阴性和阳性对照。
1.3 MRI检查所有患者均使用我院1.5 TMRI扫描仪(美国GE公司生产)检查。T1WI使用SE序列,T2WI使用快速自旋回波序列。T1WI:TE11ms,TR500ms;T2WI:TE85ms,TR2200ms;型冠状位、矢状位和轴面扫描;0.2mL/Kg Gd-DTPA对比剂肘静脉注射进行增强扫描。
1.4 统计学处理统计分析采用SPSS19.0软件,计量资料采用(±s)表示,比较使用t检验,计数资料比较使用χ2检验或Fisher精确检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 病理结果23例HPC中,经病理诊断14例为高分化HPC(病理性核分裂像<5/10HPF和/或Ki63染色阳性细胞<30%;细胞核异型性不明显,瘤区坏死不明显),9例为间变性HPC(病理性核分裂像≥5/10HPF和/或Ki63染色阳性细胞≥30%;同时有以下2项:瘤细胞中度以上丰富,核中度至重度异形,有出血,瘤区出现坏死囊变)。
2.2 HPC组和脑膜瘤组MRI表现比较HPC组和脑膜瘤组肿瘤形态、肿瘤坏死囊变、肿瘤与附着硬膜关系、T2WI信号和肿瘤强化程度影像表现差异有统计学意义(P<0.05),见表2。
2.3 不同分化HPC影像表现比较间变性HPC肿瘤坏死囊变比例为66.67%,高于高分化HPC(P<0.05);高分化HPC和间变性HPC肿瘤形态、硬膜尾征、肿瘤与附着硬膜关系、T1WI信号、T2WI信号和肿瘤强化程度影像表现差异无统计学意义(P>0.05),见表3。
2.4 典型病例某女性患者,45岁,右颞间变性HPC,TIWI平扫显示肿瘤边界不清,呈类圆形,瘤体内可见大片状液化坏死低信号区,邻近组织受压移位,中线结构左移,见图1,T2WI平扫可见肿瘤体内有大片状液化坏死高信号影,瘤体呈窄基底附着于脑膜,见图2;某男性患者,32岁,右颞枕高分化HPC,T1WI显示肿瘤呈分叶状,边界清楚,瘤体可见小斑片状略低信号影,见图3,T2WI可见瘤体小斑片状略高信号影,见图4。
3 讨 论
颅内血管外皮细胞瘤来源于脑膜间质的毛细血管细胞,是一种少见的颅内恶性肿瘤。由于颅内血管丰富、血管外皮细胞瘤极易复发,恶性程度较高,治疗需术前血管栓塞,术中扩大切除范围、术后辅以放疗[3]。但良性脑膜瘤与高分化血管外皮细胞瘤具有相似影像表现,极易出现误诊,但目前关于间变性血管外皮细胞瘤的影像特征认识尚不充分,颅内HPC的术前诊断准确率不高。因而,探寻不同分化程度颅内HPC的影像学特征,对提高术前诊断准确率、治疗和预后效果意义重大[4-5]。
影像学检查是术前诊断颅脑肿瘤的主要方法之一,其中MRI检查凭借信息丰富和高分辨率等特点在临床应用广泛。MRI能够较好地显示肿瘤的内部结构和瘤周改变,对肿瘤的信号不均匀性、瘤内出血、流空效应、肿瘤和硬膜的关系、增强特征及颅骨破坏、囊变与坏死及“硬膜尾征”能很好显示。研究发现良胜肿瘤与恶性肿瘤相比,相关改变与肿瘤组织的病理级别关系密切,其囊变与坏死、信号强度、增强程度以及瘤周水肿与病理超微结构均存在一致性,故而可对肿瘤组织的生物学行为和病理学特征进行有效反映[6-8]。

表1 两组一般资料比较

表2 HPC组和脑膜瘤组MRI表现比较
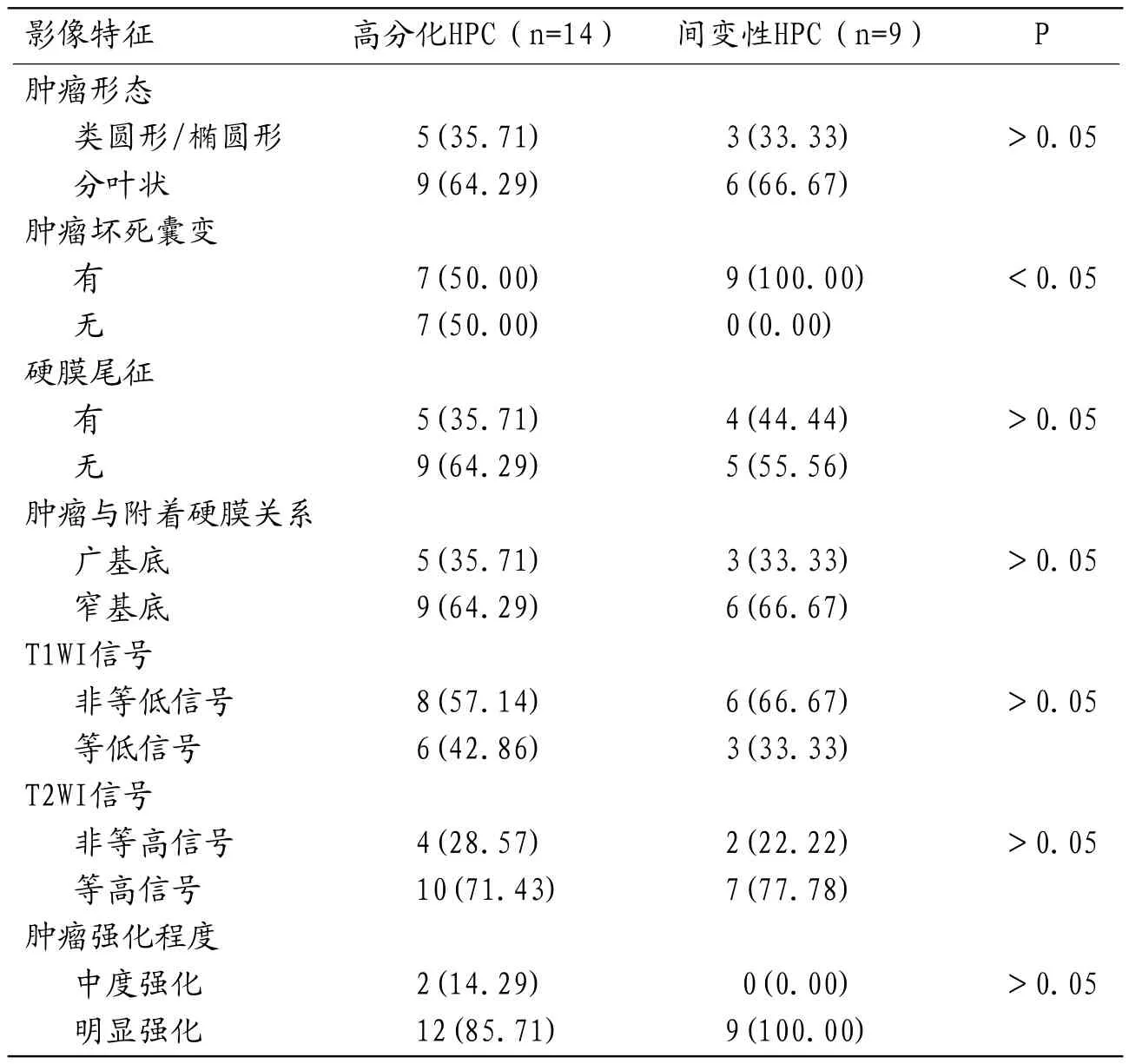
表3 不同分化HPC影像表现比较
本研究病理学结果显示23例HPC中,经病理诊断14例为高分化HPC,9例为间变性HPC。间变性瘤细胞更加丰富,瘤区出现坏死较多见,核异型性明显;与间变性HPC相比,高分化HPC边界较清楚、形态较规整,出血及坏死囊变较少。本研究MRI影像学结果显示HPC组肿瘤形态呈分叶状、肿瘤坏死囊变、瘤体呈窄基底附着硬膜、T2WI呈等高信号、肿瘤明显强化比例均高于脑膜瘤组(P<0.05)。上述结果提示颅脑HPC与脑膜瘤MRI特征存在较大差别。HPC组肿瘤形态呈分叶状说明肿瘤生长速度较快,具有侵袭性恶性生长的特点,而脑膜瘤多呈椭圆形、圆形和扁圆形,这可能是因为脑膜瘤生长较缓,瘤细胞主要成漩涡状生长的紧密排列;血管外皮细胞瘤T2WI由于肿瘤内存在出血和坏死囊变导致病变呈高低混杂信号,主要由于肿瘤的血液供给无法满足肿瘤的生长需要,进而导致肿瘤出现组织囊变、坏死[9-11]。

图1-4 MRI影像图。图1:T1WI轴位;图2:T2WI轴位;图3:T1WI轴位;图4:T2WI轴位。
高分化和间变性HPC患者的MRI表征结果显示间变性HPC肿瘤坏死囊变比例为100.00%,高于高分化HPC(P<0.05);高分化HPC和间变性HPC在肿瘤形态、硬膜尾征、肿瘤与附着硬膜关系、T1WI信号、T2WI信号和肿瘤强化程度等影像表现方面差异无统计学意义(P>0.05)。上述结果提示不同分化HPC的MRI影像表现有一定差异。高分化HPC脑膜尾征较少见,硬膜与窄基底相连,肿瘤可能不来源于蛛网膜帽细胞;间变性HPC瘤体新生血管较多,血液供应丰富,具有显著的强化效应[12-13]。
综上所述,颅内HPC的MRI影像表现具有一定特征性,且不同分化HPC的MRI影像表现有一定差异。
