化学实验三大热点技巧攻略
2018-08-06山东胡海昊张传迎
山东 胡海昊 张传迎
化学实验是高考盛宴中的传统菜系,且是压轴菜系,是历年考生颇感头疼的一个题型。该类题目往往以仪器的组装、实验的改进、评价和设计等为考查方向,考查考生分析和解决问题、实验操作、实验设计和创新等能力。根据实验中是否含有计算题型,也可以将综合实验分为定量实验与定性实验。文章结合近年的高考试题,将实验题的突破技巧予以诠释和解读。
突破点一:明确实验目的,建立答题模板
【例1】(2017·全国卷Ⅰ·26题节选)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。

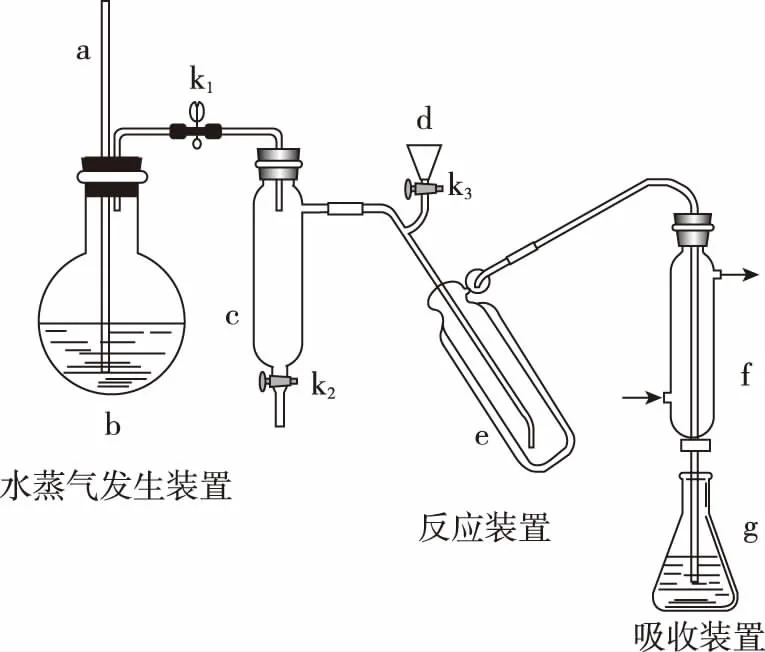
回答下列问题:
(2)b中放入少量碎瓷片的目的是__________。f的名称是__________ 。注意直形冷凝管、球形冷凝管在实验中的不同用法
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水。重复操作2~3次。倒吸,在多数实验中要避免,而在本题中得到了有益的作用
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。
【答案】(1)避免b中压强过大
(2)防止暴沸 直形冷凝管
(3)c中温度下降,管路中形成负压
(4)①液封,防止氨气逸出
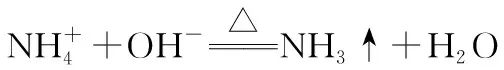
【解题策略】
实验简答题答题模板
(1)滴定终点的现象:
当最后一滴××滴入时,锥形瓶中溶液恰好由××颜色变成××颜色,且半分钟内不复原或不褪色。
(2)实验操作:
②沉淀剂是否过量的判断方法:静置,向上层清液中继续滴加少量沉淀剂,若无沉淀产生,则证明沉淀剂已过量。
③洗涤沉淀操作:将蒸馏水沿着玻璃棒注入过滤器中至浸没沉淀,待水滤出,重复2~3次即可。
④判断沉淀是否洗净的操作:取少量最后一次洗涤的滤液,滴加××试剂,若没有××现象,证明沉淀已经洗净。
(3)易混淆的两种结晶方法:
①溶解度受温度影响较小的溶质转化为晶体的操作:蒸发→结晶→过滤→洗涤→干燥。
②溶解度受温度影响较大或带结晶水的溶质转化为晶体的操作:蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
(4)简单实验的设计:
操作(取样,加入××)⟹现象 (如果有××生成)⟹结论(说明××的是××)。
(5)熟悉常考仪器作用的叙述:
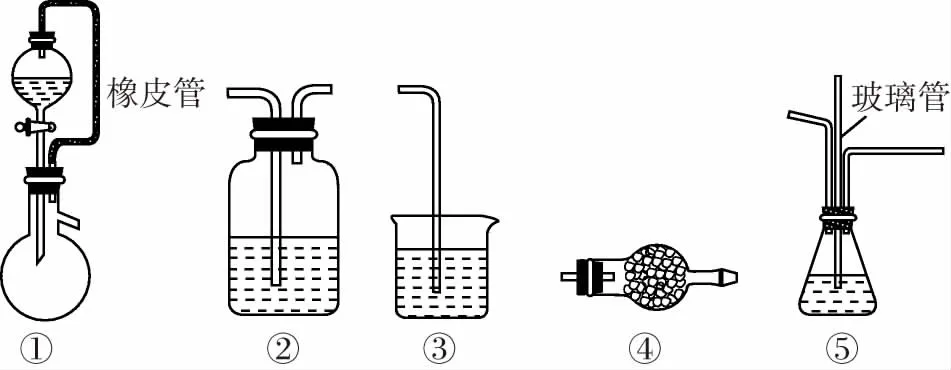
实验仪器①中橡皮管的作用:平衡压强,使液体能顺利滴下;降低液体体积对气体体积测量的干扰。
实验仪器②的作用:干燥或除去气体中的杂质。
实验仪器③的作用:吸收尾气,防止污染空气。
实验仪器④的作用:干燥气体或吸收气体;防止空气中二氧化碳、水蒸气对实验的影响。
实验仪器⑤的作用:安全瓶,防止瓶内压强过大。
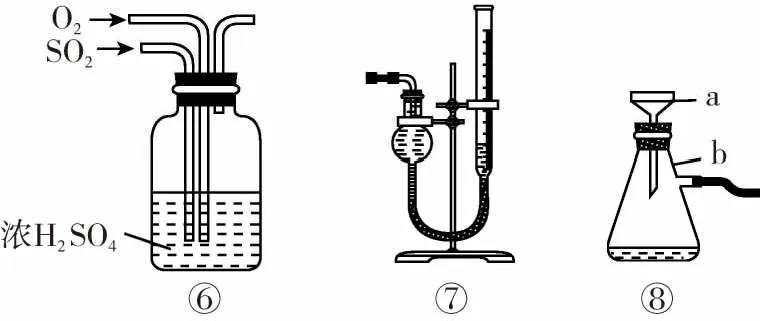
实验仪器⑥的作用:混合气体;干燥气体;通过观察气泡速率控制流量。
实验仪器⑦的作用:测量气体体积。读数时注意:装置冷却到室温,上下移动量气管使两液面高度一致,平视量气管内凹液面最低处读出数值。
实验仪器⑧中仪器名称与作用:a为布氏漏斗,b为抽滤瓶或吸滤瓶,两者组合配合抽气,使抽滤瓶内压强减小,加快过滤的速率。
突破点二:准确连接装置,理解操作顺序
【例2】(2016·全国卷Ⅰ·26题节选)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
氨气的制备
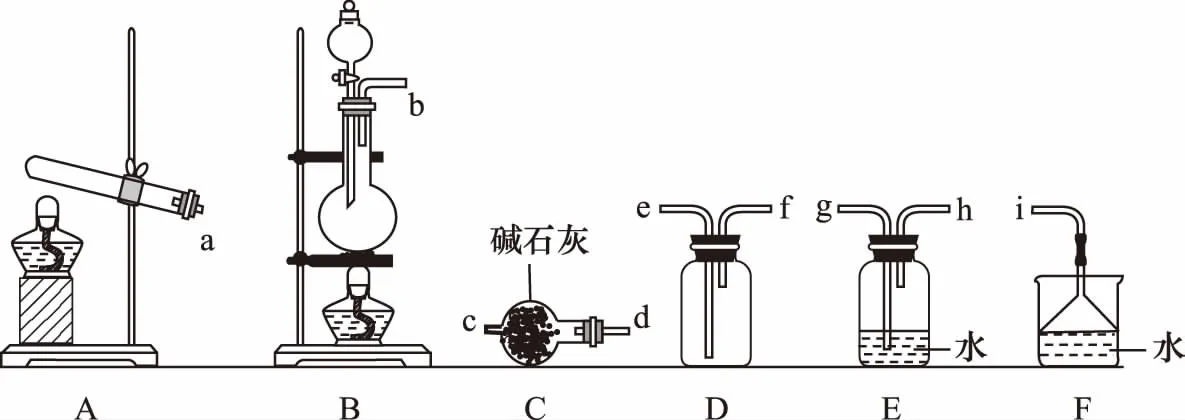
①氨气的发生装置可以选择上图中的________,反应的化学方程式为__________
______________________________。考查基本知识:氨气的制备,注意气体发生装置不同,则反应原理不同
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→________________________(按气流方向,用小写字母表示)。目的:氨气的提纯、收集。理解不同装置的作用,则仪器连接就会水到渠成

②dcfei
【解题策略】
1.实验流程
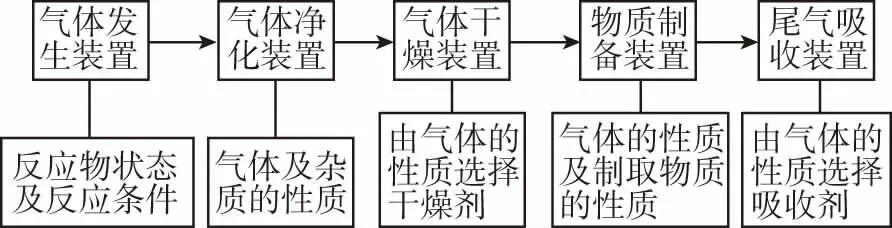
2.装置连接顺序
(1)分析各装置的作用,按实验流程连接;填接口连接顺序时还应注意:洗气或干燥气体时导气管长进短出,干燥管大口进小口出。
(2)净化气体时:一般先除去有毒、有刺激性气味的气体,后除去无毒、无味的气体,最后除水蒸气。
(3)检验混合气体时:先检验水蒸气,再检验并除去较活泼气体,最后检验其他气体。如蔗糖与浓硫酸反应时混有少量SO2、CO2及水蒸气,应先用无水CuSO4检验水蒸气,再用品红溶液检验SO2,用酸性高锰酸钾溶液除去SO2,然后用澄清石灰水检验CO2。
突破点三:化学实验中的计算
【例3】(1)(2017·全国卷Ⅱ·28题)某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定

①取100.00 mL水样经固氧、酸化后,用amol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为__________;注意滴定终点描述的关键点
若消耗Na2S2O3溶液的体积为bmL,则水样中溶解氧的含量为________mg·L-1。此题为间接氧化还原滴定,根据得失电子守恒确定各物质的比例关系
②上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏________(填“高”或“低”)。
(2)(2017·全国卷Ⅰ·27题节选)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
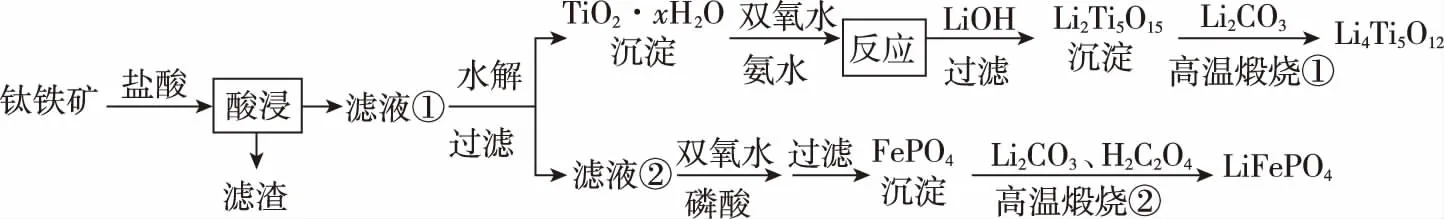
①Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________。对化合价的考查,注意通过已知化合价的Li、Ti,确定-1、-2价氧元素的数目即可
②若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成?__________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。考查Ksp的基本运算及溶度积规则
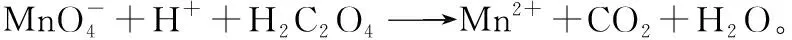
【答案】(1)①蓝色刚好褪去 80ab②低
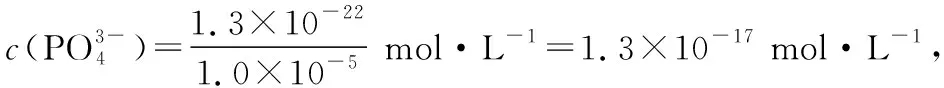
(3)45.0%
【解题策略】
1.有关滴定的计算
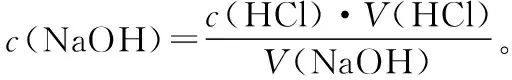
(2)氧化还原滴定的计算:主要根据氧化还原的化学方程式、离子方程式或关系式计算。如:


2.其他计算

