江苏省盐城市3株白羽肉鸭源鹅细小病毒的分离鉴定及其VP3基因遗传进化分析
2018-08-06李亚非潘金金陈洪益陆红霞刘红祥陈先亮徐全刚
李亚非,潘金金,陈洪益,陆红霞,刘 东,刘红祥,陈先亮,徐全刚
(1. 江苏省盐城市亭湖区动物卫生监督所,江苏盐城 224001;2. 青岛易邦生物工程有限公司,山东青岛 266011;3. 中国动物卫生与流行病学中心,山东青岛 266032)
2013年开始,我国山东、安徽等地的白羽肉鸭暴发了一种以长舌、短喙、生长抑制,屠宰时易断腿、断翅为主要特征的疫病,俗称“鸭大舌病”。此病最早于1971年在法国半番鸭中发现。Palya等[1]2009年对病原进行分离和鉴定,确定为变异鹅细小病毒或称变异小鹅瘟病毒(Goose parvovirus,GPV)。该病毒与经典小鹅瘟病毒有所差异,引起的疾病被命名为短小与侏儒综合征(Short beak and dwarfism syndrome,SBDS)。2014年以后,国内多位专家研究证明,导致我国白羽肉鸭发生SBDS的病原也是GPV[2-6]。GPV主要感染白羽肉鸭,且传播迅速。该病的发病日龄越小,死淘率越高,15日龄后发病的鸭生长抑制,易出现断毛、掉毛、断腿、断翅、饲料报酬率高等现象。目前该病已在全国白羽肉鸭养殖地区广泛传播,造成了严重经济损失。江苏省徐州市一直是该病的高发区,而在其他地区则鲜有报道。2017年江苏省盐城市报道出现此病,经临床和实验室诊断,确诊为SBDS。
1 材料与方法
1.1 材料
1.1.1 样品采集与处理 样品来源于江苏省盐城市多个发病肉鸭场。发病鸭日龄集中于10日龄左右,主要表现为生长抑制、矮小、短喙,舌头伸出喙外无法收缩,部分鸭腹泻、瘫痪,发病率为30%~50%。采集发病鸭的胰腺、肝脏、脾脏、肾脏等组织样品,加入适量抗生素PBS液,经剪切匀浆后反复冻融3次,取上清经0.22 μm滤膜过滤后保存备用。
1.1.2 试剂 DNA提取试剂盒:购自Axygen公 司;RNA 提 取 试 剂TRIzol Reagent: 购 自Invitrogen公司;AMV反转录酶及Taq DNA聚合酶:购自Fermentas公司;RNA酶抑制剂(RNasin):购自大连Takara公司;pGEM-T easy载体:购自 Promega公司;DNA Gel Extraction Kit:购自Axygen公司。
1.1.3 引物 利用Chang等[7]报道的引物进行水禽细小病毒鉴定,用Zàdori等[8]发表的水禽细小病毒病VP3基因保守区引物进行PCR扩增。引物由上海华大生物技术有限公司合成。

表1 水禽细小病毒引物
1.1.4 非免疫鸭胚 非免疫鸭胚购自江苏泰兴某种鸭场,经乳胶凝集方法[9]检测,卵黄中鹅细小病毒抗体阴性。
1.2 方法
1.2.1 组织样品PCR检测 将1.1.1中处理好的病料上清,用Axygen公司提供的方法提取样品总DNA,并按TRIzol Reagent法提取总RNA。用表1中GPV-F/R引物检测小鹅瘟病毒(GPV),同时分别用禽流感病毒(AIV)[10]、新城疫病毒(NDV)[11]、坦布苏病毒(DTV)[12]、鸭肝炎I型病毒(DHV1)[13]和鸭肝炎III型(DHV3)[14]病毒及呼肠孤病毒(ARV)[15]等引物,按照文献条件进行PCR扩增(扩增AIV使用12碱基随机引物反转录第一链,其他均使用6碱基随机引物)。
1.2.2 病毒分离与纯化 取病料上清0.2 mL经尿囊腔接种11日龄鸭胚,每份接种3个胚,收集24 h后死亡和有鸭胚体病变的鸭胚尿囊液,盲传4代。
1.2.3VP3保守基因PCR扩增、克隆及序列测定 取备用尿囊液提取总DNA,用VP3-F/R引物PCR 扩增。条件为:94 ℃ 5 min,94 ℃ 45 s,53 ℃35 s,72 ℃ 1 min 50 s,35 个循环,72 ℃ 10 min。PCR产物电泳后切胶纯化回收,克隆到pGEM-T easy载体,连接产物转化至DH5α大肠杆菌感受态细胞;采用SDS碱裂解法小量提取质粒,阳性质粒送南京金斯瑞生物科技有限公司,在ABI PRISMTM3730型DNA测序仪上进行序列测定。应用Lasergene 7.1软件,对测序基因片段进行拼接,利用GenBank中的BLAST工具,查找基因序列的同源序列,应用MEGA 6.0软件进行序列比对和遗传进化树绘制。
2 结果
2.1 组织样品PCR检测
3个场样品的PCR检测中,只有GPV引物组为阳性,其他各病毒引物均未能扩增出相应的条带(图1)。
2.2 病毒分离
病料经尿囊腔接种鸭胚后,发现鸭胚盲传前3代的平均死亡率为55%,第4代鸭胚死亡率明显增加,为89%;收取第4代尿囊液,提取尿囊液总DNA,用VP3-F/R引物进行PCR扩增,发现3份尿囊液PCR结果都为阳性(图2)。
图2 VP3基因PCR检测结果
2.3 VP3保守基因序列比对分析
将2.2中PCR扩增阳性的条带克隆至T载体后测序。利用所测序列,通过BLAST软件下载同源性相似的参考序列,并截取参考序列VP3基因,用MEGA 6.0软件进行基因进化分析。通过序列比对可以看出,此次分离的3株鸭源GPV(YC1、SQ1、SQ2)间的VP3基因核苷酸同源性为100%;与我国其他地区鸭源GPV代表株(DS15、JS1等)同源性也很高,达99.6%以上;与番鸭源GPV代表株(D、PT等)同源性为95%~99%。值得一提的是,此次分离株尽管与经典小鹅瘟代表株(B、GER、YZ99、GDa等)同源性都在95%以上,但从进化图谱看,分离株与西欧经典小鹅瘟株亲缘关系更近(图3),而引起番鸭SBDS的毒株则与我国小鹅瘟分离株亲缘关系更近;分离株与番鸭细小病毒代表株P株等亲缘关系较远,只有81%~83%。
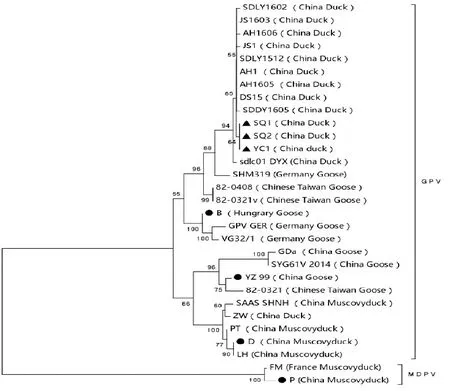
图3 基于水禽细小病毒VP3基因遗传进化树
3 讨论
水禽细小病毒种类繁多,宿主范围广,按细小病毒VP3基因的遗传学分类,可分为小鹅瘟病毒、番鸭细小病毒(番鸭“三周病”)、番鸭小鹅瘟病毒等。其中,小鹅瘟病毒主要引起雏鹅出血、栓塞性肠炎,番鸭细小病毒主要引起3周龄内番鸭气喘、拉稀。番鸭小鹅瘟病毒从遗传学上分析属于小鹅瘟中国株和番鸭细小病毒的重组变异病毒,主要引起番鸭短喙矮小综合征和肠炎。2013年以后,我国养殖白羽肉鸭陆续出现小鹅瘟病毒感染,并且与番鸭感染小鹅瘟后的症状类似。最初,学者们都认为经典小鹅瘟病毒不会引起北京鸭(樱桃谷鸭)、白鸭发病,但Ning等[16]研究发现,经典小鹅瘟病毒经人工途径感染北京鸭(樱桃谷鸭)后,也会造成鸭生长缓慢、短喙等现象,但较鸭源小鹅瘟分离株引起的临床症状要轻微很多。值得重视的是,本研究通过遗传进化分析发现,这3株引起SBDS毒株的VP3基因与小鹅瘟欧洲经典株同源性更高。而我国樱桃谷鸭的种源长期依赖进口,提示这3株病毒可能通过引种传入我国,或者由欧洲分离株进化而来。这一发现给我国肉鸭的引种带来了新的启示。
此研究首次报道江苏省盐城市鸭源小鹅瘟病毒引起白羽肉鸭SBDS。盐城市水系发达,一直有饲养水禽、消费水禽的习惯。而这3株病毒分离于自然水域饲养的樱桃谷鸭,且都与蛋鸭、白鹅一起混养。这种饲养模式极易造成该病在不同种群间的扩散传播,因此开展该病的持续监测对于了解该病的分布及病原变异情况具有重要意义。该病病原为新型水禽细小病毒,目前尚无有效的预防及治疗方法。但因其病原属于水禽细小病毒,因此临床上经常使用小鹅瘟抗体来预防和治疗该病。但在此需要特别强调的是,虽然抗体的早期使用能抑制临床上出现的短喙、侏儒等明显发病现象,但仍然不能解决鸭生长后期出现的饲料报酬率低,体重偏轻,屠宰时断腿、断翅等问题。因此,研发高质量的亚单位疫苗、基因工程疫苗、抗原抗体复合物疫苗是解决该问题而更值得关注的研究方向。
4 结论
通过PCR 检测、基因测序和遗传进化分析,确定2017年江苏省盐城市部分樱桃谷鸭发生短小与侏儒综合征的病原为一种新型鹅细小病毒。该毒株与欧洲分离株的亲缘关系更近,提示病毒可能通过引种传入我国,或者由欧洲分离株进化而来。今后将围绕该病开展详细的流行病学调查,结合实验室检测技术,继续追溯和追踪病毒的来源和变异情况,以便为该病防控提供强有力的支持。
