重组禽流感病毒(H5+H7)二价灭活疫苗在肉鹅中的应用效果评价
2018-08-06谢向萌韦显凯覃小柳梁仕增闭璟珊袁湖业胡茂快
谢向萌,韦显凯,梁 晟,覃小柳,梁仕增,闭璟珊,袁湖业,胡茂快
(1.横县动物疫病预防控制中心,广西横县 530300;2. 广西动物疫病预防控制中心,广西南宁 530001;3. 横县陶圩镇农业站,广西横县 530314)
禽流感(Avian Influenza,AI)是由禽流感病毒(Avian Influenza virus,AIV)感染禽类及其它易感动物引起的一种烈性、高度接触性人兽共患传染病。根据表面血凝素(HA)基因和神经氨酸酶(NA)基因不同,AIV可分为16种H亚型和9种N亚型。其中,可感染人的亚型有H5N1、H5N6、H6N1、H7N2、H7N3、H7N7、H7N9、H9N2、H10N7、H10N8等[1-5]。AIV的传播扩散不仅对农业生产造成巨大危害,也对人类健康构成严重威胁。
2013 年2—3月间,我国上海、安徽等长三角区内省份发生了严重的人急性下呼吸道感染,经中国疾病预防控制中心鉴定,确定病原为H7N9流感病毒[6]。与其他亚型流感病毒一样,H7N9亚型病毒一直在不断进化,并获得了在哺乳动物体内大量繁殖和毒力增强的能力,导致人感染和死亡[7]。2017 年以前,在家禽中分离的 H7N9 病毒绝大多为弱毒株,对家禽没有致病力。2017 年后的监测结果显示,有些地区的H7N9 病毒已突变为高致病性毒株,对鸡有高致病力,而且流行范围有扩大趋势,对养禽业带来极大威胁[8-9]。
鉴于人间和禽间H7N9疫情防控形势的变化,2017年6月农业部要求广东、广西先行开展H7N9流感免疫试点工作,采用重组禽流感病毒二价灭活疫苗(H5N1 Re-8株+H7N9 Re1株)进行免疫注射。为评价该灭活疫苗在商品肉鹅中的安全性和有效性,进行了田间免疫试验。
1 材料与方法
1.1 材料
1.1.1 疫苗 重组禽流感病毒二价灭活疫苗(H5N1 Re-8株+H7N9 Re1株):哈尔滨维科生物技术开发公司生产,批号为2017002。
1.1.2 试验动物 来自同一种鹅场、同一批次临床健康商品代肉雏鹅(狮头鹅),未经H5禽流感病毒疫苗或“H5+H7”重组禽流感病毒疫苗免疫。1.1.3 主要试剂 禽流感病毒血凝抑制抗原H5N1 Re-8株和H7N9 Re-1株:哈尔滨维科生物技术开发公司生产。
1.2 安全性及效力试验
1.2.1 安全性试验 取2周龄雏鹅400只,平均分为2组,分别进行单剂量和大剂量安全试验。每组分别采用肌肉和颈部皮下注射两种方式,数量各100只。单剂量安全试验注射剂量为0.5 mL/只,大剂量为1.0 mL/只。另取2周龄雏鹅20只为对照,以相同剂量和方式注射生理盐水。接种疫苗后,每日观察各组的采食、饮水及精神状况,判断是否有不良临床反应。14 d后,疫苗接种组每组剖杀5只,对照组剖杀2只,观察注射部位是否有炎症反应,以及疫苗吸收情况和脏器病理变化。免疫前及出栏前,每组随机取20只鹅称重,统计接种疫苗组和对照组的增重情况。
1.2.2 效力试验 取2周龄雏鹅500只,肌肉注射接种疫苗(0.5 mL/只),3周后以相同途径加强免疫1次(1.5 mL/只)。免疫前和免疫后每周采血分离血清,分别检测H7N9 Re-1和H5N1 Re-8株抗体,每次随机取30只,直至出栏。对每次随机选取的30只免疫鹅,全部采集喉/泄殖腔棉拭子,进行H7N9病毒分离;若病毒分离阳性,则进一步进行鉴定。
1.3 抗体检测
按《高致病性禽流感诊断技术》(GB/T18936-2003)中的血凝(HA)和血凝抑制试验(HI)试验要求,进行HI抗体效价测定。采用SPSS statistics 17.0,对检测数据进行统计分析。分析结果描述:P<0.01表示差异极其显著,P<0.05表示差异显著,P>0.05表示无显著差异。
2 结果
2.1 安全性试验
观察发现,单剂量和大剂量肌肉注射、颈部皮下注射,以及对照组的采食、饮水及精神状况均正常,未见不良临床反应。
接种后14 d,疫苗接种组每组剖杀5只鹅,对照组剖杀2只,进行病理检查。肌肉注射组:在注射部位均未观察到炎症、疫苗残留现象,疫苗吸收良好(图1-A、图1-E);气囊清净透明;心、肝、脾、胃、肺、肠管正常;淋巴结、胰腺正常;喉头、咽喉、气管正常(图1-B、图1-F)。皮下注射组:注射部位无炎症,但发现大剂量接种组有2只出现少量疫苗残留,疫苗吸收不完全(图1-C、图1-G);气囊清净透明;心、肝、脾、胃、肺、肠管正常;淋巴结、胰腺正常;喉头、咽喉、气管正常(图1-D、图1-H)。对照组:注射部位及器官均正常(图1-I、图 1-J)。
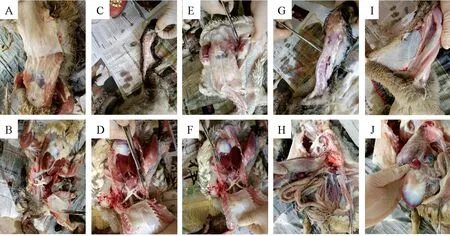
图1 疫苗接种组和对照组剖检结果
分别在免疫前(2周龄)、免疫后(4周龄),每组随机取20只鹅称重。结果显示,各组平均增重最大为2 225 g,最小为2 107 g(表1),无显著差异(P>0.05)。
2.2 效力试验
免疫前后,随机取30只鹅采样检测H7和H5抗体,共采样检测7次。结果显示:免疫前,HI抗体滴度均为0;免疫后,H5、H7的HI抗体滴度逐渐上升(表2)。加强免疫后2周,H5、H7的HI抗体滴度平均值分别达到6.6 log2、6.4 log2,合格率达到了70%以上,符合国家要求(图2)。免疫前后,共采集喉头和泄殖腔棉拭子210个,由国家禽流感参考实验室对其进行H7N9病毒分离。结果均为阴性。
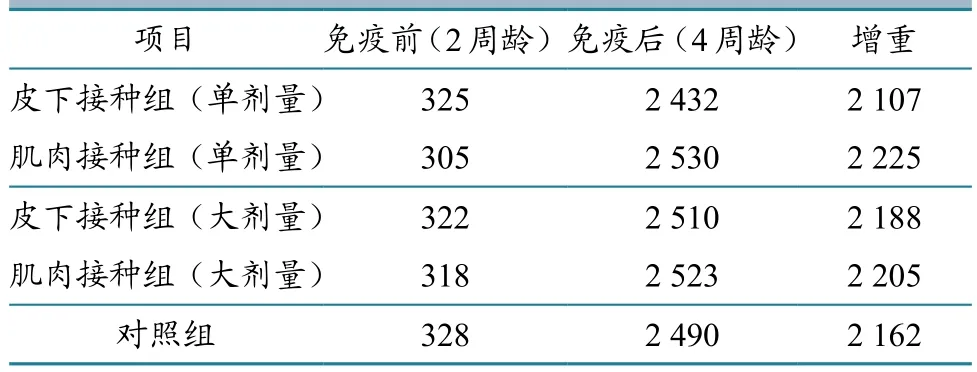
表1 免疫前后鹅的平均体重 单位:g
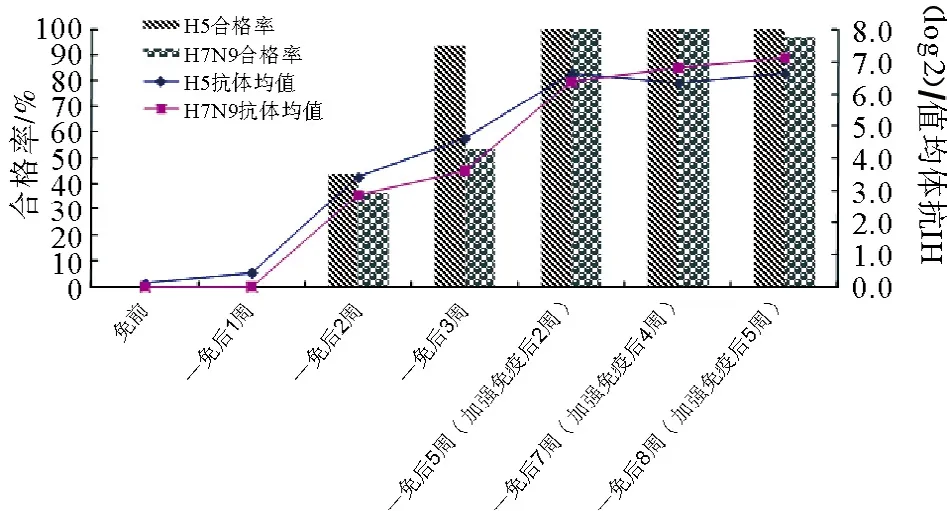
图2 抗体滴度和合格率变化曲线
3 分析与讨论
3.1 疫苗免疫是必要的
2017年2月18日,国家卫生和计划生育委员会向世界卫生组织(WHO)报告,对从广东省两病例分离的H7N9病毒株进行核酸序列分析,发现其在 HA1和 HA2之间的连接肽区有 4 个氨基酸插入[8];2月21日,我国向世界动物卫生组织(OIE)报告,从广东省活禽市场中分离到这种病毒。研究显示,该病毒已从对禽低致病性向高致病性转化[10-11]。因此,对家禽接种 H7亚型疫苗,以高滴度抗体,阻止流感病毒在家禽体内的复制以及传播,进而阻断流感病毒由禽传染给人,是预防该亚型流感病毒流行的最有效手段[12]。
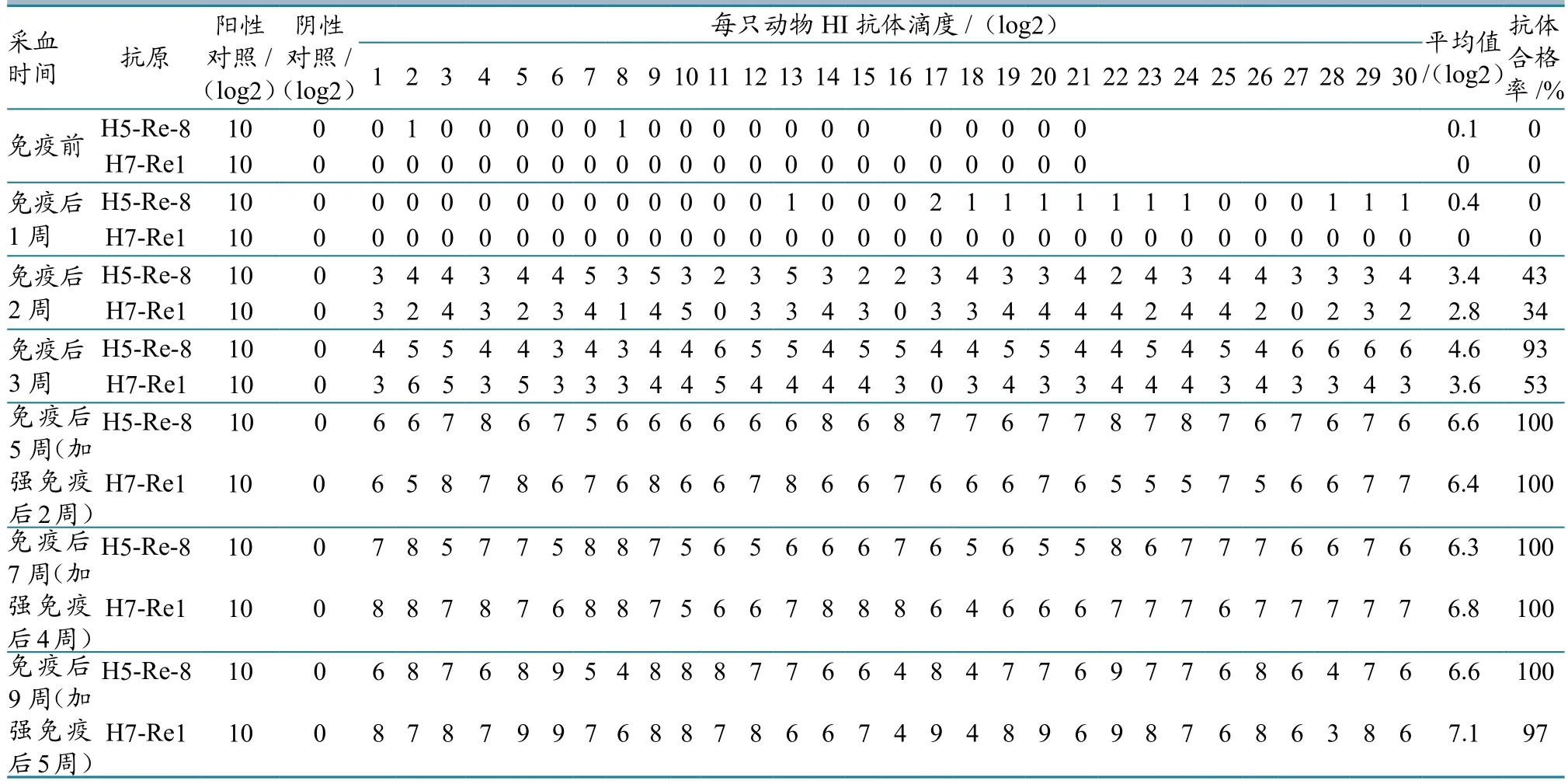
表2 疫苗临床应用检测结果
3.2 疫苗是安全的
无论是单剂量组,还是大剂量组,不管是肌肉接种,还是皮下接种,肉鹅采食、饮水及精神状况均正常;剖检未见淋巴、脏器有病理变化;喉头和泄殖腔棉拭子样品没分离出H7N9病毒。这些均说明该重组禽流感病毒(H5+H7)二价灭活疫苗免疫接种肉鹅是安全的。从肉鹅免疫后增重情况分析,疫苗接种组平均增重2157~2225 g,对照组平均增重2 162 g,各组间无显著差异,说明疫苗对鹅生长无影响。
3.3 疫苗是有效的
肉鹅免疫后3周,H5、H7抗体合格率分别达到93%、53%;免疫后5周(加强免疫后2周),HI抗体滴度都在5~8 log2之间,抗体整齐度好,而且H5、H7抗体合格率均为100%,说明该重组禽流感病毒(H5+H7)二价灭活疫苗免疫接种肉鹅是有效的。本试验为田间试验,没有进行免疫后的攻毒保护试验。但蒋文明等[13]进行的H7N9亚型流感候选疫苗株攻毒保护实验表明,该疫苗株对H7N9具有很好的攻毒保护作用。
3.4 疫苗用法与用量。
从免疫效果可看出,肌肉或颈部皮下注射免疫接种肉鹅均切实可行。对2周龄雏鹅进行首免,每只注射0.5 mL。5周龄时,以相同途径加强免疫1次,每只1.5 mL,加强免疫后2周(即7周龄),肉鹅H5、H7抗体整齐度好,抗体合格率均达到100%。需要指出的是,只进行1次免疫,免后3周时的H7抗体平均滴度仅为3.6 log2,抗体合格率为53%,达不到平均滴度4 log2以上、合格率70%以上的保护标准,因此肉鹅开展两次免疫是非常必要的。由于疫苗为油苗,没有进行滴鼻免疫实验。考虑到肌肉注射的普遍性,本试验并没有进行皮下注射试验。
4 结论
本研究使用重组禽流感病毒(H5+H7)二价灭活疫苗免疫商品肉鹅,通过单剂量和大剂量安全试验,未见肉鹅有不良临床反应及疫苗副反应,对生长无影响,说明疫苗安全性较好;效力试验表明,加强免疫后,H5、H7抗体合格率均可达到100%,疫苗保护效果较好。建议在2周龄时,对雏鹅进行首免,每只注射0.5 mL,5周龄时加强免疫1次,每只1.5 mL,这样可取得理想的免疫保护效果。
