靶向抑制IGF-1R逆转非小细胞肺癌对EGFR-TKIs获得性耐药的研究
2018-08-06张曦黄选章曾云云张为民
张曦 ,黄选章 ,曾云云 ,张为民 *
(1.温州医科大学附属第二医院,浙江 温州 325000;2.广州军区广州总医院,广东 广州510010)
肺癌已经进入分子靶向治疗的时代,以吉非替尼、厄洛替尼为代表的表皮生长因子酪氨酸激酶抑制剂 (epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)被广泛应用于晚期非小细胞肺癌的各线治疗,然而耐药现象的出现成为制约靶向治疗进一步应用的瓶颈[1-2]。因此,发现非小细胞肺癌对EGFR-TKIs的获得性耐药机制、寻找逆转耐药的新途径具有重要的临床意义。既往研究发现,胰岛素样生长因子I型受体(insulin-like growth factor-1 receptor,IGF-1R)参与介导非小细胞肺癌EGFR-TKIs的获得性耐药[3-4],但抑制IGF-1R表达是否能逆转肺癌细胞对EGFR-TKIs的获得性耐药未见报道。因此,本研究拟通过RNAi技术,观察抑制IGF-1R表达对非小细胞肺癌细胞EGFR-TKIs的敏感性及IGF-1R下游相关信号通路的影响,以探讨靶向抑制IGF-1R对逆转非小细胞肺癌EGFR-TKIs获得性耐药的影响及其可能的机制。
1 材料与方法
1.1 材料 非小细胞肺癌EGFR-TKIs耐药细胞株H460/ER由课题组前期培养所得;三质粒慢病毒载体系统购自吉凯基因公司;DMSO、MTT购自Sigma公司;1640培养基购自Gibco公司;限制性内切酶、T4DNA ligase M0202v、T4DNA ligase buffer购自NEB公司;Lipofectamine 2000购自Invitrogen公司;Trizol购自 Invitrogen公司;QIAGEN Plasmid大抽Kit购自QIAGEN公司;PCR引物由上海吉凯基因公司合成 (IGF-1R上游引物:5’-TGCGTGAGAGGATTGAGTTTC-3’,下游引物:5’-CTTATTGGCGTTGAGGTATGC-3’;内参GAPDH上游引物:5’-TGACTTCAACAGCGACACCCA-3’,下游引物:5’ -CACCCTGTTGCTGTAGCCAAA-3’;qRT-PCR试剂盒购自罗氏公司;EGFR、IGF-1R、ERK、AKT、p-IGF-1R、p-EGFR、p-AKT、p-ERK、β-actin 等蛋白一抗和二抗均由Cell Signaling公司提供;24孔Transwell板购自Corning公司。
1.2 siIGF-1R重组慢病毒载体的构建及病毒包装
1.2.1 慢病毒载体的构建 按照GeneBank提供的IGF-1R基因编码区,设计3对相应shRNA序列,通过BLAST分析及前期预实验,确定干扰靶序列“GCTTCACCGTTTACTACAA”,委托上海吉凯公司合成干扰序列的双链DNA oligo。将退火后的dsDNA与双酶切后的穿梭载体连接转化,挑选阳性克隆行PCR鉴定与测序。
1.2.2 病毒的包装及滴度测定 以lipofectamine 2000试剂介导的瞬时感染方法转染293T细胞,培养8小时后倒去含有感染混合物的培养基,以少量PBS洗涤残余的感染混合物,加入含血清的新鲜细胞培养基继续培养48小时,收集并离心浓缩细胞上清液,分装后-80℃保存。取其中一管测定:取出冻存细胞接种于96孔板中,24小时后每孔吸去90μL 培养基,分别为 10、1、10-1、10-2、10-3、10-4、10-5、10-6μL的病毒颗粒稀释液中加入等量病毒原液,培养24小时后换成完全培养基,荧光显微镜下观察带绿色荧光的细胞数量。病毒滴度=带荧光的细胞数/病毒原液。
1.3 慢病毒转染H460/ER细胞 用胰酶消化对数生长期的H460/ER细胞,将其制成悬液后接种于6孔板中,37℃培养箱培养使细胞融合至约30%,根据预实验摸索的MOI值(20)加入适量病毒,48小时后用含5μg/mL嘌呤霉素的培养基继续培养,感染72小时后在荧光显微镜下拍照,观察感染率。
1.4 qRT-PCR法和Western Blot法检测慢病毒对H460/ER细胞IGF-1R的抑制效应
1.4.1 qRT-PCR法测定IGF-1R的mRNA水平 用TRIzol法提取细胞总RNA,反转录为cDNA,行引物PCR扩增。采用20μL反应体系:灭菌水7μL,2xSYBR GreenMaster10μL,10μM上、下游各引物 0.6μL,DNA模板2μL。PCR扩增条件:95℃预变性5秒,95℃5秒,60℃30秒,一共进行40个循环(95℃,15秒→60℃,15秒→95℃,15秒)。重复测定3次。数据由PCR仪自带软件完成收集。实验结果采用2-△CT法分析。
1.4.2 Western Blot法检测IGF-1R的蛋白表达水平取消化后的各组细胞用蛋白提取液提取其中的总蛋白质。BCA法测定蛋白浓度,行10%SDS-PAGE电泳分离,转至PVDF膜上,用含5%牛血清白蛋白封闭约2小时,按说明书及前期实验所得比例加入各蛋白一抗,于4℃摇床上反应过夜,洗膜3次,再加入二抗,摇床反应1小时,再次洗膜3次,得到的蛋白条带用ECL试剂盒显色发光。以β-actin为内参照,用Quantity One图像软件对条带进行光密度值分析。
1.5 MTT法检测 靶向抑制IGF-1R后H460/ER细胞对EGFR-TKIs敏感性变化 收集对数期细胞,调整细胞悬液浓度为 1×105个/mL,5%CO2,37℃孵育,至细胞单层铺满孔底(96孔平底板)。设9个浓度梯度,每组取4个平行复孔,边缘孔用无菌PBS填充。细胞贴壁后,每孔加入100μL含不同浓度厄洛替尼的培养液,培养72小时再向孔内加入20μL 0.5%的MTT,培养4小时弃掉上清液后再加入150μL二甲基亚砜,振荡10分钟后酶标仪下测定各孔吸光度值(492nm波长),计算细胞存活率及其半抑制率(half maximal inhibitory concentration,IC50)。
1.6 划痕实验和Transwell实验 检测靶向抑制IGF-1R后H460/ER细胞转移侵袭能力的变化(1)划痕实验:收集两组细胞,按 5.0×104个细胞/孔接种于6孔板上,融合至80%时用无血清培养液饥饿过夜,第2天用200μL无菌移液器枪头在皿底部划3条平行直线,用PBS洗细胞3次,去除划下的细胞,加入无血清培养基,放入5%CO237℃培养箱培养。24小时后取样,置于荧光显微镜(×40)下拍照。 (2)Transwell侵袭实验:Transwell板上室每孔加入无血清培养液200μL(含5×105个细胞),下室每孔加入500μL含10%新生胎牛血清的培养液,37℃培养箱中培养,24小时后取出上室,用棉签拭去上室表面的非侵袭细胞,然后染色,置于荧光显微镜(×200)下拍照,取其中3个细胞分布良好的视野计数,计算平均值。
1.7 统计学处理 采用SPSS 14.0软件进行统计学分析所有实验重复3次,取平均值。实验数据以(±s)表示,采用 t检验。
2 结果
2.1 重组慢病毒载体的鉴定及滴度测定 挑选阳性克隆送上海吉凯公司测序。鉴定及测序结果符合预期,说明合成的IGF-1R shRNA oligo DNA序列插入正确。按逐孔稀释法,计算出IGF1R-siRNA重组慢病毒滴度为 3×106TU/μL。
2.2 慢病毒感染H460/ER细胞 H460/ER细胞感染重组慢病毒IGF1R-siRNA及其空白对照慢病毒IGF1R-siControl的效率均达到90%以上,如图1。

图1 H460/ER细胞感染IGF1R-siControl、IGF1R-siRNA慢病毒效果 (×100)。1A:细胞感染IGF1R-siControl慢病毒后的明场照片;1B:细胞感染IGF1R-siRNA慢病毒后的荧光照片;1C:细胞感染IGF1R-siControl慢病毒后的明场照片;1D:细胞感染IGF1R-siRNA慢病毒后的荧光照片。
2.3 目的基因IGF-1R抑制效率 qRT-PCR和Western Blot检测结果显示,IGF1R-siRNA慢病毒对H460/ER细胞IGF-1R的mRNA和蛋白抑制率分别达(67.7±2.6)%和(86.6±1.6)%(P<0.05)。 说明构建的IGF1R-siRNA慢病毒能高效抑制H460/ER细胞IGF-1R的表达。详见图2-3。
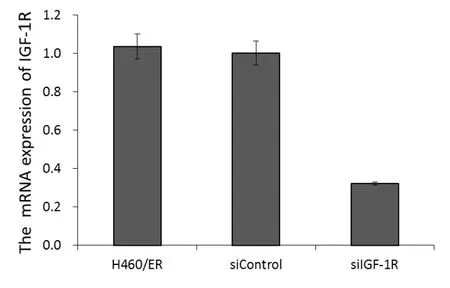
图2 qRT-PCR法检测各组细胞IGF-1R的mRNA表达差异

图3 Western Blot法检测各组细胞IGF-1R的蛋白表达差异
2.4 抑制IGF-1R表达对H460/ER细胞EGFRTKIs敏感性的影响 MTT法检测结果显示,siControl H460/ER和siIGF-1R H460/ER细胞均呈无限繁殖,它们对厄洛替尼的增殖作用表现为浓度依赖性 (图4);siIGF-1R H460/ER细胞对厄洛替尼的敏感性较siControl H460/ER细胞明显升高,IC50 值分别为(6.29±1.56)μmol/L 和(65.34±3.30)μmol/L (P<0.05), 说明抑制 IGF-1R 表达后,H460/ER细胞对 EGFR-TKIs的耐药性显著降低。
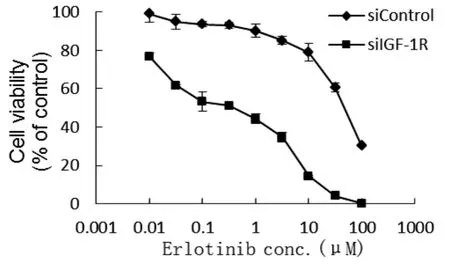
图4 MTT法检测不同浓度厄洛替尼分别作用72小时后对siControl H460/ER和siIGF-1R H460/ER细胞生长的抑制作用
2.5 抑制IGF-1R 表达对H460/ER细胞IGF-1R信号转导通路相关蛋白表达的影响 靶向抑制IGF-1R后,H460/ER细胞中EGFR蛋白及其磷酸化表达未见明显变化 (灰度未见明显变化,P>0.05),而IGF-1R蛋白及其磷酸化表达显著降低(灰度明显降低,P<0.05),p-AKT 和 p-ERK 表达亦下降(灰度较对照组下降,P<0.05)。详见图5。

图5 Western Blot法检测各组细胞IGF-1R、EGFR、AKT和ERK及其磷酸化水平的表达
2.6 细胞转移和侵袭能力的变化 划痕实验结果显示,siControl H460/ER和siIGF-1R H460/ER细胞划痕的两边缘距离分别为(5.5±0.5)mm 和(8.9±0.7)mm。相比对照组 siControl H460/ER,siIGF-1R H460/ER细胞两边缘距离延长 61%(P<0.05)(图6)。Transwell实验结果显示,siControl H460/ER和siIGF-1R H460/ER细胞穿过Matrigel胶的细胞数分别为(574±33)个和(179±13)个,siIGF-1R H460/ER细胞穿过Matrigel胶的细胞数为siControl H460/ER 的 69%(P<0.05)(图 7)。 上述结果说明,抑制IGF-1R后,非小细胞肺癌H460/ER细胞的侵袭转移能力明显减弱。

图6 抑制IGF-1R后H460/ER细胞的转移侵袭能力变化。6A:划痕实验(×40);6B:Transwell侵袭实验(×200)。
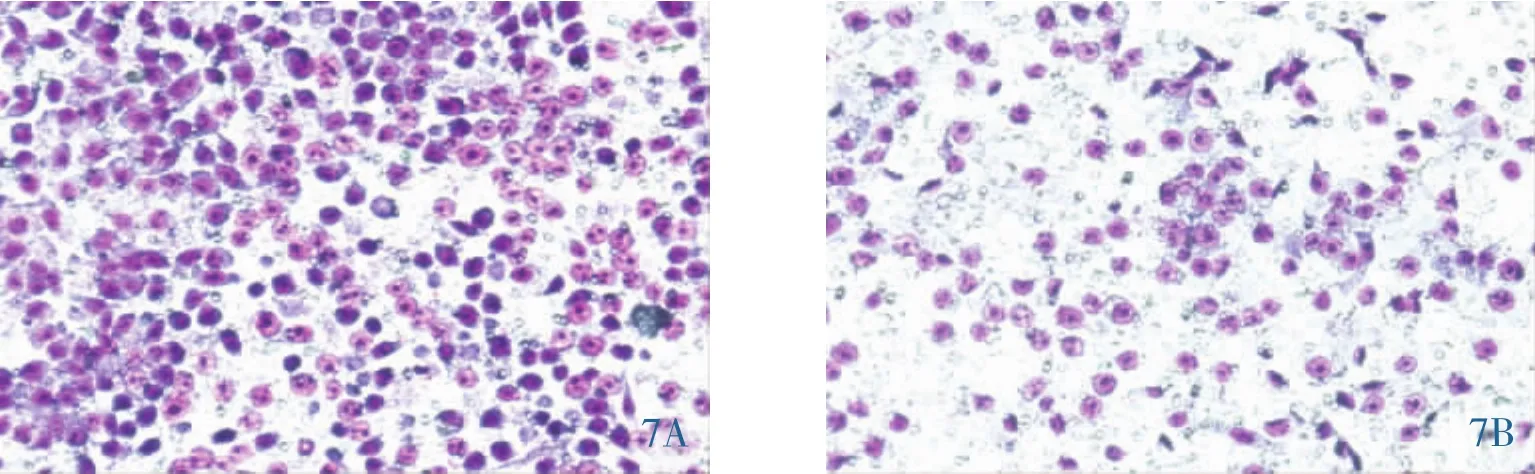
图7 siIGF-1RH460/ER细胞较siControlH460/ER细胞侵袭能力明显减弱。7A:siControlH460/ER细胞穿过Matrigel胶的细胞数;7B:siIGF-1R H460/ER细胞穿过Matrigel胶的细胞数。
3 讨论
非小细胞肺癌对EGFR-TKIs获得性耐药的主要机制为T790M突变和c-MET基因扩增,两者占所有非小细胞肺癌对EGFR-TKIs获得性耐药机制的60%左右[5],但目前仍有约40%的NSCLC的EGFRTKIs获得性耐药机制尚未明确。既往研究发现,IGF-1R信号转导通路在NSCLC对EGFR-TKIs获得性耐药过程中起重要作用[3-4]。IGF-1R是一种跨膜酪氨酸蛋白激酶受体,表达于多种类型细胞的表面,对细胞的增殖、分化、抗凋亡起着调控作用。它与配体结合后激活2条主要的信号转导通路:PI3K-AKT信号通路和ERK/MAPK信号通路,促进细胞的有丝分裂和生长[3]。IGF-1R在多种肿瘤中表达,它在肺癌等恶性肿瘤的发生和发展中起着重要作用[6]。
本研究利用RNAi技术[7]成功构建稳定抑制IGF-1R表达的H460/ER细胞株。研究发现,靶向抑制IGF-1R后,H460/ER细胞对EGFR-TKIs敏感性显著升高,siIGF-1R H460/ER细胞对厄洛替尼的IC50仅为对照组siControl H460/ER细胞的1/10。说明靶向抑制IGF-1R逆转了H460/ER细胞对EGFR-TKIs的获得性耐药。对IGF-1R信号通路相关蛋白表达变化的研究显示,与siControl H460/ER细胞相比,siIGF-1R H460/ER细胞的IGF-1R蛋白及其磷酸化表达明显降低,p-AKT和p-ERK水平下降,而EGFR蛋白及其磷酸化未出现明显变化。表明靶向抑制IGF-1R后,其下游PI3K/AKT和MAPK/ERK信号转导通路受到抑制。此外,划痕实验和Transwell实验结果显示,与siControl H460/ER细胞相比,siIGF-1R H460/ER的转移侵袭能力大幅减弱,说明靶向抑制IGF-1R可减弱H460/ER细胞的侵袭转移能力。已有研究证实,肿瘤细胞的侵袭转移能力与上皮间质转化有关[8],而上皮间质转化在IGF-1R介导的NSCLC对EGFR-TKIs获得性耐药机制中起着重要作用[9]。因此,肿瘤细胞侵袭转移能力的减弱很可能也参与了逆转非小细胞肺癌对EGFR-TKIs的耐药。鉴于IGF-1R通过与配体结合激活2条主要的信号通路 (PI3K/AKT和MAPK/ERK)而发挥细胞效应[10],本研究结果也已证实抑制IGF-1R表达能逆转H460/ER细胞对EGFR-TKIs的获得性耐药及减弱细胞侵袭转移能力,说明靶向抑制IGF-1R表达很可能通过阻断其下游PI3K/AKT和MAPK/ERK信号通路的传导,从而逆转H460/ER细胞对EGFR-TKIs的获得性耐药。
本研究仅对一种非小细胞肺癌细胞作了研究,有待在多株非小细胞肺癌细胞中加以证实,且IGF-1R信号通路交错复杂,它参与介导的非小细胞肺癌EGFR-TKIs获得性耐药机制亦尚未完全阐明,有待进一步研究。
