肝癌发生发展机制的研究进展及其治疗现状
2018-08-04陈世发综述赵礼金审校
陈世发 综述 赵礼金 审校
(1. 遵义医学院临床学院,贵州 遵义563000;2. 遵义医学院附属医院肝胆外科,贵州 遵义563000)
肝癌(原发性肝癌)较常见于男性,其由肝细胞癌、肝内胆管细胞癌及混合型肝癌等组成,约90%是肝细胞癌(hepatocellular carcinoma,HCC)。据2012年统计,全世界约有78万新发病例和74万死亡病例,我国占新发病例的50%,且呈明显的上升趋势[1]。肝癌的发病具有地区差异性,撒哈拉以南非洲和东亚地区的发病率高达20例/10万例,意大利、西班牙和希腊等地中海国家的发病率约为10~20例/10万例,而北美和南美的发病率相对较低(5例/10万例),80%~90%的肝细胞癌是在乙肝病毒、丙肝病毒及酒精导致肝硬化的基础上发生[2]。
迄今为止,肝癌的致病原因尚待研究,目前认为肝癌是基因和环境因素共同导致的结果。在我国,乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)感染、长期酗酒、非酒精脂肪性肝病、进食黄曲霉毒素B1污染的食物、各种肝硬化等与肝癌密切相关[3],脂肪肝和2型糖尿病被认为是肝癌的独立危险因素。另外肝癌可能与多种基因相关的各种细胞信号通路、外泌体、Toll样受体、自噬、血清甲胎蛋白(α-fetoprotein,AFP)及肥胖等有关。肝癌的发生是由病毒特异性因子、免疫机制、环境因素和个体遗传背景相关的基因共同作用的结果[4]。
目前肝癌诊断主要以AFP、超声检查、X线计算机断层成像(CT)、磁共振成像及肝穿刺活检为主要指标,与肝癌的高危因素结合来对肝癌进行诊断。早期筛查肝癌高危人群是提高肝癌患者疗效的关键措施,有利于肝癌的早期发现、诊断及治疗。AFP作为监测肝癌的主要指标,高危人群进行早期筛查肝癌的主要手段是AFP和超声检查,建议至少间隔6个月进行1次检查。目前,其它生物学标志物对肝癌检测具有好的效果,但进一步的研究加以证实[5]。
目前治疗肝癌的方法较多,根据不同的分期选择的手术方式也不相同,以多学科联合治疗为主的个体化治疗策略在肝癌治疗中正逐渐的得到推广,使肝癌的5年生存率得到了提高,但肝癌复发和转移仍是目前亟待解决的难题。本文就肝癌的发生发展及治疗进展进行文献综述。
1 肝癌的发生发展
1.1 肝炎病毒与肝癌
目前的数据表明,在我国,肝癌的主要危险因素是慢性乙型/丙型肝炎性肝硬化。在我国,HBV、HCV或HBV/HCV双重感染可显著增加肝癌的发展风险[6],肝癌的发生与慢性HBV感染关系密切,且与HBV的产物,HBV的整合和突变以及宿主易感性多种因素有关。目前所知乙型病毒X蛋白(hepatitis B virus X protein,HBx)在病毒诱导的HCC的发病机理中起关键作用,与肝癌发生发展密切相关。有研究[7]表明,HBx可能通过调节氧化应激、DNA修复、信号转导、转录、蛋白质降解、细胞周期进程和细胞凋亡的相关信号通路来促进肝癌的发生发展,另外慢性乙肝肝炎引起的肝纤维化及肝硬化在肝癌的发生中也起重要的促进作用。最近,先进基因测序技术研究表明,肝癌细胞中HBV DNA整合位点和易感基因/单核苷酸多态性在肝癌的发病机制中起重要作用,另外,表观遗传变化、免疫和炎症因子也是肝癌的重要促成因素[8]。慢性HCV感染是西方国家肝癌的主要原因。HCV引起肝癌发展涉及慢性HCV感染,持续性慢性肝炎及肝纤维化,伴不可逆的体细胞遗传/表观遗传改变的肿瘤克隆,以及恶性克隆在致癌组织微环境中的进展等多个步骤,HCV可能通过诱导慢性炎症以及通过病毒因子直接作用促进肝癌发展[9]。HCV感染相关性肝癌与并发的肝脏疾病、病毒基因型、生活方式等因素以及肥胖和糖尿病的存在密切相关,最终导致肝纤维化及肝硬化,导致肝癌的发生发展,其分子机制尚未得到明确阐明[10]。
1.2 代谢与肝癌
近年来,众多研究[11-12]表明,2型糖尿病(type 2 diabetes mellitus,T2DM)在肝癌的发生发展中扮演着非常重要的角色,且与糖尿病的病程有关,是肝癌发生发展中独立或协同的危险因素。有研究发现,T2DM对肝癌的发生具有高危险性,使肝癌的发病率及病死率增加。一项队列研究[13]显示肝癌的发生与糖化血红蛋白升高成线性关系,当糖化血红蛋白≥9%使肝癌的风险增加。另一项队列研究[14]已证实糖尿病是多种族中肝癌的一个危险因素,糖尿病的根治可能会降低多种族中肝癌发病率。非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)包含非酒精性肝脂肪变性 、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、NASH相关肝纤维化、肝硬化以及原发性肝癌,是目前全球最常见的肝脏慢性代谢性疾病,是一种代谢应激性肝损伤,与遗传易感因素和胰岛素抵抗关系密切[15]。肥胖、糖尿病及代谢综合征在NAFLD发病机制中可能起着重要的作用,将成为肝癌的独立病因。NAFLD可能在炎症因子、氧化应激、信号通路的激活及抑癌因素的减少的情况下逐渐发展成肝癌,但具体机制目前尚未完不明确,需进一步的研究加以证实[16]。目前认为肥胖是多种肿瘤发生的高危因素,流行病学研究表明超重和肥胖的流行导致了肝癌的风险增加。而一项Meta分析[17]也显示超重和肥胖与肝癌的发生及发展密切相关。目前糖尿病、肥胖及NAFLD引起肝癌的机制尚不清楚,可能通过诱导肝脏的胰岛素抵抗及多种促炎性细胞因子(如TNF-α、IL-6)、血管活性因子及促氧化分子的释放来导致肝癌的发生和发展[18]。
1.3 信号通路及其相关因子
研究[19]表明,Hedgehog(Hh)信号通路中的某些基因的异常激活与肝癌的发生发展密切相关。有研究指出,异常激活的Hh信号通路与肝癌细胞的增殖和凋亡密切相关。Sonic Hedgehog(Shh)是Hh的同源基因,肝癌的发展是由Shh信号通路激活后通过增加细胞因子B1和周期蛋白依赖性激酶1(cyclin-dependent kinases 1,CDK1)蛋白的表达,促进G2/M期的转换及促进细胞增殖所导致[20]。Shh信号通路能显著促进肝癌细胞的增殖来促进肝癌的发展[21]。丝裂酶原激活蛋白激酶(mitogen-activated protein kinase,MAPK)是信号从细胞膜传导至细胞核内部的重要传递者,细胞外信号调节蛋白激酶(extracellular-signal regulated protein kinase,ERK)及c-Jun N末端蛋白激酶(Jc-Jun N-terminal kinase,JNK)是MAPK的两个亚族,异常激活与肝癌的发生发展相关。ERK的磷酸化激活多种靶分子如c-Jun、c-Fos及G1/S-特异性周期蛋白-D1等来促进肝癌的发展[22]。而激活的JNK信号通路引起下游的通路蛋白c-Jun、P53及P21等表达,促进肝癌的增殖及血管生成等,参与肝癌的细胞周期及细胞凋亡调控过程[23]。Notch信号通路因在细胞的增殖、生长、凋亡、迁移、侵袭及血管生成等细胞过程中至关重要而在许多癌症的发生发展中均扮演着重要的角色[24]。Notch信号通路通过促进肝细胞增殖抑制其凋亡、调控细胞周期及EMT[25]等多种机制来调节肝癌的发生发展。而且它是多种重要信号通路的交点,间接与转化生长因子β(TGF-β)和NF-κB等信号通路的相互作用来诱导肝癌的形成[26]。JAK/STAT信号通路的各种成分相互组成并异常活化,尤其STAT3与肝癌的发生发展息息相关,JAK2/STAT3信号通路在肝癌中活性升高且与预后相关密切[27-28]。因此,该通路对肝癌发生发展机制的双向调节具有重要的治疗意义。另外酪氨酸激酶受体相关通路、Wnt/β-catenin、Met-HGF、VEGF、ROR、TGF-β和NF-κB等信号通路及相关因子与肝癌的发生发展有关。
1.4 外泌体
外泌体是由microRNA、mRNA、DNA片段及蛋白质等组成的纳米小膜囊泡,可由免疫细胞,间质细胞及癌细胞等释放。外泌体通过细胞间信息的交换来对肿瘤的微环境进行调节及对特定靶基因进行调控来影响肿瘤的发生发展[29]。microRNA的特定表达可直接作用于细胞周期的关键因子来调控肝癌细胞的增殖,影响肝癌的发生发展。microRNA-616参与了肝癌的发生和发展[30],microRNA-196a可能通过FOXO1促进肝癌细胞的增殖来影响肝癌的发生[31]。有研究[32]还表明,microRNA还与NAFLD的发生有关。
1.5 Toll样受体家族
Toll样受体家族(TLR)及其下游NF-κB、MAPK信号通路激活产生的炎症介质和细胞因子会改变肝癌组织的微环境,调控肝癌的发生发展。目前已经表明TLR2、TLR3、TLR4、TLR7、TLR9与肝癌的发生发展有关。在乙肝相关性HCC中,肝癌组织中的TLR3、TLR4及TLR9阳性表达与肝癌侵袭以及预后欠佳相关联[33],TLR3+1234C/T的多态性是可能的危险因素[34]。
另外,自噬、甲胎蛋白、肿瘤相关巨噬细胞及肝癌干细胞等也与肝癌的发生发展相关。
2 肝癌的临床分期
肝癌的分期对于评估患者的预后,选择合理的治疗方案至关重要。目前国际上还没有统一的分期方案,各个国家或地区根据各自的具体情况制定了不同的分期,各种分期之间各有利弊,差异明显,难以达成统一。目前有奥田邦雄(Okuda)评分法(表1)、Izumi TNM改良分期法(表2)、意大利肝癌小组CLIP评分法(表3)、法国(French)评分法(表4)、巴塞罗那(Barcelona clinical stage,BCLC)临床分期(表5),香港中文大学预后系数(Chinese University of Hong Kong prognostic coefficient,CUPI)评分系统(表6)、日本肝癌研究小组(Liver Cancer Study Group of Japan,LCSGJ)TNM分期(表7)、日本JIS评分法(表8)、Vauthey简化分期(表9)、美国癌症分期联合委员会(American Joint Committee on Cancer,AJCC)最新TNM分期(表10)及最新中国肝癌学会分期(表11)等。

表1 Okuda评分法(1985年)Table 1 Okuda staging system (1985)

表2 Izumi TNM改良分期法(1994年)Table 2 Izumi modified TNM staging system (1994)

表3 CLIP评分法(1998年)Table 3 CLIP staging system (1998)

表4 法国分期(1999年)Table 4 French staging system (1999)
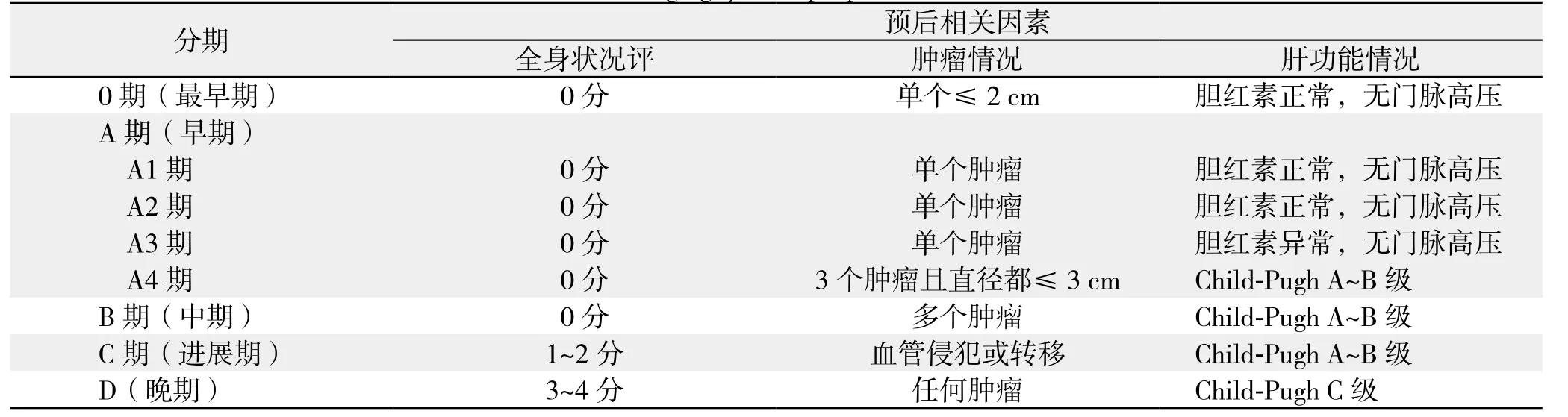
表5 BCLC临床分期(1999年提出,2005年修订)Table 5 BCLC clinical staging system (proposed in 1999, revised in 2005)
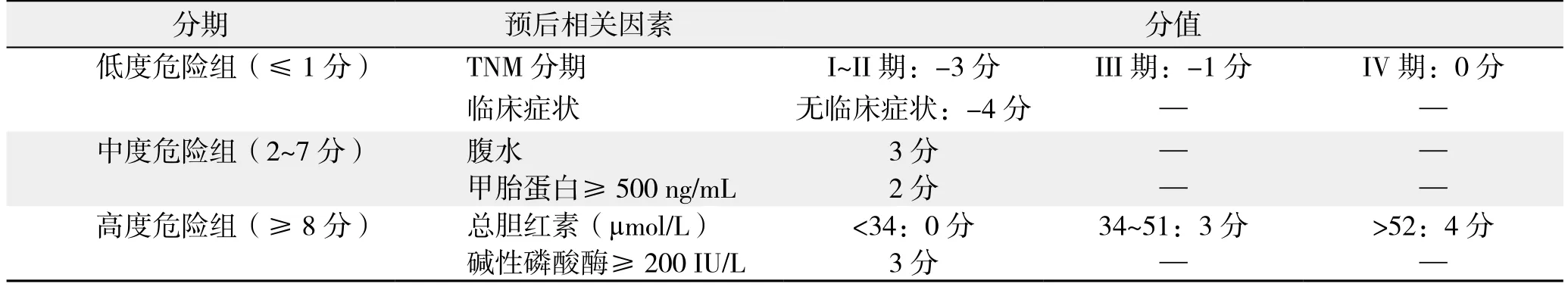
表6 CUPI评分系统(2001年)Table 6 CUPI staging system (2001)
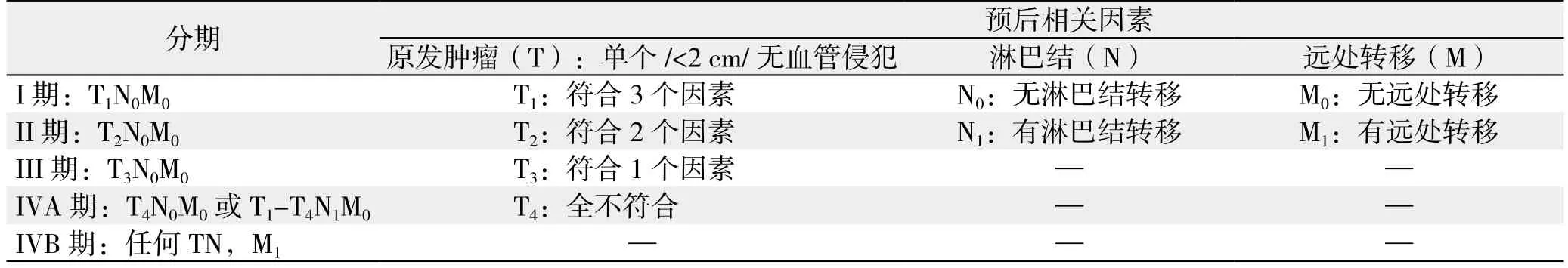
表7 日本LCSGJ分期(2000年)Table 7 LCSGJ staging system (2000)

表8 日本JIS评分(2003年)Table 8 JIS staging system (2003)

表9 Vauthey简化分期法(2002年)Table 9 Vauthey’s simplified staging (2002)

表10 AJCC最新TNM分期(2017年第八版)Table 10 New TNM staging system of AJCC (the 8th edition released in 2017)

表11 最新中国肝癌临床分期Table 11 Latest Chinese staging system for liver cancer
3 肝癌的治疗进展
3.1 肝切除术
肝切除术是目前应用于肝癌最普遍及有效的根治性措施,可明显降低肿瘤复发及转移,患者的生存时间延长,适宜于Child-Pugh A~B级、单个肿瘤直径<5 cm或2~3个肿瘤且最大直径≤5 cm,无脉管侵犯和远处转移的患者。由根治性、姑息性及二期肝切除术组成,手术方式由开放、腹腔镜及机器人辅助肝切除术组成。术前综合评估肝脏贮备功能,制定合理的手术方案、提高肝癌手术切除率及保证手术安全性,使患者获得更好的预后。通过对1 443例巴塞罗那临床分期0~C期的患者研究,肝切除术为各种临床分期的肝癌患者的一种根治性治疗方法[35]。腹腔镜肝切除具有创伤小、痛苦少、术后恢复快、对肝脏损伤小、失血量较少、术中术后并发症及病死率低、有利于手术后早期进行辅助治疗等优点。腹腔镜肝切除具有创伤小、疼痛轻及恢复快等优势,且安全可行,值得临床开展[36]。早期腹腔镜肝切除因精准度及切除范围受到一定限制,而最新的中国指南指出:腹腔镜肝切除不受肝内肿瘤位置和切除肝脏体积的限制,适合于病变≤10 cm的肿瘤,其有效性尚待临床研究证实[37]。精准肝切除是肝脏的各种局限性病灶外科治疗的首选,是与解剖性肝切除相符的一种全新的理念。其治疗肝癌具有创伤小且恢复快,近期效果好[38]。解剖性肝切除在肝癌中推荐使用,使肝癌的整体切除率得以提高[39],特别适宜于直径<5 cm的肝癌[40]。机器人辅助的肝切除术为实现腹腔镜下精准肝切除开拓出了新的手段,特别利于腔镜下的缝合和肝门部的精准解剖,使腹腔镜肝切除的适应证扩大,且安全可靠,但因其机械性阻碍了操作等原因阻碍该技术的广泛应用[41]。中晚期肝癌通过合理、综合及序贯的使用经肝动脉结扎等局部治疗进行降期或二期处理,使10%~20%的患者得到二期手术切除的可能,术后5年约有24.9%~57%患者生存[42],应用于治疗肝硬化巨大肝癌,具有安全性及可行性[43]。
3.2 肝移植
肝移植同时切除了肝肿瘤及硬化的肝脏,疗效相比肝切除好,使复发降低及复发时间延长。是肝硬化失代偿的早期肝癌或小肝癌、射频消融及经导管肝动脉化疗栓塞术不能治疗的肝癌及复发性肝癌最有效的一种治疗方法。肝移植由活体肝移植、尸体肝移植及补救性肝移植组成。目前肝移植的适应证有多种标准,符合米兰标准的肝移植术经多项临床研究证明术后5年有60%~80%患者获得生存,是目前较公认的标准。米兰标准(单个肿瘤直径≤5 cm,肿瘤≤3个且直径<3 cm,无血管侵犯,无淋巴结或远处转移)及“Up-to-7”标准(肝癌结节≤7 cm或结节之和≤7个,无微血管侵犯)的提出者回顾性分析了1 556例肝癌患者,两种标准的患者5年总生存率(OS)无差异[44]。改良TNM标准(匹兹堡标准)只把大血管侵犯、淋巴结转移及远处转移作为移植禁忌,使得更多肝癌患者受益,长期生存率接近50.0%[45]。加州大学标准(UCSF)将单个肿瘤直径扩大到6.5 cm,肿瘤≤3个且直径均≤4.5 cm及直径之和≤8 cm,并分析了2 000例患者,术后5年生存率可达到75%[46]。考虑到我国与西方国家患者的差异,提出了适宜我国国情的标准。杭州标准(无大血管侵犯;肿瘤的总直径≤8 cm或肿瘤总直径>8 cm且病理组织学为中/高分化和术前AFP≤400 ng/mL)[47],有效扩大了肝移植的适应证且使受益患者达到了37.5%,让国内更多肝癌患者受益且对患者预后预测是可靠的[48]。另外,还提出了复旦大学标准[49]及成都标准,都扩大了肝移植适应证。补救性肝移植是在等待肝移植的期间进行切除、消融或介入等治疗后进行的肝移植。其3年及5年生存率较低,鉴于其安全性及可行性及器官的严重缺乏,对肝癌切除术后复发或肝衰竭患者的有效策略及更好选择[50-51]。目前和将来重点关注的问题是肝癌肝移植的适应证选择、复发的预防及治疗,但随着国内外器官捐献事业的不断发展及外科学、免疫学、肿瘤学、分子生物学等协调发展,将会使肝移植在更多肝癌患者中持续开展并取得更佳的疗效。
3.3 介入治疗
介入治疗在中晚期肝癌患者得到普遍利用,主要用于术后复发不能手术切除或不能手术切除的患者。由传统经导管动脉化疗栓塞(conventional trans-arterial chemoembolization,cTACE)、药物洗脱微球化疗栓塞(drug-eluting bead transarterial chemoembolization,DEB-TACE),经动脉放疗栓塞(transarterial radioembolization,TARE)等构成。cTACE是二期肝切除及降期治疗后肝移植的一线治疗策略及可能的标准治疗方法,且可以提高患者的生存质量[52]。超选择性插管是近年来产生的新技术,可插管至肿瘤的供养动脉,使肿瘤的栓塞更加彻底且肝功能受损更轻[53],目前提高cTACE效果的重要措施是反复多次及超选择性插管下进行治疗。药物洗脱微球(drugeluting bead,DEB)是一种新型栓塞材料,DEBTACE在晚期肝癌的治疗中比cTACE表现出更好的治疗反应及延迟肿瘤的进展,毒副作用小,且具有安全性及有效性[54-55]。DEB-TACE较钇-90(90Y)栓塞使肝癌患者在第1、2、3年有更多的生存获益[56],是一种前景广阔且可行的方法,但需前瞻性研究来证实。TARE是将放射性微球输入有肿瘤的动脉中,对所有肿瘤结节不论数目、大小和位置都能进行处理。90Y放射性栓塞与cTACE相比较,在安全有效性及患者存活时间方面具有相似性,但其副作用较轻及可延缓肿瘤进展,尚待随机对照研究来证实[57]。目前以TACE联合其他方法治疗不可切除的肝癌得到了广泛的研究,可提高患者的OS及肿瘤坏死率,使患者血清AFP下降或恢复正常以及降低局部复发率。TACE与高强度聚焦超声、三维适形放射治疗、消融及无水酒精注射的联合可以改善患者整体生存,疗效较好,尚需临床研究来验证[58]。其与微波消融和放射性粒子碘125植入的联合治疗能提高小肝癌的疗效,且创伤小及并发症少[59]。在TACE治疗前进行系统评估及选择合适的患者可改善预后[60]。
3.4 消融治疗
消融治疗的适应证是位于肝门部大血管附近的直径≤5 cm的单个肿瘤、肿瘤≤3个且最大直径均≤3 cm、无血管、胆管、相邻器官浸润及远处转移、不能手术或术后复发的患者,是直径≤3 cm的肝癌的根治性措施。包含微波消融(microwave ablation,MWA)、激光消融(laser ablation,LA)、射频消融(radiofrequency ablation,RFA)、高强度聚焦超声(highintensity focused ultrasound,HIFU)、化学消融及冷冻消融等,可根据肿瘤的大小和位置进行恰当的选择。消融治疗相比TACE有优势,与肝切除及肝移植相比,在局部疗效和3年生存率方面相似,且方便、微创及费用低,是一种治疗早期肝癌首选的方式[61]。目前RFA和MWA的疗效已获得广泛认可。RFA是治疗极早期肝癌安全有效的一种方式[62],术中RFA是巴塞罗那0~A期小肝癌患者的最佳方案[63]。RFA用于早期深部肝癌或2~3个直径≤3 cm的中央型肝癌比外科手术更有效[64]。RFA是不适合外科治疗的早期肝癌的首选治疗[65],RFA可以作为小肝癌、符合或不符合米兰标准的复发性小肝癌或肝癌的治疗术式[66-68]。MWA与RFA相比在局部及远期疗效以及并发症的发生率等方面无明显不同。MWA治疗较大肝癌是安全有效及具有可行性的方式,但对于术后复发的治疗需进一步探索[69]。激光消融在不能手术或术后复发的肝癌患者应用,具有损伤小、并发症发生率低、具有安全性可靠性且操作简便等优势。其完全消融的效果并不劣于RFA,是治疗肝硬化性小肝癌的一种选择[70]。因单光纤难以覆盖整个病灶,使用多条细光纤可以改善直径>3 cm的肝癌的疗效[71],是一种充满前景的方法。HIFU通常与介入治疗、PEI、局部放疗等联合治疗,取得了不错的疗效[72]。冷冻消融有微创安全、可重复进行及肝脏损伤小等优点。与RFA及MWA相比,在治疗中晚期肝癌患者的时间、并发症、肿瘤复发率及生存率等方面具有一定的优势,值得推广[73]。反复多次的化学消融才能获得理想疗效。
3.5 放射治疗
放射治疗是肝功能差不能手术切除的IIIa期、IIIb期肝癌且伴有门静脉或下腔静脉癌栓或肝外转移的患者的姑息性治疗及肝癌移植前的治疗。包括外放疗及内治疗。肝癌对放疗敏感,常规放疗因大剂量放射线招致肝功能下降,小剂量疗效有限及治疗周期长等缺点而较少使用。为了使肿瘤局部放射剂量提高及肝损害减少,近年来新的体外放疗技术得到发展,如立体定向放射治疗(stereotactic body radiation therapy,SBRT)、三维适形放射治疗(three-dimensional conformal radiotherapy,3DCRT)、调强适形放射治疗(intensity modulated radiation therapy,IMRT)、图像引导放射治疗(image guided radiation therapy,IGRT)、体部伽玛刀治疗、质子射束治疗(proton beam therapy,PBT)等。SBRT增加了治疗剂量、减少肝损伤、具有稳定的局部控制率、改善了OS、并降低了毒性。研究表明,SBRT是不可切除的局部进展期肝癌的一种非侵入性的疗法[74],是小肝癌的患者的一种安全有效的选择[75]。3DCRT可精确增加肿瘤照射剂量及减少肝组织的照射剂量,近期疗效较好,可减少并发症、改善生存质量及延长生存期[76]。IGRT是一种有效地提高肝癌的控制率的四维放疗技术,是一种精确治疗。体部伽玛刀具有精度高、剂量高、疗效高及损伤低等优点,是治疗肝癌的重要手段。PBT的物理性能优越,避免了相关不良反应的发生,在肝癌的治疗中得到了发展。PBT的照射剂量少于IMRT[77]。选择性内放射性治疗(selective internal radiation therapy,SIRT)是近距离治疗,常用的粒子如90Y微球、131I单克隆抗体、125I粒子等。目前研究的较多的TARE是SIRT的一种方法,采用90Y微球的TARE对治疗中晚期肝癌疗效较好,但对血供较差的肿瘤疗效较差。粒子治疗具有副反应小,并可提高肝癌患者的生存率[78]。以上技术正逐渐应用肝癌临床治疗,其安全性及有效性尚需前瞻性随机临床研究来证实。
3.6 系统化疗
系统化疗(化疗)延长了患者的生存时间,应用在肝癌后期和(或)发生扩散转移的患者。肝癌对化疗药物敏感性及疗效差、副作用大。治疗肝癌的化疗药物有阿霉素(多柔比星)、卡培他滨、吉西他滨、奥沙利铂、5-氟尿嘧啶、三氧化二砷(arsenic trioxide,As2O3)等。As2O3通过增加T淋巴细胞及减少调节性T细胞来治疗肿瘤[79],是经过多中心研究证实及我国批准用于治疗中晚期肝癌的姑息治疗的化疗药物,但单药副反应较重。As2O3与TACE联合治疗肝癌具有好的疗效[80],可能具有广阔的前景[81]。目前包含奥沙利铂的FOLFOX4方案(奥沙利铂、亚叶酸钙、氟尿嘧啶)、XELOX方案(卡培他滨、奥沙利铂)、GEMOX方案(吉西他滨、奥沙利铂)等在我国被批准用于治疗不适合手术切除或局部治疗的局部晚期和转移性肝癌。FOLFOX4与单药阿霉素化疗相比可以延长无进展生存期(progression-free survival,PFS)及反应率(response rate,RR),后期随访表明,在提高OS及疾病控制率方面有优势,且安全性、耐受性较好,可能为亚洲患者带来获益,但研究未达到主要终点[82]。GEMOX对晚期原发性肝癌有效,具有可控的毒副作用及良好肿瘤控制率[83-84]。含奥沙利铂的系统化疗在2015年被美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南列为晚期肝癌治疗的可选方案。
3.7 靶向治疗
靶向治疗在中晚期肝癌中的治疗近年来研究得较多。索拉非尼是经中国国家食品药品监督管理总局(China Food and Drug Administration,CFDA)和美国食品药品监督管理局(Food and Drug Administration,FDA)批准的,目前唯一被用于晚期肝癌治疗的标准靶向药物[85]。两项III期临床试验证实,索拉菲尼可改善晚期肝癌患者的中位总生存期(median overall survival,MOS)及中位疾病进展期(median time to progression,MTTP),改善生存质量[86],是不可手术切除的肝癌患者的一线靶向治疗药物[87],是被全世界唯一认可的用于中晚期肝癌患者最有效及常用的全身性靶向治疗药物,因其价格昂贵等原因,在我国的广泛使用受限。RESORCE研究表明:瑞戈非尼(regorafenib)能够明显改善OS及无进展生存(PFS),是经索拉非尼治疗后肝癌进展的患者能够获得生存获益的,唯一可以使用的二线靶向药物。2017年被FDA批准作为肝癌的二线治疗[88]。乐伐替尼(lenvatinib)在治疗不适合手术切除的肝癌患者,其OS不劣于索拉非尼,且安全可耐受[89]。
3.8 免疫治疗和基因治疗
免疫治疗由主动免疫治疗和过继免疫治疗组成。目前应用最多的是干扰素。它可改善HBV相关性HCC根治性切除术后患者的OS,可能延缓肿瘤的复发[90],干扰素α2b并不能降低病毒性肝炎相关性肝癌术后复发[89]。胸腺法新作为肝切除术后辅助治疗可能改善肝切除术后小肝癌患者的预后。胸腺法新辅助治疗HBV相关性肝癌行根治性切除术后的有效性和安全性的临床试验(NCT02281266)还在进行中[91]。过表达PD-L1可降低肝癌的OS、无疾病生存(disease free survival,DFS)及无复发存活率(recurrence free survival,RFS),且与肿瘤低分化,血管侵袭和AFP升高有关[92]。I/II期临床试验评估PD-1/PD-L1免疫检查点阻断剂和细胞毒T淋巴细胞相关抗原4(cytotoxic T-Lymphocyte Antigen 4,CTLA-4)阻断剂相联合的结果表明,抗PD-1抗体联合局部治疗或分子靶向治疗是肝癌的有效策略[93]。因此,免疫检查点阻断剂将为肝癌的治疗开启新的大门。细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIK)经多项研究证明可以改善乙肝或丙肝相关性肝癌的早期DFS和OS,且具有安全性[94]。CIK可提高肝癌患者的RFS及OS[95], 协同微创治疗可改善肝癌的长期生存[96]。CIK与常规治疗及传统的侵袭性治疗联合显著延长了BCLC分期A或B期的肝癌患者的RFS、DFS及OS,副作用轻且能改善肝癌患者的预后,可推荐用于肝癌患者,而对患者优化选择是未来研究的方向[97-98]。T细胞免疫疗法将作为肝癌的一种有效治疗措施,可能降低复发率,提高生活品质,延长生存期[99]。免疫疗法将是治疗肝癌的一个有前景的选择,需大量的临床研究来验证。当前,基因治疗的研究较多,有p53基因、自杀基因等。重组腺病毒p53能抑制肝癌的发展,是不能手术切除的肝癌的安全有效的治疗策略,可延长患者的生存期[100],与SIRT联合可作为不能手术或拒绝手术的肝癌患者局部治疗首选的一种安全有效措施[101],需随机临床试验来证实。
3.9 中医治疗
中医的核心思想是辨证论治,肝癌的主要中医治法包括化痰软坚法、补肾健脾法、养阴柔肝法、活血化瘀法、清热解毒法、益气清毒法等[102]。在肝癌治疗中,中医药能改善肝癌患者症状、增强机体的免疫力、减轻放化疗的不良反应、改善生存质量及延长生存期等。康莱特,华蟾素、榄香烯、复方斑蝥等已批准用于肝癌的治疗,安全耐受而且依从性较好,目前其疗效尚无高级别证据来证明。
4 总结及展望
综上所述,迄今为止,肝癌的发生发展机制及其相关因素的关系尚不明确。但随着细胞生物学及分子生物学等技术的发展进步及模拟人肝癌动物模型的建立,以及这些技术在肝癌的研究中应用,将使肝癌的发生及发展机制越来越清晰,这将有助于肝癌的早期诊断及早期治疗。当前治疗肝癌的方案层出不穷,但如何选择一种合理的最有效的治疗方案需要进一步探索。而针对不同分期肝癌患者的采取个性化方案,以及采取肝切除、肝移植、介入治疗、消融治疗、放射治疗、系统化疗、靶向治疗、免疫治疗、基因治疗及中医治疗等多种方式的多学科综合治疗方案将成为未来十年甚至几十年治疗肝癌的主流趋势。多学科综合治疗及个性化的治疗方案使患者的5年生存率得以提高,但肝癌的复发和转移仍是今后进一步探索和亟待解决的难题,而最新的研究认为,肝癌干细胞与肝癌的复发和转移相关,对肝癌干细胞及其机制的研究以及针对肝癌干细胞的分子靶向治疗的将会为肝癌的根治带来新的希望。
