微小RNA在肝细胞癌中的相关研究进展
2018-08-04房锋综述宋天强审校
房锋 综述 宋天强 审校
(天津医科大学肿瘤医院 肝胆肿瘤科,天津 300060)
肝细胞癌(Hepatocellular carcinoma,HCC)是全球第五大常见恶性肿瘤,并高居全球癌症死因的第3位[1]。最新的数据显示,全球每年HCC新发病例数超过620 000,而每年HCC死亡病例数达598 000,死亡病例数与新发病例数之比接近1:1,预后十分恶劣,而中国每年HCC死亡病例数占全球总数的55%,HCC已成为严重威胁我国人民生命健康的重大恶性肿瘤之一[1-2]。
截至目前,手术切除仍是治疗HCC效果最为确切的首选方法。此外,介入、免疫治疗以及基因治疗在近年来亦取得显著进步,有效地提高了HCC尤其是中晚期HCC的生存率[3]。尽管如此,HCC的总体疗效仍难令人满意,其5年生存率长期徘徊于30%~40%,甚至更低[4]。究其原因在于对晚期HCC和复发转移性HCC缺乏有效的治疗手段[4]。因此,深入研究HCC发生发展过程中的分子机制,筛选与其紧密相关的核心分子,对于HCC的预防、诊断和治疗具有十分重要的意义。
1 非编码RNA(non-coding RNAs, ncRNAs)
随着2001年人类基因组测序的完成,科学家们惊奇地发现人类基因组中能编码蛋白的基因有2~2.5万个,仅占整个基因组2%,其中98%的序列为非编码序列,仅转录成RNA而不继续翻译成蛋白质[5]。几年来,随着高通量转录组学研究的进展,大量ncRNAs被发现。按照ncRNAs片段的长度,可将它们大致分为两大类,即小于200个核苷酸的短ncRNA(small ncRNA,sncRNA)和超过200个核苷酸的长ncRNA(long ncRNA,lncRNA)。
1.1 sncRNA
sncRNA主要包括微小RNA(microRNA,miRNA)、小核仁RNA(small nucleolar RNA,snoRNA)和Piwi蛋白相互作用RNA(PIWI-interacting RNA,piRNA)。
SnoRNA主要参与核糖体RNA(ribosomal RNA,rRNA)、转运RNA(transfer RNA,tRNA)及小核RNA(Small nuclear RNA,snRNA)的化学修饰。snoRNA包含两大家族:C/D box snoRNA和H/ACA box snoRNA,可分别参与RNA的甲基化和假尿嘧啶化修饰[5]。研究发现SnoRNA-SNORD126在HCC中呈显著性高表达,SNORD126过表达可增加AKT、GSK-3β和p70S6K的磷酸化水平,上调FGFR2表达进而激活PI3K-AKT信号通路促进HCC生长[6]。
piRNA是一类长度为26~31 nt单链的小RNA,5'端具有强烈的尿嘧啶倾向性,piRNA主要存在于哺乳动物的生殖细胞和干细胞中,通过与Piwi亚家族蛋白结合形成piRNA复合物来调控基因沉默途径[7]。Rizzo等[8]利用小RNA测序技术发现125个与HCC微血管侵犯密切相关的piRNA。研究[9]发现,piR-Hep1可通过激活Akt磷酸化促进HCC细胞生长和侵袭转移。
1.2 lncRNA
lncRNA包括基因间长非编码RNA(intergenic lncRNA)、反义长非编码RNA(antisense lncRNA)及环状RNA(circular RNA,circRNA)等,lncRNA在表观遗传调控、细胞周期和分化调控、及肿瘤发生发展等众多生命活动中发挥重要作用,成为遗传学研究热点[5]。
HULC为基因间lncRNA,在HCC中呈显著性高表达,其表达水平与HCC的TNM分期、复发和生存相关;HULC可通过miR-200a-3p/ZEB1信号通路调控EMT(epithelial-mesenchymal transition)促进HCC侵袭转移[10]。ZEB1-AS1为反义lncRNA,ZEB1-AS1启动子低甲基化致其在HCC组织中呈高表达,ZEB1-AS1可上调ZEB1表达,诱导EMT进而促进HCC侵袭转移[11]。
circRNA是一类不具有5'末端帽子和3'末端poly(A)尾巴,以共价键形成环形结构的非编码RNA分子,circRNA分子呈封闭环状结构,不易被核酸外切酶RNaseR降解,比线性RNA更稳定。circRNA分子含miRNA应答元件,可充当竞争性内源RNA(competing endogenous RNA,ceRNA),与miRNA结合解除miRNA对其靶基因的抑制作用,上调靶基因的表达水平[12]。环状RNA Cdr1as在HCC组织中表达上调,Cdr1as可通过靶向miR-7促进HCC细胞生长和转移[13]。
2 miRNA
miRNA是一类5'端带磷酸基团、3'端带羟基的,长度约20~24个核苷酸的非编码调控RNA家族[14]。成熟的miRNA由一段具有发夹环结构,长度为70~80个核苷酸 的单链RNA 前体(premiRNA)剪切后形成。miRNA与其靶基因mRNA(messenger RNA,mRNA)分子的3'端非编码区域(3'-untranslated region,3'-UTR)互补匹配,两者之间完全或近乎完全的互补匹配可诱导靶基因mRNA的降解,而部分互补则可通过阻断核糖体接近mRNA抑制mRNA的翻译。
自1993年Lee等[15]发现并报道第1个miRNA—Lin-4以来,miRNA研究已成为生命科学研究领域的一大热点。研究发现,miRNA可调控人类基因组中约1/3的基因表达,并参与了生命过程中的一系列重要进程,包括早期发育以及细胞增殖、分化、免疫调控、凋亡、代谢等[16]。目前业已发现1 881种miRNA前体和2 588种成熟miRNA(miRbase version 21.0,http://www.mirbase.org)。miRNAs在肿瘤发生发展中具有重要作用,不同类型的肿瘤有其特异的miRNAs表达谱,其生物学功能可呈现出癌基因(oncogenes)或者是抑癌基因(tumor suppressor genes)的作用。近年来,关于miRNA的新发现和新观点层出不穷,miRNAs与肿瘤的关系已成为当前众多科学家关注的热点之一。
3 miRNA和HCC
miRNA在HCC发生发展中具有至关重要的作用。HCC的发生发展涉及到众多信号通路的异常激活或失活,如p53,RAS/MAPK,PI3K/Akt/mTOR,Wnt/β-cateninβ,MET,Myc,转化生长因子β等。作为负性调控因子,miRNA可调节上述信号通路的活性,参与HCC发生发展调控[16-17]。
3.1 miRNA在HCC中的异常表达
miRNA在HCC中常呈异常表达[16](表1)。大量研究证实,miR-17-92、miR-21、miR-221、miR-222、miR-224等在HCC中呈高表达,而let-7、miR-200、miR-29、miR-122、miR-123、miR-199a、miR-199b等在HCC中常表达下调[18]。2006年Murakami等[19]首次报道HCC中miRNA的异常表达谱,其运用芯片技术对24例HCC组织及对应的癌周正常组织、9例慢性肝炎组织中的miRNA表达谱进行分析,结果发现miR-18和miR-224在HCC组织中呈高表达,miR-195、miR-199a、miR-200a和miR-125a在HCC中呈低表达,利用miRNA表达谱诊断HCC的准确性高达97.8%(45/46)。
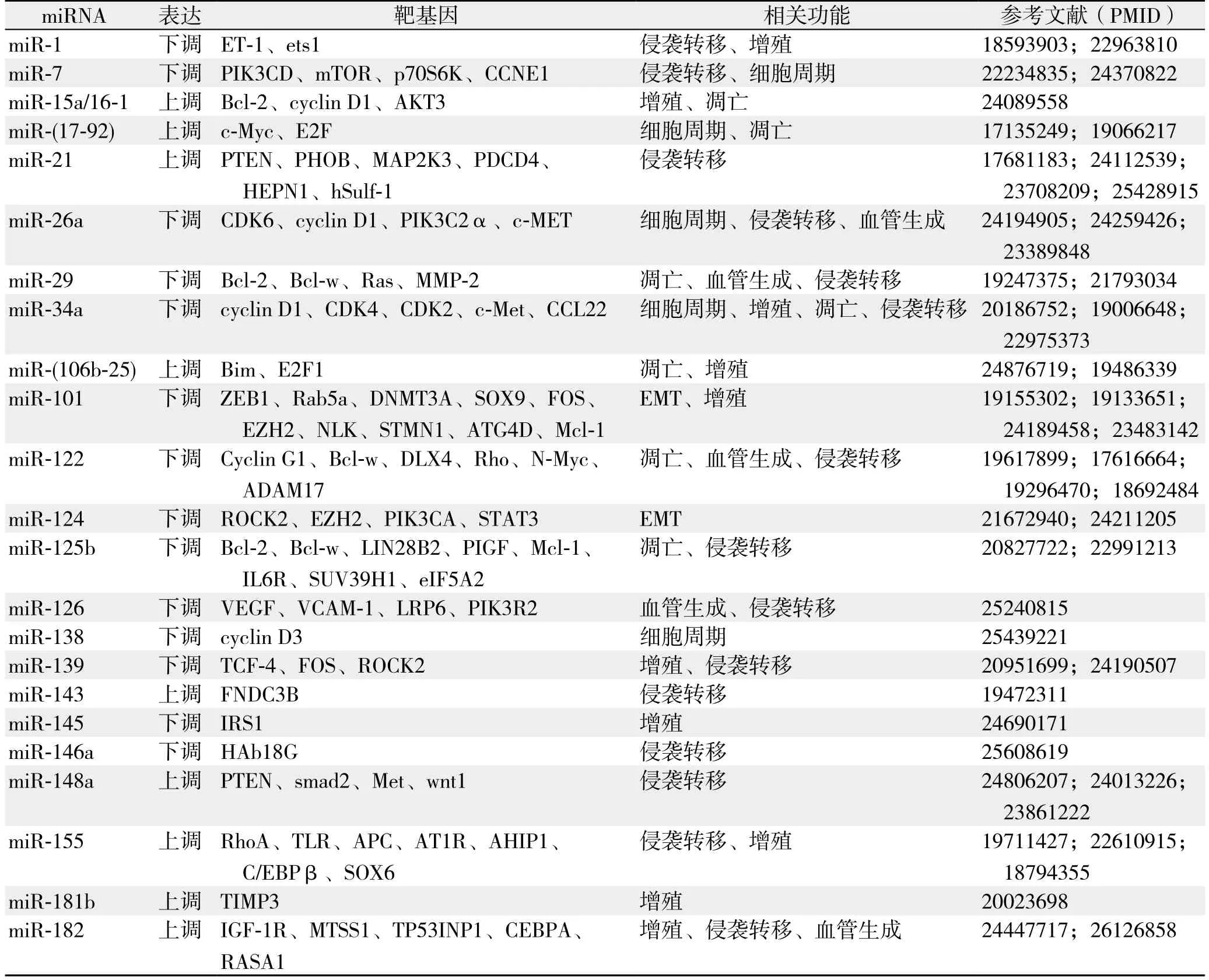
表1 HCC中部分差异表达miRNATable 1 Some differentially expressed miRNAs in HCC
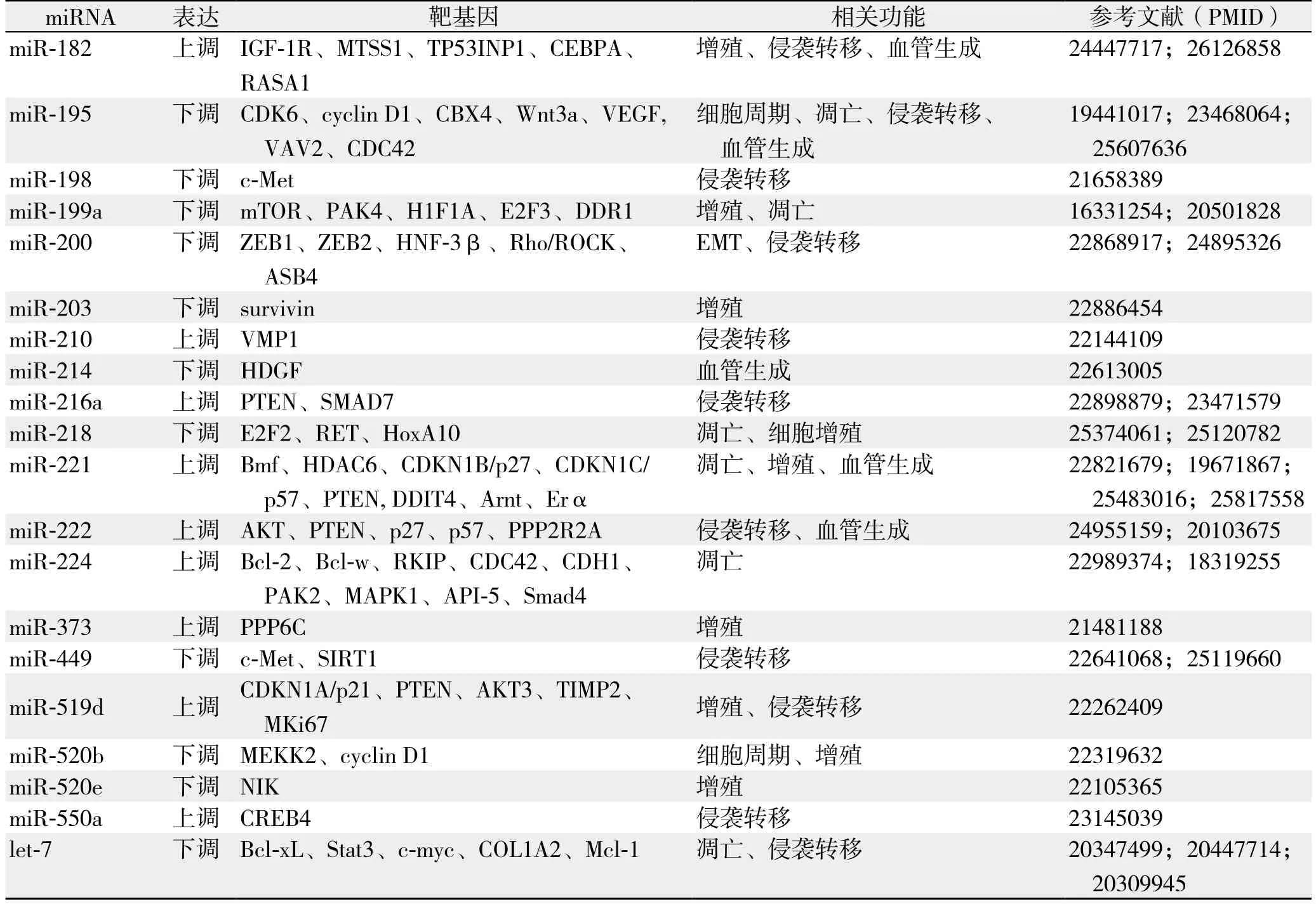
表1 HCC中部分差异表达miRNA(续)Table 1 Some differentially expressed miRNAs in HCC (continued)
HCC患者血清miRNA亦存在差异表达。最近Ghosh等[20]利用芯片分析HBV/HCV相关HCC的miRNA表达谱,筛选获得40个组织中差异表达的miRNAs,其中仅 miR-126和miR-142-3p在HBV相关HCC患者血清中表达上调,其诊断HCC的效能并不优于AFP,但两者联合可将HCC的诊断效能提高至92%。miR-122系肝脏特异性miRNA,其在HCC组织中呈低表达,但在HCC患者血清中,miR-122表达上调,可能系HCC细胞持续分泌miR-122至外周循环中所致[21-22]。
3.2 HCC中miRNA异常表达的调控机制
miRNA经常定位于肿瘤相关的染色体区域或染色体脆性位点。HCC发生发展过程中,转录因子水平改变或基因组不稳定如突变、异位、拷贝数目改变、缺失、DNA甲基化、组蛋白乙酰化/去乙酰化等均可影响HCC中miRNA的表达,此外,lncRNA在miRNA调控中亦具有重要作用。理解miRNA失调背后的机制并不是开发生物标记物的必要条件,但阐明miRNA异常表达的调控机制将有助于理解HCC的发病机制和探索潜在的治疗靶点。转录水平调控:转录因子可通过激活primiRNA的转录调控miRNA的表达。miR-151定位于染色体8q24.3,在HCC中呈异常扩增,且其表达水平与HCC的肝内转移密切相关[23]。Zeng等[24]证实,miR-122启动子区域含C/EBPα结合位点,敲除C/EBPα可显著降低miR-122的启动子活性,进而降低内源性miR-122的表达。表观遗传学调控:甲基化等表观遗传学在调控miRNA表达方面具有重要作用。众多miRNA的启动子区域存在CpG岛,而CpG岛的高甲基化可导致miRNA转录抑制。HCC组织中miR-34b甲基化率为79.1%,显著高于癌旁肝组织,从而导致miR-34b在HCC中显著性低表达[25]。Long等[26]研究发现CpG岛高甲基化可抑制HCC细胞中miR-148a 的表达。miR-191在HCC组织中的表达显著高于癌旁肝组织,甲基化特异性PCR发现低甲基化与miR-191高表达显著相关[27]。组蛋白去乙酰化酶(Histone deacetylase,HDAC)可通过染色质重塑下调特定基因的表达。HDAC在HCC中常表达上调,抑制HDAC表达可上调miR-449的表达水平[28]。lncRNA和miRNA:lncRNA在众多细胞生命活动调控中发挥重要作用。研究发现,lncRNA可作为ceRNA调控miRNA的表达及其生物学功能[29]。Tran等[30]研究发现,Linc00176在HCC组织中呈显著性高表达,其可通过调控miR-9和miR-185表达促进HCC细胞增殖。FABP5P3在HCC组织中呈高表达,FABP5P3敲除可抑制HCC细胞的增殖和侵袭转移,FABP5P3可与miR-589-5p结合降低其细胞内表达丰度,上调miR-589-5p靶基因ZMYND19的表达,从而促进HCC发生发展[31]。Li等[32]发现,MALAT1可抑制miR-146b-5p的表达,调控TRAF6诱导的Akt磷酸化,进而促进HCC生长和侵袭转移。LncRNA亦可在转录水平调控miRNA表达。如PCAT-14在HCC在组织中呈显著高表达,其可诱导启动子甲基化抑制miR-372的表达,进而促进HCC细胞增殖和侵袭转移[33]。
3.3 miRNA在HCC中的生物学功能
miRNA在HCC中可具有癌基因或抑癌基因的作用,近年来,大量的研究证实miRNA参与了HCC发生发展中的众多生物进程,包括细胞增殖、凋亡、血管生成、侵袭转移及耐药性等。
3.3.1 miRNA调控HCC细胞增殖 研究发现众多miRNA可通过调控细胞周期或细胞生长控制HCC细胞的增殖,如miR-122、miR-99a、miR-221、miR-138、miR-193b、miR-26a等。Zhou等[34]研究发现,miR-363在HCC组织中呈显著低表达,具有抑癌基因活性;miR-363可通过靶向S1PR1抑制ERK和STAT3信号通路及其下游相关基因PDGF-A、PDGF-B、MCL-1和Bcl-xL表达,从而抑制HCC细胞生长。miR-147b在HCC中呈高表达,体内和体外实验证实miR-147b 可通过靶向UBE2N促进HCC细胞生长[35]。HBV感染系HCC的主要致病因素,研究发现HBx蛋白可通过增强miR-331-3p启动子活性促进其表达,miR-331-3p表达上调可通过靶向抑制ING5促进HCC细胞增殖[36]。此外,HbeAg可促进miR-106b的表达,miR-106b可通过抑制靶基因Rb促进HCC细胞从G0/G1期到 S期,从而促进HCC细胞增殖[37]。
3.3.2 miRNA调控HCC细胞凋亡 凋亡抑制是HCC的一个重要的生物学特征。miRNA参与了HCC细胞凋亡的调控。Yang等[38]研究发现,miR-15b-5p在HCC组织中呈显著低表达,miR-15b-5p可通过靶向Rab1A抑制HCC细胞凋亡。Tan等[39]发现miR-1180可通过靶向TNIP2激活NF-κB信号通路抑制HCC细胞的凋亡。miR-365在HCC细胞系中呈低表达,过表达miR-365可通过靶向Bcl-2诱导SMC7721细胞凋亡,从而抑制HCC细胞活性[40]。
3.3.3 miRNA调控HCC血管生成 血管生成在HCC发生发展中具有重要作用。Wang等[41]研究发现miR-195与HCC的血管生成密切相关,miR-195可抑制内皮细胞的成管,体内试验亦证实miR-195可降低裸鼠肿瘤的微血管密度,深入研究证实miR-195可靶向VEGF调控HCC的血管生成。Yang等[42]研究发现miR-26a与HCC组织的微血管密度呈负相关,体外和体内研究证实miR-26a可直接靶向肝细胞生长因子HGF抑制HCC细胞中血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)的表达,进而抑制内皮细胞的VEGFR2信号传导通路从而抑制血管生成。此外,miR-26a亦可通过PIK3C2α/Akt/HIF-1α信号通路调控VEGF-A的表达,进而调控HCC血管生成[43]。miR-182在HCC组织中呈高表达,实验研究证实缺氧可上调miR-182表达,进而通过其靶基因RASA1促进HCC血管生成[44]。Yang等[45]发现miR-1301在HCC组织及细胞中显著性低表达,miR-1301低表达与HCC血管侵犯显著相关,miR-1301可通过靶向BCL9抑制β-catenin和VEGF表达抑制HCC血管生成。
3.3.4 miRNA调控HCC细胞侵袭转移 肿瘤的侵袭转移是一个多步骤、多因素参与的复杂过程。大量的研究报道证实miRNA通过对相关基因的表达调控在HCC侵袭转移调控中具有重要作用。Budhu等[46]利用miRNA芯片技术检测了482例HCC组织和241例非癌肝组织样本中的miRNA的表达谱,通过比较HCC组织中侵袭性样本和非侵袭性样本的miRNAs表达谱差异,筛选出20种HCC侵袭转移相关的miRNAs,包括miR-338、miR-219-1、miR-207、miR-185、miR-30c-1、miR-122、miR-34a、miR-19a、miR-148a、miR-124a-2、miR-922、miR-148b、miR-122a、miR-125b-2、miR-194、miR-30a、miR-126、 let-7g、miR-15a和miR-30e;基于上述结果,作者建立了miRNA指纹图谱,该图谱可准确鉴别HCC的静脉侵犯并能预测HCC的早期复发转移。
近年来,研究人员对miRNA在HCC侵袭转移中的作用及其作用机制进行了深入系统的研究。Wong等[47]研究发现HCC组织中miR-139的低表达与HCC的血管侵犯、微卫星结节显著相关,miR-139过表达可通过靶向Rho-kinase 2抑制HCC细胞的侵袭运动和远处转移能力。Cui等[48]发现miR-337可通过靶向HMGA2抑制PI3K/AKT和Wnt/β-catenin信号通路,抑制HCC侵袭转移。
基质金属蛋白酶(matrixmetalloproteinase,MMP)家族在肿瘤侵袭转移中具重要作用,miR-29b可通过靶向MMP2调控HCC的侵袭转移能力[49]。HCC合并门静脉瘤栓的患者其术后的复发转移率较高,Liu等[50]采用芯片技术检测了HCC门静脉瘤栓和癌组织中的miRNAs表达,发现miR-135a在瘤栓中呈显著性高表达,miR-135a可通过靶向MTSS1促进HCC的侵袭转移并增加门静脉瘤栓的发生率。GTPase蛋白在调节细胞骨架方面具有重要作用,miR-200b/200c/429可靶向RhoA和ROCK2介导细胞骨架重组和细胞间质黏附,从而调控HCC细胞的迁徙转移[51]。
上皮细胞-间充质转化(epithelialmesenchymal transition,EMT)是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,在癌症转移中发挥了重要作用。通过EMT,上皮细胞失去了细胞极性,失去与基底膜的连接等上皮表型,获得了较高的迁移侵袭和降解细胞外基质的能力。EMT是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程。Jiang等[52]发现miR-874在HCC组织及细胞中表达下调,miR-874可通过靶向SOX12抑制EMT从而降低HCC细胞的侵袭转移能力。Guo等[53]发现miR-429可通过靶向CRKL介导的Raf/MEK/ERK-EMT信号通路,抑制HCC的侵袭转移。Hu等[54]发现miR-488在HCC中呈低表达,其表达水平与HCC血管侵犯显著相关,miR-488可通过靶向ADAM9介导的EMT促进HCC侵袭转移。Li等[55]发现miR-1271通过靶向PTP4A1/c-Src信号通路抑制EMT,进而抑制HCC的侵袭转移。
3.3.5 miRNA调控HCC耐药性 化疗在HCC治疗中的作用及其微弱,究其原因在于HCC对化疗药物不敏感。miRNA在调控HCC耐药性方面亦具有重要作用。HCC的多重耐药性(multi-drug resistance,MDR)通常与 P-glycoprotein(P-gp/ABCB1)蛋白的高表达有关。研究[56]发现miR-491-3p可通过靶向Sp3调控ABCB1表达,增加HCC细胞对化疗的敏感性。Wang等[57]发现miR-183可促进MRP2、P-gp、p-STAT3和HIF-1α表达,增加BEL-7402细胞对5-FU的耐受性。Shao等[58]发现miR-205-5p在HCC细胞中呈低表达,而在多重耐药性细胞中呈高表达,miR-205-5p可通过靶向PTEN/JNK/ANXA3信号通路降低HCC细胞对5-Fu的敏感性。肝脏特异性miR-122亦在调控HCC的MDR方面具有重要作用,Yahya等[59]发现miR-122可调控MDR相关基因(ABCB1、ABCC1、ABCG2和ABCF2)表达,过表达miR-122可增加HCC细胞HepG2对表柔比星的化疗敏感性。
索拉非尼可有效延长晚期HCC患者的生存期,系晚期HCC患者的首选用药,但其临床有效率较低。Yang等[60]研究发现miR-34a在HCC组织中呈显著性低表达,体外研究证实miR-34a可靶向Bcl-2降低索拉非尼诱导的HCC细胞凋亡。Liu等[61]研究发现miR-222可通过调控 PI3K和AKT降低HCC细胞对索拉非尼的敏感性。Pollutri等[62]发现miR-494在具有干细胞样特点的HCC中呈高表达,miR-494过表达可通过mTOR信号通路降低HCC细胞对索拉非尼的敏感性。
3.4 miRNAs在HCC中的临床应用前景
3.4.1 miRNAs用 于HCC诊 断 miRNA表 达谱可反映肿瘤的来源、分期以及其它临床病例特征,miRNAs可被用作肿瘤诊断的工具。Qu等[63]通过检测105例HCC患者、107例慢性肝病患者及71例正常人群中血清miRNA的表达,发现miR-16诊断HCC的敏感性优于AFP、DCP和 AFP-L3%, 且 miR-16、AFP、AFP-L3% 和DCP联合检测诊断HCC的敏感性和特异性分别为92.4%和78.5%,尤为重要的是对于常规检测指标均为阴性且肿瘤直径<3 cm的患者,miR-16的阳性预测率高达69.2%,显示出miRNA在HCC诊断方面的巨大价值。Liu等[64]研究发现miR-15b和miR-130b联合检测对于诊断HCC的敏感性和特异性分别为 98.2%和91.5%,且对于AFP<20 ng/mL的HCC患者,其联合检测的敏感性为96.7%。Lin等[65]研究证实,血清miR-224可用于诊断早期HCC,其诊断的灵敏性和特异性分别为86.5%和76.7%,均显著优于AFP。最近,Fornari等[66]研究发现,血清miR-939、miR-595和miR-519d可用于区分肝硬化和HCC患者,其用于诊断HCC的效能分别为0.84、0.92和0.82,均明显优于AFP(0.73)。
外泌体(exosomes)是一种直径约40~100 nm,由脂质双层膜包裹的囊泡,外泌体胞内成分较为复杂,具有广泛存在或细胞特异的蛋白、miRNA、mRNA 和其他非编码RNA核酸分子[68]。外泌体 miRNA在HCC诊断中具有重要价值。Wang等[68]发现,外泌体miR-122、miR-148a和miR-1246在HCC患者中呈显著性高表达,其中miR-148a在区分HCC和肝硬化患者方面的诊断效能为0.891,显著优于AFP(0.712);在区分HCC患者和正常人群方面,miR-122的诊断效能高达0.990;此外,miR-122、miR-148a和AFP联合用于区分HCC和肝硬化患者的诊断效能高达0.931。
近年来,miRNA尤其是血清miRNA在诊断HCC方面显示出巨大的价值,且随着实时定量RTPCR技术的发展,miRNA检测的灵敏度日益提高,如今可以在ng级的总RNA中检测的到miRNA表达,因而进一步深入研究并筛选出具备最佳诊断效能的miRNA,将有助于提高HCC的早期诊断率,并进而提高HCC的整体治疗效果。
3.4.2 miRNA用于监测HCC预后 近年来,高通量技术的应用使得大规模地研究基因表达谱与病原学、分期、复发倾向及预后相关的分子信号特征成为可能。miRNA不仅能诊断HCC,亦可用来预测HCC转移和复发、判断患者生存、指导术后辅助治疗。Sato等[69]利用miRNA芯片检测了73例HCC组织中的miRNA表达谱,筛选出13个与HCC复发密切相关的miRNAs,上述miRNAs联合检测可有效的预测HCC术后早期复发。Zhu等[70]研究发现miR-29a-5p的表达水平与HCC术后早期复发密切相关,miR-29a-5p用于预测HCC术后早期复发的敏感性和特异性分别为74.2%和68.2%。Zhang等[71]以 miR-145、miR-31和 miR-92为基础建立了HCC术后预测模型,其预测HCC术后淋巴结转移的敏感性和特异性分别为69.6%和80.2 %。
鉴于循环miRNA具有良好的稳定性、检测的无创性和可重复性等自身特性,使体液miRNAs检测在预后预测中的价值日益受到重视。Qu等[72]发现miR-665在HCC患者血清中呈高表达,其表达水平与HCC肿瘤大小及局部侵袭转移显著相关,且miR-665高表达HCC患者的预后较差。miR-125b在HCC患者血清外泌体中呈高表达,其表达和HCC患者至进展时间和总生存时间显著相关[73]。
3.4.3 miRNA用于HCC治疗 鉴于miRNA通常在HCC中表达异常,并具有重要的癌基因或抑癌基因功能,对它们的表达量进行调节可能有助于逆转HCC的某些表型异常,达到治疗HCC的目的。对于某些低表达或不表达的miRNA,可采用过表达的方法导入相应的外源性miRNA,如化学合成miRNA类似物或病毒载体技术;另一方面,对于高表达的miRNA,可采用多种方法下调或抑制其表达,常用的是反义寡核酸肽段,如antagomirs或2-氧-甲基修饰的寡聚核苷酸链。miR-199在HCC组织中常呈显著性低表达,Callegari等[74]构建了miR-199的腺病毒表达载体,使其在HCC细胞中特异性表达,体内研究发现腺病毒注射可显著抑制小鼠体内种植瘤的生长,显示出良好的HCC治疗效果。Varshney等[75]利用短肽纳米颗粒包裹miR-199a-3p,可将细胞内miR-199a-3p的水平提高500倍,进而通过mTOR信号通路显著抑制HCC细胞生长,裸鼠荷瘤模型证实尾静脉注射miR-199a-3p纳米颗粒可有效抑制HCC生长,抑制效率超过50%。
靶向miRNA治疗目前已成为肿瘤靶向治疗研究的热点之一,但其安全性和有效性目前尚缺乏大量证据。miR-122在HCV感染中具有重要调控作用,上调miR-122的表达可有效抑制慢性丙肝患者体内的HCV RNA水平。van der Ree等[76]探讨了靶向miR-122药物(miravirsen,又名SPC3649)治疗在慢性丙肝患者中的安全性和有效性,研究共入组36例患者,其中27例患者接受了miravirsen皮下注射(3~7 mg/kg,5周),结果证实该药物可有效抑制HCV RNA复制且未见明显不良反应。miRNA-34a在众多恶性肿瘤中呈显著低表达,Beg等[77]开展临床I期研究探索脂质体miR-34类似物(MRX34)在实体瘤治疗中的安全性和最大耐受剂量,MRX34静脉注射,每周两次,持续3周;研究共入组47例患者,其中HCC14例,其主要不良反应包括发热64%、乏力57%、后背疼痛57%、恶性49%、腹泻40%等,研究发现MRX34治疗呈现出客观的抗肿瘤活性且不良反应在可耐受范围之内。
4 结语及展望
近年来,miRNA在HCC发生发展中的相关研究已成为HCC研究领域的前沿热点,并已取得了较大进展。越来越多的证据使得miRNA在HCC发生、侵袭和转移中的功能更进一步的阐明,完善和丰富了HCC发生发展的分子生物学与遗传学机制,为HCC的诊断、治疗提供了新的分子标志物和靶点。
尽管如此,仍有许多问题需要科研工作者们进一步研究解决:⑴ 已知miRNA在HCC发生发展中的作用及其作用机制研究。截至目前,大量HCC内差异表达的miRNA被发现,但其具体作用机制仍大部分未知。⑵ miRNA自身表达和功能的调控机制研究。既往大多数研究仅关注miRNA调控mRNA的功能,而miRNA自身的表达与功能又受哪些因素调控等方面的研究还很少涉及。⑶ 靶向miRNA的治疗研究,发展具有更长半衰期、更高效能的改良拟miRNA分子和反义分子,开展基于miRNA的转基因和基因敲除体内实验为该类药物研发的安全性与有效性提供更多有价值的信息。这些问题的解决都将有助于推动miRNA在HCC等肿瘤临床诊断与治疗领域中的广泛应用。
尽管miRNA应用于HCC诊断、治疗等方面的尝试才刚刚开始,但已显现出巨大的潜在应用价值,有理由相信随着对miRNA作用及其作用机制的深入了解,以miRNA为靶点的新药物将会不断出现,基于miRNA的基因治疗策略将会掀开HCC治疗的新篇章。
