Th17/Treg、IL-17在慢性阻塞性肺疾病患者中的表达及与肺功能的相关性
2018-08-03张占强吴春艳王美玲牛慧艳
张占强,吴春艳,方 彬,王美玲,牛慧艳
(1. 河北省涿州市医院,河北 涿州 072750;2. 河北省保定市第一中心医院,河北 保定 071000)
慢性阻塞性肺疾病(COPD)是临床上常见的呼吸系统疾病,近年来其发病率呈持续增长的趋势[1]。COPD的病理基础是气道壁和肺实质的慢性炎症及结构破坏,可表现为肺实质改变及外周血T淋巴细胞数量异常[2]。研究表明,辅助性T细胞17(Th17)及调节性T细胞(Treg)参与各种自身免疫性疾病和慢性感染性疾病中的免疫调节,在COPD发病机制中发挥着重要作用[3-4]。而白细胞介素-17(IL-17)是Th17细胞特异性分泌的细胞因子,可诱导机体组织损伤,并参与炎症反应的发生发展[5]。本研究通过观察慢性阻塞性肺疾病患者外周血淋巴细胞中Th17和Treg细胞含量及IL-17水平变化,并分析Th17、Treg及IL-17与肺功能指标的相关性,探讨Th17、Treg及IL-17在COPD患者预后评估中的价值,以期为临床防治提供依据。
1 临床资料
1.1一般资料 选取2014年1月—2016年10月河北省涿州市医院呼吸内科收治的COPD患者共184例作为COPD组,其中男118例,女66例,年龄36~81(63.28±10.16)岁。COPD稳定期患者92例,COPD急性加重期(AECOPD)患者92例。COPD的诊断均符合中华医学会呼吸病学分会慢性阻塞性肺疾病学组修订的《慢性阻塞性肺疾病诊治指南(2013年修订版)》[6]。排除合并有其他肺部疾病或感染者,合并有其他系统疾病如心、肝、脑、肾等严重功能障碍者,长期应用激素者,恶性肿瘤或预计生存期不到3个月者,近期手术、妊娠及哺乳期者。另选取同期我院健康体检者95例作为对照组,男60例,女35例,年龄38~79(62.54±9.83)岁。各组性别、年龄及病史等基本资料比较差异无统计学意义(P均>0.05),均具有可比性。
1.2主要仪器及试剂 美国Becton Dickinson公司的FACS Calibur流式细胞仪,流式抗体均购自美国Becton Dickinson公司。细胞刺激培养所需离子霉素、豆蔻酰佛波醇乙酯、莫能菌素购自美国ENZO Alexis-Biomol公司,胞内检测所需固定破膜试剂盒及荧光定量PCR所需试剂购自美国Invitrogen公司,所需引物、探针由上海博亚生物技术公司合成。荧光定量PCR仪购自美国Applied Biosystems公司(ABI 7500 Sequence Detection System),酶标仪购自美国Bio-Rad公司(型号550),低温高速离心机(Beckman)。ELISA试剂盒购自北京博奥森生物技术有限公司。
1.3研究方法 比较各组外周血Th17、Treg、Th17/Treg、IL-17水平及肺功能指标情况,分析Th17、Treg、Th17/Treg、IL-17与肺功能指标的相关性,并应用ROC曲线评价Th17、Treg、Th17/Treg及IL-17对AECOPD患者的诊断效能。
1.3.1外周血Th17及Treg细胞检测 所有研究对象均于清晨空腹采集静脉血3 mL,经肝素抗凝及加入等体积淋巴细胞分离液后1 500 r/min离心15 min,得到外周血单个核细胞(PBMC)悬液,铺至24孔细胞培养板,并在RPMI-1640培养基中加入10%胎牛血清。每孔加入豆蔻酰佛波醇乙酯2.5 μL(终浓度50 ng/mL)、离子霉素2 μL(终浓度1 μg/mL)及莫能菌素2 μL(终浓度10 μg/mL)吹打混匀,孵育4 h。加入抗人CD4单抗20 μL,室温避光孵育20 min。再通过加入染色缓冲液2 mL及抗IL-17单抗20 μL,室温孵育15 min,此后1 500 r/min离心10 min,弃上清,加入染色固定液1 mL,等待上流式细胞仪检测。
1.3.2肺功能检查 采用肺功能仪(Sensormedics)对所有研究对象行肺功能检查,包括测定第1秒用力呼气量(FEV1)、FEV1占预计值百分比(FEV1%)、用力肺活量(FVC)、FVC占预计值百分比(FVC%)及第1秒用力呼气量占用力肺活量的百分比(FEV1/FVC)。目前临床上以FEV1作为COPD诊断、分级和衡量预后的标准。

2 结 果
2.1COPD组与对照组外周血Th17、Treg、Th17/Treg及IL-17水平比较 COPD组外周血Th17、Th17/Treg及IL-17水平均明显高于对照组(P均<0.05),外周血Treg细胞含量明显低于对照组(P<0.05)。见表1。

表1 2组外周血Th17、Treg、Th17/Treg及IL-17水平比较
2.2各组外周血Th17、Treg、Th17/Treg及IL-17水平比较 AECOPD组和COPD稳定期组外周血Th17、Th17/Treg及IL-17水平明显高于对照组(P均<0.05),且AECOPD组外周血Th17、Th17/Treg及IL-17水平明显高于COPD稳定期组(P均<0.05)。AECOPD组和COPD稳定期组外周血Treg细胞含量均明显低于对照组(P均<0.05),且AECOPD组外周血Treg细胞含量明显低于COPD稳定期组(P<0.05)。见表2。
2.3各组肺功能指标比较 AECOPD组和COPD稳定期组FEV1、FEV1%、FVC、FVC%、FEV1/FVC均明显低于对照组(P均<0.05);且AECOPD组FEV1、FEV1%、FVC%、FEV1/FVC均明显低于COPD稳定期组(P均<0.05)。见表3。

表2 各组外周血Th17、Treg、Th17/Treg及IL-17水平比较

表3 各组肺功能指标比较
2.4外周血Th17、Treg、Th17/Treg及IL-17与肺功能指标的相关性分析 Spearman相关性分析显示,COPD患者外周血Th17、Th17/Treg及IL-17与FEV1、FEV1%、FVC、FVC%、FEV1/FVC均呈负相关(P均<0.05);而COPD患者外周血Treg细胞与FEV1、FEV1%、FVC、FVC%、FEV1/FVC均呈正相关(P均<0.05)。其中外周血Th17、IL-17与FEV1%的相关性较好(r=-0.747,-0.753,P<0.05)。见表4和图1。
2.5外周血Th17、Treg、Th17/Treg及IL-17对AECOPD的诊断价值 外周血Th17、Treg、Th17/Treg及IL-17诊断AECOPD的AUC及95%CI分别为0.862[0.764,0.963],0.783[0.705,0.848],0.814[0.726,0.875],0.851[0.758,0.946]与对照组(AUC=0.5)比较差异均有统计学意义(P均<0.05)。取外周血Th17最佳临界值为7.28%时,其诊断AECOPD的灵敏度和特异度最好,分别为80.4%和87.3%。见图2和表5。
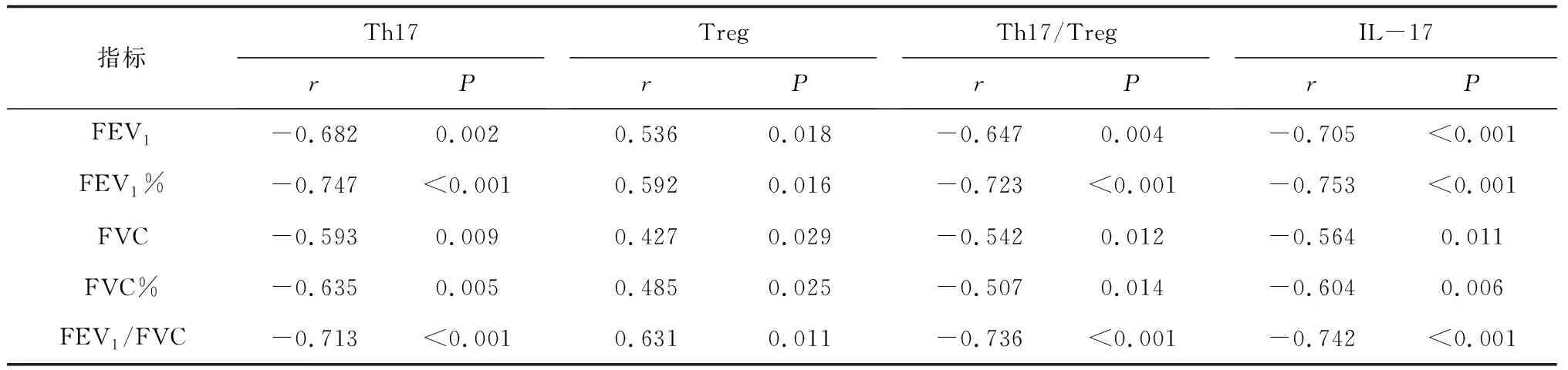
表4 外周血Th17、Treg、Th17/Treg及IL-17与肺功能指标的相关性分析
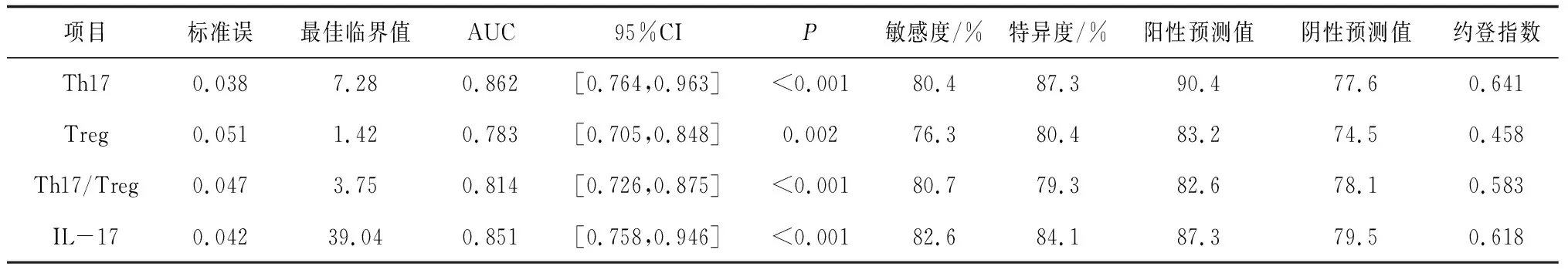
表5 外周血Th17、Treg、Th17/Treg及IL-17对AECOPD的诊断价值
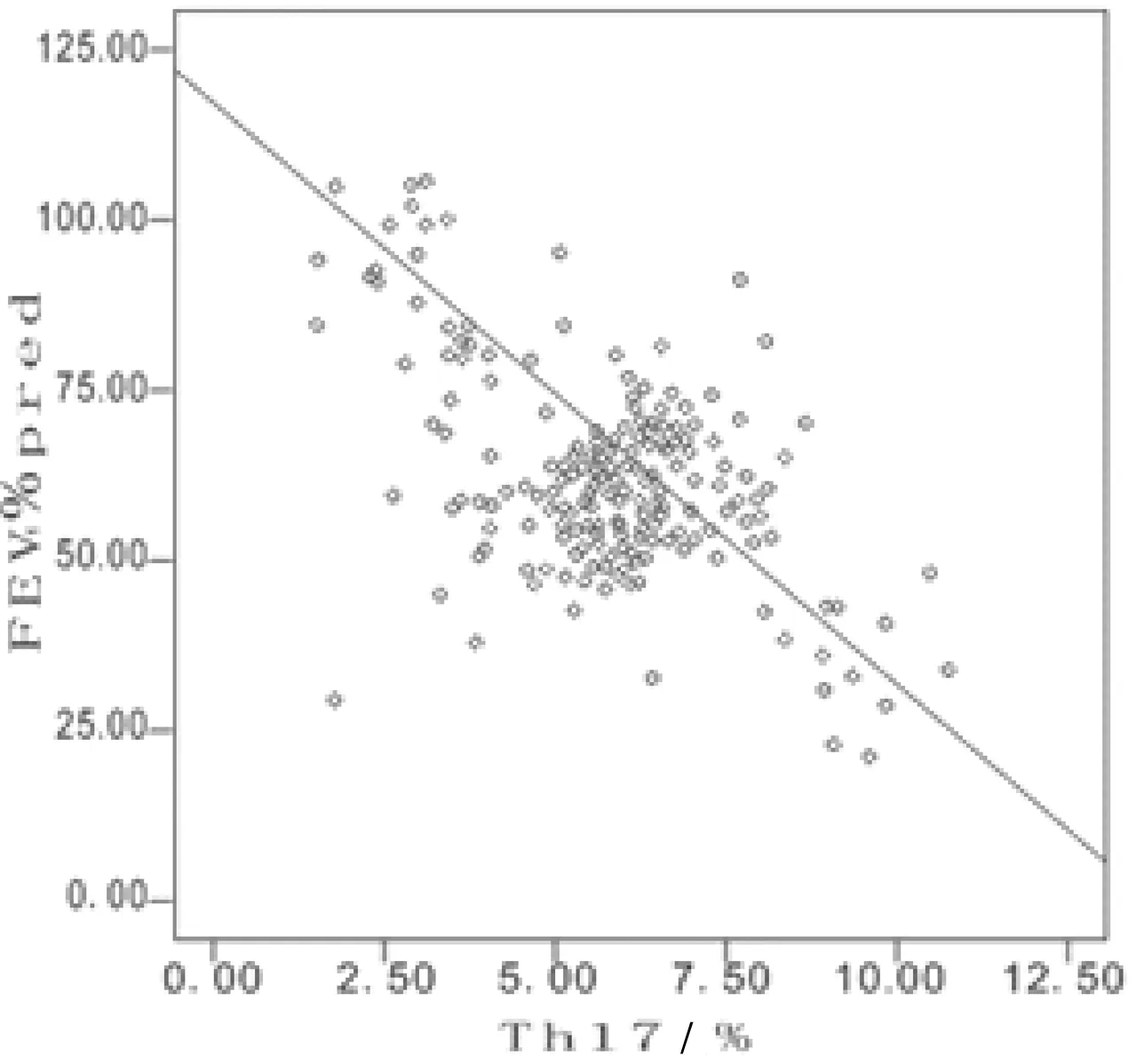
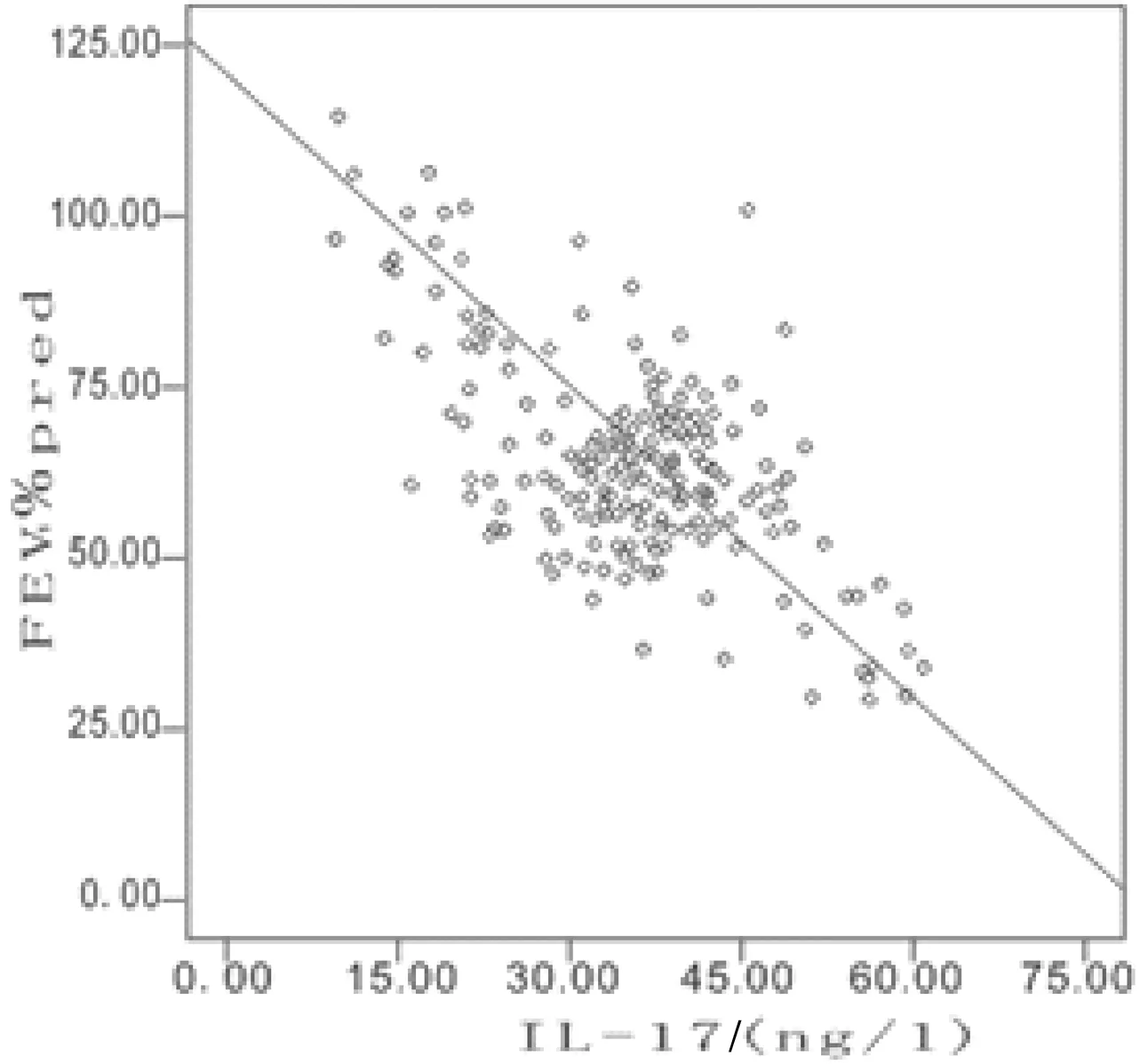
图1 外周血Th17、IL-17与FEV1%的相关性
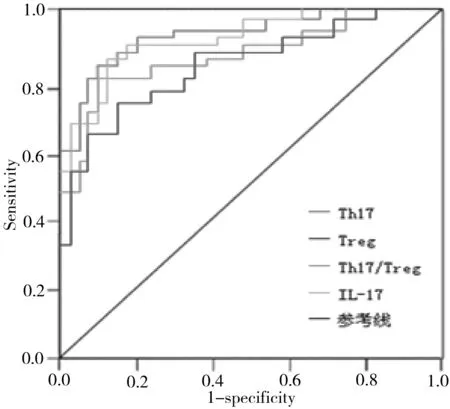
图2 外周血Th17、Treg、Th17/Treg及IL-17诊断AECOPD的ROC曲线
3 讨 论
COPD是各种炎症细胞参与的全身异常炎症反应性疾病,以不完全可逆的气流受限为主要特征。目前,COPD的发病率较高,预后较差,严重危害人类健康,同时给患者及社会带来沉重的经济负担。因此,如何早期诊断及预测其病情严重程度对降低COPD的病死率具有重要意义。
Th17与Treg是一类近年来发现的淋巴细胞亚群,两者分化上相互关联,功能上相互拮抗,Th17/Treg细胞的平衡关系对于维持机体免疫稳定和预防炎症性疾病的发生具有重要作用[7-8]。Th17细胞分泌的IL-17可促使体内炎症细胞释放大量的致炎因子和趋化因子,诱导和活化中性粒细胞,进而引起中性粒细胞向炎症组织聚集[9]。多项研究表明,Th17/Treg可能在慢性炎症性肺部疾病发生和发展过程中发挥着重要的调节作用[10-11]。本研究结果显示,COPD组外周血Th17、Th17/Treg及IL-17水平明显高于对照组,而COPD组外周血Treg细胞含量明显低于对照组,与Li等[12]研究结果基本一致。这提示Th17、Treg、Th17/Treg及IL-17可能参与COPD的发生发展。Chang等[13]研究表明,在COPD患者中CD8+和CD4+细胞所产生的细胞因子IL-17A和IL-17F相对于对照组是明显增加的。COPD是慢性炎症反应,且炎症主要从肺部产出,引起全身炎症反应,进而引起组织破坏的病理性免疫应答发生,使Treg细胞含量减少。与对照组比较,COPD稳定期组外周血Th17、Th17/Treg及IL-17水平明显升高,且AECOPD组升高更明显;与对照组比较,COPD稳定期组外周血Treg细胞含量明显下降,且AECOPD组下降更明显。可见Th17、Treg、Th17/Treg及IL-17在COPD的发病过程中起着重要的作用,与COPD症状严重程度密切相关。Domagaa-Kulawik等[14]研究认为,Th17/Treg平衡参与了COPD的免疫调节过程,使得Th17及Treg细胞含量在COPD患者不同时期中存在差异。另有研究也表明,IL-17作为致炎因子,全程参与了COPD患者炎症的发生、发展,随着COPD病变程度的加重,IL-17水平随之升高,Th17细胞及其特异性分泌因子IL-17可能介导了COPD的炎症过程[15-16]。与对照组比较,COPD稳定期组FEV1、FEV1%、FVC%、FEV1/FVC明显下降,且AECOPD组下降更明显。相关性分析显示,COPD患者外周血Th17、Th17/Treg及IL-17水平随FEV1、FEV1%、FVC、FVC%、FEV1/FVC的下降而明显升高;COPD患者外周血Treg细胞含量随FEV1、FEV1%、FVC、FVC%、FEV1/FVC的下降而明显下降。这说明自身免疫功能失调对COPD患者肺功能的下降产生重要的影响,Th17型免疫应答介导了COPD发病过程中的自身免疫应答,同时由于COPD患者体内具有免疫抑制作用的Treg细胞数下降或功能异常可引起患者肺功能指标下降。既往研究发现,自身免疫反应是导致COPD患者持续存在气道慢性炎症的主要原因,而持续存在气道慢性炎症可导致上皮细胞损伤甚至气道重塑,最终导致肺功能损伤[17-18]。此外,IL-17参与了COPD患者肺部慢性炎症进展的病理损伤,IL-17水平与COPD气道受限加重程度呈正相关[19]。应用ROC曲线分析显示,外周血Th17、Treg、Th17/Treg及IL-17对AECOPD的诊断具有重要的参考价值,而且外周血Th17最佳临界值为7.28%时,其诊断AECOPD的灵敏度和特异度最好,分别为80.4%和87.3%。说明外周血Th17细胞水平可有效地反映COPD患者病情严重程度,是预测COPD急性加重的可靠指标。Podolin等[20]研究也表明,外周血Th17细胞水平较传统感染标志物(CRP、WBC)更能准确地预测感染和炎症水平,是早期预测AECOPD的有效指标。因此,通过抑制COPD患者外周血Th17细胞水平,可显著降低患者机体炎症反应,从而改善患者预后。
综上所述,外周血Th17、Treg、Th17/Treg及IL-17参与了COPD患者呼吸道慢性炎症的发生发展过程,并可能导致炎症的持续存在及肺功能的逐步损害,同时与COPD病情严重程度密切相关。但本研究为小样本单中心研究,可能存在一定的偏倚,尚需多中心、大规模的前瞻性研究来进一步证实。
