甲状旁腺素促进骨质疏松骨折大鼠Ⅰ型胶原代谢的研究
2018-08-02孙明曜曾弈沈彬
孙明曜 曾弈 沈彬*
1. 四川大学华西医院,四川 成都 610041 2. 首都医科大学附属北京安贞医院,北京 100029
甲状旁腺素(parathyroid hormone,PTH)是一类能够调节骨代谢的激素[1-2]。在临床上,小剂量的甲状旁腺素能够有效预防和治疗骨质疏松,无论是特立帕肽[PTH(1-34),一段包含了34个氨基酸的PTH内源性片段],还是全长的PTH(1-84),都能够有效减少骨质疏松骨折的风险[3-4]。另一方面,对于已经发生了骨质疏松骨折的患者,间断低剂量的使用PTH可以缩短骨折愈合的时间,改善愈合效果[5-7],甚至对于部分骨缺损的修复,也有良好的促进效果[8-9]。
骨质疏松性骨折的风险不仅仅受骨密度影响,更取决于骨强度的变化。Ⅰ型胶原作为构成细胞外基质的主要成分,它的含量和排列结构密切影响着骨基质的质量、骨构架形成以及骨的强度[10]。前人研究发现,在骨质疏松患者的骨组织中,Ⅰ型胶原含量有着不同程度的减低,其排列结构也变得紊乱[11-12]。故Ⅰ型胶原与骨质疏松及骨质疏松骨折之间有着密切的联系。COL1A1是编码Ⅰ型胶原α1链的基因。通过对COL1A1 mRNA转录水平的检测,可以推测Ⅰ型胶原代谢的动态过程,并判断Ⅰ型胶原含量的变化趋势。所以COL1A1基因的检测也是研究Ⅰ型胶原变化趋势的一项重要手段。不过有关PTH对Ⅰ型胶原及COL1A1影响的研究,尤其在骨质疏松性骨折中的研究,目前文献报道尚少。
因此本研究拟通过建立骨质疏松性骨折大鼠模型,在PTH(1-34)的干预下,检测骨折断端标本HE染色、Ⅰ型胶原免疫组化染色及COL1A1 mRNA表达水平,并与对照组对比,进而探讨骨折愈合过程中PTH影响下Ⅰ型胶原代谢的变化。
1 材料与方法
1.1 建立大鼠骨质疏松模型
选取清洁级SD雌性成年大鼠,体重(300±50)g,分为手术组(OVX组)及假手术组(Sham组),OVX组大鼠切除双侧卵巢,Sham组仅做背部切口,不切除卵巢。术后3个月,取手术组及假手术组各5只,测定骨密度,观察模型是否建立成功。
1.2 建立大鼠胫骨骨折内固定模型
OVX组大鼠骨质疏松模型建立成功后,于胫骨中上段1/3处锯断双侧胫骨,并以克氏针行胫骨髓腔髓内固定。即建立大鼠胫骨骨折内固定模型。术后于手术切口及克氏针针眼处涂抹红霉素药膏,并肌注头孢呋辛(30 mg/100 g)预防感染。
1.3 分组与取材
将64只骨质疏松胫骨骨折模型大鼠随机分为两组,每组32只。A组(PTH组)予以特立帕肽3 μg/(100 g·d)皮下注射,每天一次;B组(NS组)予以等量生理盐水皮下注射,每天一次。自第一天给药起,分别于第1、2、4、8 周随机选取A组及B组大鼠各8只进行取材。处死大鼠后,取双侧胫骨标本,拔除内固定物,一部分胫骨存放于液氮,用RT-PCR检测COLIA1mRNA的表达水平;另一部分固定于4%多聚甲醛,行HE染色及免疫组化染色。
1.4 统计学方法
2 结果
2.1 骨质疏松模型的建立
大鼠双侧卵巢切除术后3个月,取OVX手术组大鼠及Sham假手术组大鼠各5只,在双能X线吸收仪上测定其胫骨中上份骨密度。OVX大鼠骨密度:(0.2512±0.0316) g/cm2,Sham组大鼠骨密度:(0.3438±0.0296) g/cm2。OVX大鼠骨密度比Sham组大鼠骨密度降低,差异有统计学意义(t=4.99,P<0.05),骨质疏松模型建立成功。
2.2 骨折模型建立及药物干预后的指标检测
2.2.1大鼠胫骨骨折断端组织COLIA1mRNA合成量:计算COLIA1基因与管家基因相比的相对表达量发现,在PTH大鼠的胫骨标本中,COL1A1 mRNA的表达有着明显的升高,差异与NS组相比有统计学意义(P<0.001),在第8周时仍没有衰减的征象。各组大鼠的COL1A1 mRNA合成对比见表1,时间趋势见图1。
2.2.2大鼠胫骨骨折断端HE染色及Ⅰ型胶原免疫组化染色:骨折术后第2周,HE染色可见:PTH组大鼠骨折断端已趋向闭合,骨折线处有相对于NS组大鼠更多的软骨细胞;NS组大鼠骨折断端之间尚有残存的裂隙,纤维骨痂部分断裂。Ⅰ型胶原免疫组化可见:PTH组大鼠骨折线软骨层的边缘已部分骨化,软骨层中心可见部分新生的Ⅰ型胶原纤维;而NS组大鼠骨痂组织中未看到新生Ⅰ型胶原的表达。术后第4周HE染色:PTH组大鼠骨痂内软骨细胞数量相对较多,骨折线两侧的骨微结构排列一致有序;NS组大鼠骨痂形态欠佳,软骨细胞少,骨折线两侧骨微结构紊乱、不对称。Ⅰ型胶原免疫组化:PTH组大鼠骨痂中有大量Ⅰ型胶原纤维形成,胶原纤维的排列方向均匀一致,呈现出自骨痂中线向骨痂边缘的对称性增强;NS组大鼠的骨痂组织中几乎看不到Ⅰ型胶原的染色。到第8周,两组大鼠的骨折断端都已经闭合,PTH组大鼠骨痂已基本完全骨化,残存的软骨细胞极少,已经观察不到成束的Ⅰ型胶原纤维,仅见大片已修复良好的骨基质;而NS组大鼠骨痂内尚残存部分未骨化的软骨细胞, 骨折线两侧还能观察到血管翳的长入(图2~4)。

表1 两组大鼠不同时间点COL1A1 mRNA的相对表达量Table 1 The relative expression levels of COL1A1 mRNA in the two groups of rats at different time points
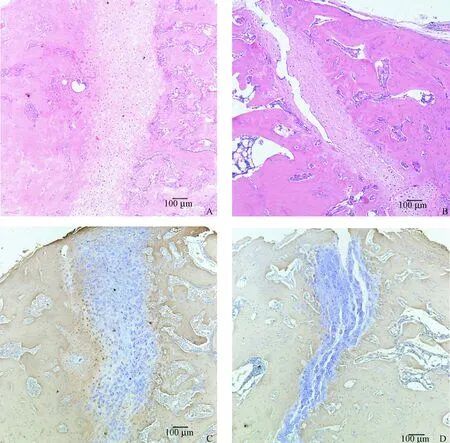
图2 骨折术后2 w PTH组与NS组大鼠胫骨骨折断端切片。A:PTH组大鼠HE染色;B:NS组大鼠HE染色;C:PTH组大鼠Ⅰ型胶原免疫组化;D:NS组大鼠Ⅰ型胶原免疫组化Fig.2 The tibial slices of the PTH group and the NS group of rats 2 weeks after fracture surgery. A: HE staining of the PTH group of rats; B: HE staining of the NS group of rats; C: IHC staining of the PTH group of rats; D: IHC staining of the NS group of rats.
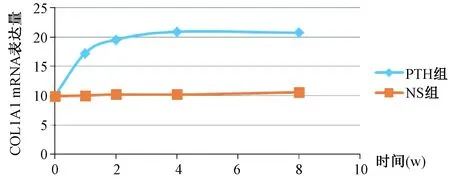
图1 两组大鼠COL1A1 mRNA相对表达量随时间变化趋势图Fig.1 The relative expression levels of COL1A1 mRNA in the two groups of rats at different time points

图3 骨折术后4 w PTH组与NS组大鼠胫骨骨折断端切片。A:PTH组大鼠HE染色;B:NS组大鼠HE染色;C:PTH组大鼠Ⅰ型胶原免疫组化;D:NS组大鼠Ⅰ型胶原免疫组化Fig.3 The tibial slices of the PTH group and the NS group of rats 4 weeks after fracture surgery. A: HE staining of the PTH group of rats; B: HE staining of the NS group of rats; C: IHC staining of the PTH group of rats; D: IHC staining of the NS group of rats.
3 讨论
甲状旁腺素的基本功能是维持血钙的平衡,促进磷酸盐及维生素D3的重吸收,以及调节骨的代谢[1-2,8]。已有研究证实,PTH对骨代谢的调节为双向作用,长期大量的分泌将导致骨的过分吸收与破坏,但是间断规律地给予PTH,反而可以增加新骨的生成[13-14]。这种研究是通过检测骨代谢标记物Ⅰ型前胶原氨基末端前肽(procollagenⅠN-terminal peptide,PINP)、Ⅰ型胶原羧基末端肽(typeⅠcollagen carboxyl terminal peptide,CTX-Ⅰ)等进行的。这些标记物恰是Ⅰ型胶原代谢的产物,这在侧面也反映了Ⅰ型胶原的代谢与骨代谢密不可分。正如前文所述,Ⅰ型胶原的含量和排列结构共同影响着骨基质的质量,以及骨的强度。另外有研究报道,在股骨颈骨折患者的骨折部作骨结构的观察,发现其板层骨的厚度发生了变化,提示在骨折处发生了Ⅰ型胶原排列的紊乱[15]。这表明在骨折断端,Ⅰ型胶原的排列会产生一定的影响。那么,在应用了PTH之后,Ⅰ型胶原的排列是否会得到有效的改善呢?目前尚没有相关文献报道。而编码Ⅰ型胶原α1链的基因正是COL1A1基因,通过对COL1A1 mRNA转录水平的检测,可以推测Ⅰ型胶原代谢的动态过程,并判断Ⅰ型胶原含量的变化趋势。综上,笔者设计了此实验,通过PTH干预胫骨骨质疏松性骨折的大鼠,观察并检测骨折断端Ⅰ型胶原的表达及排列,以及COL1A1 mRNA转录水平,从而分析PTH对骨质疏松性骨折过程中Ⅰ型胶原代谢的影响。
通过对骨折断端的染色观察发现,相比于对照组,PTH影响下的Ⅰ型胶原不仅表达更快、更多,其排列结构也更为有序。此前也曾有人进行过类似的研究。Ascenzi等[16]曾对接受PTH治疗的骨质疏松女性的皮质骨进行了高倍率的光学及电子显微镜观察,发现在PTH组患者的骨组织中,Ⅰ型胶原排列更为有序、方向更为一致,由此促成了更厚的皮质骨板层。这与本研究观察的结果是相符合的。不过Ascenzi等并没有对Ⅰ型胶原的含量进行测定。Saito等[17]则在实验动物体内进行了PTH注射下胶原蛋白的含量测定。他们以切除卵巢的猴子作为骨质疏松模型,分别进行低剂量(1.2 μg/kg)和高剂量(6.0 μg/kg)hPTH(1-34)每周一次的注射,18个月后监测其腰椎椎体的胶原含量。结果发现在低剂量PTH组中,腰椎椎体内胶原含量明显高于对照组。然而Saito等的实验也存在一定的局限性。首先,他们所测定的“胶原”不能明确是单纯的Ⅰ型胶原,而很有可能是多亚型胶原的混合;其次,他们的监测时间点只有一处,不能很好地反映胶原代谢的动态变化。Kakar等[18]曾对建立了股骨骨折模型的雄性小鼠进行了为期14 d的PTH(1-34)间断注射,发现在细胞外基质中,与软骨生成和骨生成相关的基因表达升高了3倍,这提示PTH可以促进骨折愈合过程中软骨的增殖和分化。本研究的HE染色和免疫组化染色结果也印证了Kakar等的推断,提示PTH能够有效地加强骨折愈合过程中软骨内成骨的作用。
本研究还采用了荧光定量PCR的方法,检测了骨痂附近骨组织内COL1A1 mRNA的相对含量。在前人的研究中,直接研究PTH对大鼠COL1A1基因表达影响的实验很少见。McClelland 等[19]对雄性大鼠进行了持续5 d、每天一次(40 ug/kg)的hPTH(1-34)注射,然后对其股骨远端干骺端的骨组织进行DDRT-PCR扩增,在其中检测到了COL1A1 mRNA的表达。该实验对于探索PTH与COL1A1关系具有很好的指导意义,但是也存在不足。首先他们没有和对照组进行表达量的对比;其次实验大鼠不是骨质疏松模型,不能排除其基线水平的差异;再次,由于干预时间过短,不能体现COL1A1水平的变化趋势。本研究借鉴McClelland 等人的经验和教训,将大鼠随机分组,在给药之前检测了COL1A1的基线表达水平,并将研究时间增加至8 w。最终通过COL1A1表达时间趋势图发现PTH组大鼠的COL1A1基因mRNA转录水平有着明显的升高,这印证了McClelland 等人的研究结果,也侧面反映了Ⅰ型胶原的表达是活跃的。
综上所述,本研究通过观测PTH干预下骨质疏松骨折大鼠的愈合,证实了PTH可以加强骨折断端Ⅰ型胶原的代谢,促进Ⅰ型胶原的合成和重塑,从而有效增加骨痂组织Ⅰ型胶原的含量和结构排列。这提示了PTH可以通过调节Ⅰ型胶原的代谢增加骨的强度,从而有效地治疗骨质疏松。
