一株番鸭致病性大肠杆菌的分离鉴定及药敏试验
2018-08-01陈锦婵福建省福州市长乐区动物疫病预防控制中心福州350200
陈锦婵 福建省福州市长乐区动物疫病预防控制中心 福州 350200
鸭大肠杆菌病是由致病性大肠杆菌引起的鸭的重要疾病,该病常见的表现型有败血症、心包炎、腹膜炎、气囊炎和输卵管炎等多种病型[1-3]。目前,兽医临床上主要应用抗菌药物来预防和控制鸭大肠杆菌病,导致耐药菌的不断产生,而且不同养殖区域的流行菌株对抗生素的敏感性也存在差异。因此,对当地致病菌进行分离鉴定并进行药敏试验具有重要的意义[4-6]。2014年4月,长乐市漳港街道某养鸭场发病,患鸭精神萎靡、食欲减退、排绿色稀粪,剖解病死鸭可见心包炎、气囊炎和腹膜炎等病理变化。根据临床症状和病死鸭剖检,初步诊断该病为鸭大肠杆菌病。为进一步确诊该病的病原,本试验进行了细菌分离鉴定,并对分离到的致病菌进行药敏试验,为制定该病的预防和控制措施提供参考。
1 材料与方法
1.1 材料
1.1.1 病料和试验动物 病死鸭来自于长乐市漳港街道某养鸭场;1日龄健康雏鸭由该养鸭场提供。
1.1.2 主要试剂 Taq酶、细菌基因组DNA纯化试剂盒和pMD18-T载体购自宝生物工程(大连)有限公司;麦康凯琼脂培养基购自青岛海博生物技术有限公司;肠杆菌科细菌生化微量鉴定管购自杭州天和微生物试剂有限公司;药敏试纸片购自冰晶天坛药物生物技术开发公司。
1.2 方法
1.2.1 致病菌分离及形态观察 病死鸭以心包炎和腹膜炎为主要病理特征,无菌采取心包液和腹腔积液划线接种于脱纤绵羊血琼脂培养基,37℃培养24 h。挑取形态一致的单克隆菌落进行纯化培养,菌株编号为DC2014-1。将上述纯化的培养物划线接种到麦康凯琼脂培养基,37℃培养24 h,观察菌落形态,革兰氏染色后进行镜检。
1.2.2 动物试验 取DC2014-1菌株接种于营养肉汤培养基,37℃培养 24 h后 10 000 r/min离心10 min。菌体用灭菌生理盐水洗涤3次,将细菌浓度用灭菌生理盐水调整为1.0×1010cfu/mL,用于小鼠攻毒试验。随机选取20羽1日龄健康雏番鸭,分为对照组和攻毒组,每组10羽。对照组试验动物颈部皮下注射0.1 mL灭菌生理盐水,攻毒组试验动物颈部皮下注射0.1 mL经灭菌生理盐水重悬的DC2014-1菌株。观察并记录试验结果。
1.2.3 生化试验 将纯化的DC2014-1菌株接种到肠杆菌科细菌生化鉴定管,37℃培养24 h,观察并记录结果。
1.2.4 16S rRNA序列的扩增和测定 应用细菌基因组DNA纯化试剂盒提取DC2014-1菌株的基因组,以提取的基因组为模板扩增16S rRNA。扩增16S rRNA的上游引物为5'-AGAGTTTGATCCTGGCTCAG-3',下游引物为:5'-ACGGTTACCTTGTTACGACTT-3'[7],引物委托上海英骏生物技术有限公司合成。PCR反应体系:2×Taq酶预混液25 μL,基因组模板 2 μL,上、下游引物各 2 μL,无 RNA 酶水补齐至 50 μL。PCR 反应程序:94℃ 5 min;94℃30 s,42 ℃ 30 s,72 ℃ 60 s,35 个循环;72 ℃ 5 min。预期的PCR扩增产物大小约1 500 bp,PCR产物经琼脂糖凝胶电泳后进行回收,并克隆到pMD18-T载体,载体转化到TOP10感受态细胞,挑取阳性菌落,送上海英骏生物技术有限公司测序。测序结果在NCBI数据库中进行比对分析,选取同源性较高的16S rRNA序列进行多重比较并构建系统发育树。
1.2.5 药敏试验 药敏试验参考文献[8]进行。取200 μL新鲜的DC2014-1菌株培养物均匀涂布于营养肉汤琼脂培养基上,用无菌镊子将药敏纸片均匀贴在琼脂培养基上,37℃培养24 h,测量抑菌圈直径,试验重复3次,计算抑菌圈直径的平均值。
2 结 果
2.1 致病菌分离及形态观察 从病死鸭的心包积液和腹腔积液中分离到一株革兰氏阴性菌,该菌株不溶血,在脱纤绵羊血琼脂培养基上菌落呈乳白色,表面光滑,圆形微凸,直径1~2 mm。该菌菌落在麦康凯琼脂培养基上呈粉红色。挑取典型菌落进行革兰氏染色、镜检,结果显示该菌为两端钝圆的革兰氏阴性粗短杆菌。
2.2 动物试验 在接种DC2014-1菌株12 h后,攻毒组试验鸭表现出扎堆、不愿活动、精神较差、食欲减少;接种24 h后动物开始死亡,至96 h攻毒组试验动物的死亡率高达50%。取攻毒后14 d未死亡的攻毒组雏鸭剖检,可见不同程度的细胞炎和气囊炎等症状,与临床自然发病病例相似,对照组动物则无上述现象。从死亡和发病的攻毒组试验动物体内分离到与接种菌株菌落形态、生化特性、16S rRNA序列一致的细菌,表明该菌为引起该养鸭场感染死亡的病原。
2.3 生化试验 将DC2014-1菌株按常规方法进行生化试验,试验结果表明该菌株对葡萄糖、麦芽糖、甘露醇、乳糖产酸产气;MR试验、过氧化氢酶试验阳性;三糖铁产酸变黄;硫化氢试验、氧化酶试验、尿素酶试验、VP试验、明胶试验阴性,与报道的大肠杆菌生化特征基本一致。
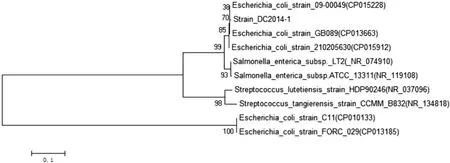
图2 基于分离株调查DC2014-1 16S rRNA基因构建的系统发育树
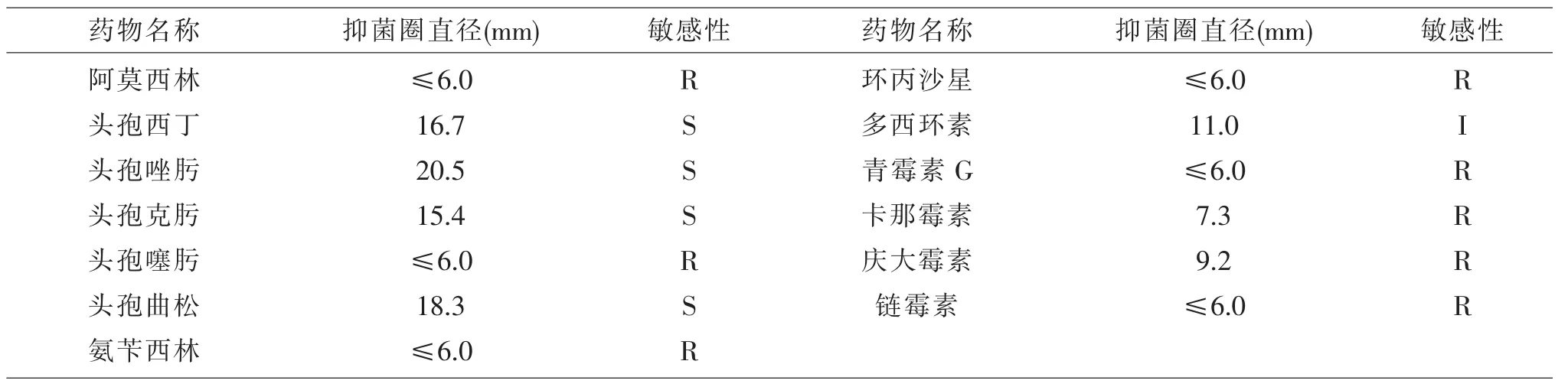
表1 分离株DC2014-1的药敏试验
2.4 16S rRNA序列的扩增和测定 采用特异性引物扩增到DC2014-1菌株的16S rRNA,大小约1 500 bp,与预期结果一致(见图1)。该基因回收测序后与GenBank中的序列比对分析,结果与大肠杆菌的相似度最高。选取相似度最高的细菌16S rRNA序列,多重比较后构建系统发育树,DC2014-1菌株与大肠杆菌在同一分支 (见图2)。根据分离株DC2014-1的形态、生化特征和16S rRNA序列的分析结果,确定其为大肠杆菌。

图1 分离株DC2014-1 16S rRNA基因的PCR扩增
2.5 药敏试验 选用13种抗菌药对分离株DC2014-1进行药物抑菌试验,结果显示(见表1)该菌对头孢西丁、头孢唑肟、头孢克肟和头孢曲松等4种药物高度敏感;对多西环素中度敏感;对阿莫西林、头孢噻肟、环丙沙星、青霉素G、卡那霉素、庆大霉素、链霉素和氨苄西林等8种药物不敏感。
3 讨 论
本试验从病死番鸭的心包液和腹腔积液中分离到一株细菌DC2014-1。该菌的染色特性、生化特性和16S rRNA分析结果表明,该分离株为大肠杆菌,动物回归试验表明该菌为导致番鸭发病死亡的病原。同时,对该分离菌进行药物敏感性分析,结果显示该菌对多种药物耐药,其原因除大肠杆菌自身极易产生耐药性外,也与养殖场长期添加或大剂量使用抗生素防控细菌性疾病有关[9-10]。本试验筛选出对该养殖场大肠杆菌DC2014-1株高度敏感的4种药物头孢西丁、头孢唑肟、头孢克肟和头孢曲松,为该养殖场制定预防和控制大肠杆菌病的措施提供了科学的依据。
