副溶血性弧菌拮抗菌的筛选鉴定及抑菌物质特性研究
2018-08-01郝彦利汪立平2黄宇良薛美翠崔云云赵3李立王正全
郝彦利汪立平,2黄宇良薛美翠崔云云赵 勇,3李 立王正全
(1. 上海海洋大学食品学院,上海 201306;2. 上海海洋大学食品热加工工程技术研究中心,上海 201306;3. 农业部水产品贮藏保鲜质量安全风险评估实验室﹝上海﹞,上海 201306)
副溶血性弧菌既是水产养殖动物细菌性疾病的主要致病菌,又是引起细菌性食物中毒的首要食源性致病菌[1]。水产养殖业中副溶血性弧菌病的防治主要是利用抗生素,但抗生素的滥用不仅产生耐药菌株[2],破坏水产养殖环境生态平衡,而且抗生素类药物在水产品中的残留也给人类健康带来威胁。利用益生菌所产抗菌肽来控制副溶血性弧菌病害的发生,投放益生菌所产抗菌肽既可以维持水产动物肠道菌群平衡,提高水产养殖动物免疫力,又可改善养殖水体环境[3]。抗菌肽(antimicrobial peptides,AMPs)是指生物体内能抵御外界微生物侵害的一类小分子多肽,是生物天然免疫防御系统的重要组成部分。目前研究最多使用最广的微生物抗菌肽是乳酸菌抗菌肽以及芽孢杆菌抗菌肽[4],但乳酸菌所产抗菌肽抑菌谱比较窄,芽孢杆菌抗菌肽在应用于水产养殖方面更具优势,是因为芽孢杆菌可产芽孢,抗逆性强,而且芽孢杆菌可产生多种抗菌肽,抑菌谱广,使其与其他非芽孢类的抗菌肽相比更具开发价值。
1986年,Kozasa等[5]将分离自土壤中的东洋芽孢杆菌应用于水产养殖中,用该菌株处理日本鳗鲡,结果显示,与对照组相比,处理组的鳗鲡死亡率明显降低。而后陆续有研究人员将枯草芽孢抗菌肽应用于副溶血性弧菌病的防治中,例如,Xu等[6]从纳豆中筛选出1株产抗菌肽的枯草芽孢杆菌NT-6,在饲料中添加适量的NT-6抗菌脂肽不仅可以促进凡纳滨对虾的生长,还可以抑制副溶血性弧菌的生长[7];王娇等[8]从养殖环境中筛选出1株可抑制副溶血性弧菌的枯草芽孢杆菌A4,并改善了南美白对虾的生长状态;Nath等[9]从凝乳中筛选出1株枯草芽孢杆菌FPTB23,对副溶血性弧菌有较好的抑制作用。但是,目前报道的从海洋环境中分离的枯草芽孢杆菌比较少,其中阮乾坤[10]从大连海域中筛选到1株海洋枯草芽孢杆菌HS-A38,可抑制副溶血性弧菌。此外,对枯草芽孢杆菌产生的抑菌物质的性质研究也不够深入。本试验拟从海水中筛选对副溶血性弧菌有较好抑制作用的枯草芽孢杆菌,并对其产生的抑菌物质的性质进行研究。
1 材料与方法
1.1 试验材料
1.1.1 样品
海水:上海浦东新区临港海域(30°42′5.8″N,121°53′31.6″E)。
1.1.2 指示菌及培养条件
指示菌及培养条件详见表2。
1.1.3 培养基
分离、纯化及形态观察培养基:营养琼脂培养基[11];
种子培养基:Landy液体培养基[12];
发酵培养基:Landy液体培养基[12];
指示菌培养基:LB培养基[13]、TSB-YE培养基[13]、MRS培养基[13]、YPD培养基[14]。
1.1.4 主要试剂
胰蛋白酶(Trypsin)、胃蛋白酶(Pepsin)、木瓜蛋白酶(Papain)、蛋白酶K(Proteinase K)、中性蛋白酶(Neutral protease):生化试剂,国药集团化学试剂有限公司;
Ezup 柱式细菌基因组DNA 抽提试剂盒、通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')及1492R(5'-GGTTACCTTGTTACGACTT-3'):生工生物工程(上海)股份有限公司;
Tricine-SDS-PAGE凝胶制备试剂盒:康为世纪生物科技有限公司。
1.1.5 主要仪器
可见分光光度计:7200型,尤尼柯(上海)仪器有限公司;
冷冻离心机:H2050R型,湖南湘仪离心机仪器有限公司;
立式压力蒸汽灭菌锅:LDZX-30FA型,上海申安医疗器械厂;
梯度PCR仪:A300型,杭州朗基科学仪器有限公司;
洁净工作台:SW-CJ-1F型,上海博迅实业有限公司;
pH计:PHS-3C型,上海雷磁仪器有限公司;
恒温调速回转式摇床:DKY-II型,上海杜科自动化设备有限公司;
电泳仪:DYY-6C型,北京市六一仪器厂;
垂直电泳槽:JY-SCZ2+型,北京君意东方电泳设备有限公司。
1.2 方法
1.2.1 抗副溶血性弧菌枯草芽孢杆菌的筛选
(1) 菌株的分离:准确量取25 mL海水样品,放入含有225 mL的0.85%无菌生理盐水的锥形瓶中,均质10 min(10次/s),90 ℃水浴10 min[15],10倍系列稀释至10-4,取各梯度稀释液100 μL涂布营养琼脂分离培养基,37 ℃培养12 h,挑取具有芽孢杆菌典型形态的菌落进行划线纯化,纯化3次。
(2) 菌株的初筛:采用点种法[16]。将副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)接种于LB培养基中,37 ℃条件下150 r/min培养12 h,制备菌悬液使其菌浓度达到106CFU/mL。将纯化得到的具有芽孢杆菌典型形态的菌株点种在混有副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)的LB培养基平板上,37 ℃培养12 h。试验重复3次。对具有抑菌效果的菌株进行下一步复筛。
(3) 菌株的复筛:采用打孔法[17]。将初筛得到的菌株在LB平板上37 ℃活化培养18 h,并转接2次,接种到Landy种子培养基中,37 ℃、150 r/min震荡培养24 h,再以3%的接种量接种到Landy发酵培养基中,37 ℃、150 r/min震荡培养24 h。10 000 r/min、4 ℃离心15 min,取其上清液用无菌0.22 μm滤膜过滤,得到无细胞发酵上清液。以副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)、金黄色葡萄球菌(Staphylococcusaureus,R11)、嗜水气单胞菌(Aeromonashydrophila,BYK00516)、单核细胞增生李斯特菌(Listeriamonocytogenes,ATCC19114)为指示菌,菌浓度均为106CFU/mL,通过打孔扩散法(50 μL/孔)进行复筛,参照Liu等[17]的方法进行改进,37 ℃培养24 h,测量抑菌圈的直径。试验重复3次。选择对这4种指示菌均有抑制作用且抑菌效果比较好的菌株进行下一步抑菌谱的测定。
1.2.2 菌株H19产抑菌物质的抑菌谱测定 将筛选获得有抑菌效果的H19菌株制备无细胞发酵上清液,分别取50 μL无细胞发酵上清液采用打孔扩散法[17]测定其对19种指示菌(水产致病菌,食源性致病菌、真菌及其培养条件见表2)抑菌圈的直径,试验重复3次。
1.2.3 抗副溶血性弧菌枯草芽孢杆菌菌株的鉴定 根据枯草芽孢杆菌菌落形态进行初步鉴定,再通过革兰氏染色法在光学显微镜下观察枯草芽孢杆菌菌株的形态,之后进一步进行16S rDNA分子鉴定[18],所得测序结果利用NCBI中BLAST软件比对,并在EZBioCloud网站中查找与其同源性较近菌株的序列,最后利用MAGE 5.0软件构建系统发育树。
1.2.4 菌株H19产抑菌物质的理化性质
(1) 菌株H19产抗菌物质的温度稳定性测定:分别取10 mL无细胞发酵上清液,置于-20,0,20,40,60,80,100,121 ℃条件下处理10 min和30 min,然后立即在25 ℃条件下水浴2 h达室温后,以副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)为指示菌,以抑菌活性为指标,抑菌活性的计算方法详见参考文献[13],试验重复3次。
(2) 菌株H19产抗菌物质的酸碱稳定性测定:分别取10 mL无细胞发酵上清液,用2 mol/L的HC1溶液和2 mol/L 的NaOH溶液调节菌株H19的无细胞发酵上清液的pH,使其pH值为2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0,37 ℃温浴保存2 h,再调回其初始pH 7.0,以副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)为指示菌,以未处理组作为对照,以抑菌活性为指标[19],抑菌活性的计算方法同1.2.4(1)。试验重复3次。
(3) 菌株H19产抗菌物质的紫外线稳定性测定:分别取10 mL无细胞发酵上清液,并置于10 mL离心管中距30 W紫外灯90 cm处照射处理10,20,30,40,50,60 min,以副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)为指示菌,以未处理组作为对照,以抑菌活性为指标[20],抑菌活性的计算方法同1.2.4(1)。试验重复3次。
1.2.5 菌株H19产抗菌物质的初步鉴定
(1) 抑菌物质的粗提及分子量的测定:在200 mL无细胞发酵上清液中缓慢加入硫酸铵至终饱和度为60%[21],用磁力搅拌器在4 ℃冰浴条件下缓慢搅拌约4 h后,置4 ℃冰箱中静置沉淀12 h[22],在4 ℃于10 000 r/min离心30 min,得到沉淀物和离心液,沉淀以原菌液1/10体积的25 mmol/L的磷酸盐缓冲液(pH 7.0)悬浮。将所得悬浮液分别选取孔径为1,3.5,7,8~14 kDa的透析袋进行透析,4 ℃条件下透析48 h,聚乙二醇20000浓缩至原体积[23],得到蛋白粗提液。以相同量的磷酸盐缓冲液为对照1,以未透析的悬浮液为对照2,测定粗提液的抑菌效果以及初步判断H19所产抑菌物质的分子量。试验重复3次。
利用低分子质量Marker(4.1~66.0 kDa共9条带),取1 kDa 透析袋处理的蛋白粗提液于垂直电泳槽中进行Tricine-SDS-PAGE蛋白质电泳[24]。电泳结束后,将胶切成两半,将带有Marker的一半胶进行考马斯亮蓝快速染色,另一半用灭菌的去离子水漂洗12 h后,小心铺在接有副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)的LB固体培养基上(1.0%琼脂),37 ℃培养12 h,与染色的一半作对比,判定抑菌物质的分子质量。试验重复3次。
(2) 粗提液对蛋白酶的敏感性:分别将胰蛋白酶、中性蛋白酶、胃蛋白酶、木瓜蛋白酶以及蛋白酶K配制成质量浓度均为4 mg/mL的母液,分别加入3.5 kDa透析袋处理的蛋白粗提液使各酶的终质量浓度为2 mg/mL[25],调节pH值至各酶最适作用pH值,以不加酶的3.5 kDa透析袋处理所得蛋白粗提液作为空白对照,37 ℃温浴保存2 h,再调节各酶解液pH值至7.0。以副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)为指示菌,采用打孔扩散法测定各酶解液抑菌活性。试验重复3次。
2 结果与分析
2.1 抗副溶血性弧菌枯草芽孢杆菌的筛选
从上海市东海采集的海水样品中分离得到菌株50株,并分别命名为H1~H50,初筛后有7株对副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)有抑菌活性,分别为菌株H1、H3、H4、H6、H12、H19、H21,将初筛得到的7株菌株进行复筛,并测定抑菌效果,结果见表1。结果显示,菌株H1和H12仅可抑制ATCC17802,菌株H4可抑制ATCC17802及R11,菌株H6和H21可抑制R11、ATCC17802以及ATCC19114,菌株H3和H19对这4种指示菌均有抑菌活性,但菌株H19的抑菌效果最强,且抑菌效果稳定。因此,选择菌株H19进行后续的试验。
2.2 菌株H19发酵液的抑菌谱测定
通过19株指示菌进行菌株H19抑菌物质的抑菌谱测定,其中包括常见的水产致病菌、主要的食源性致病菌以及酵母菌,由表2可以看出,菌株H19可抑制7株革兰氏阳性菌,9株革兰氏阴性菌,2株酵母菌,即既可抑制革兰氏阳性菌又可抑制大部分革兰氏阴性菌,且对革兰氏阳性菌抑菌效果强于革兰氏阴性菌,7株革兰氏阳性菌抑菌直径为(16.16±0.09)~(28.53±0.15) mm,9株革兰氏阴性菌的抑菌直径为(11.17±0.05)~(22.00±0.10) mm;仅对革兰氏阴性菌副溶血性弧菌(Vbrioparahaemolyticus,ATCC 33847)以及酿酒酵母(Saccharomycescerevisiae,H-1)无抑制作用。
2.3 菌株H19的鉴定
2.3.1 菌株H19的菌落形态 由图1可知,菌株H19经培养后,菌落形态为圆形,污白色,褶皱不透明,凸起,边缘不整齐;经革兰氏染色后,通过光学显微镜观察呈蓝色,菌株H19为革兰氏阳性菌,菌体呈杆状,符合枯草芽孢杆菌的形态特征。
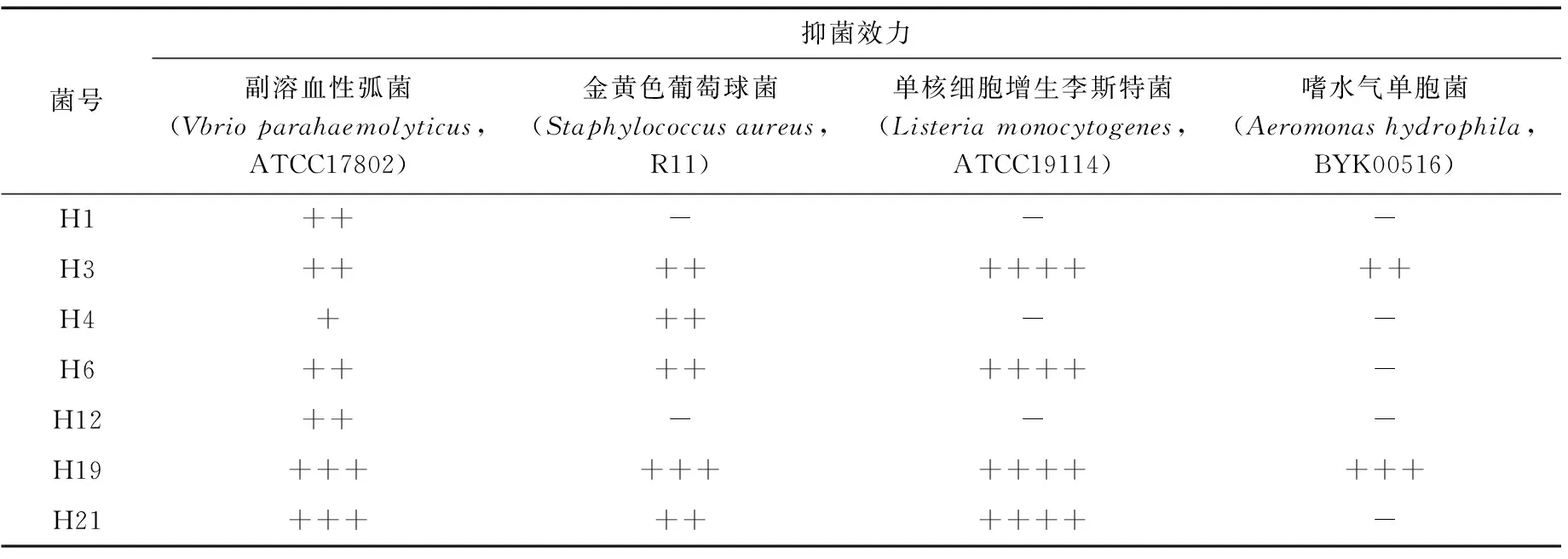
表1 海洋抑菌枯草芽孢杆菌对4种致病菌的抑菌情况†
† ++++代表抑菌圈直径>20 mm;+++代表抑菌圈直径15~20 mm;++代表抑菌圈直径10~15 mm;+代表抑菌圈直径<10 mm;-代表抑菌圈直径≤7 mm。

表2 枯草芽孢杆菌H19的抑菌谱†
† “G+”代表革兰氏阳性菌,“G-”代表革兰氏阴性菌。
图1 菌株H19 在营养琼脂平板上的菌落形态和营养肉汤液体培养基的显微形态(10×100)
Figure 1 Colonial morphology on NA plate and microscopic morphology (10×100) in NB culture medium of H19 strain
2.3.2 菌株H19的分子鉴定 提取菌株H19的总DNA,以菌株H19的基因组DNA为模板,采用细菌16S rDNA通用引物进行PCR扩增,得到特异性扩增产物长度为1 000~2 000 bp (图2),经生工生物工程(上海)股份有限公司测序,菌株H19的16S rDNA序列大小为1 172 bp,菌株H19的基因序列在GenBank上利用BLAST软件进行序列比对,结果显示,菌株H19与枯草芽孢杆菌KCTC 13429的相似度高达99%;结合菌株形态学特征、菌落形态学特征以及16S rDNA序列,结果该菌被鉴定为枯草芽孢杆菌,命名为BacillussubtilisH19,简称H19。将H19在EZBioCloud网站中进行比对,获得的相似度较高的基因序列利用MEGA 5.0软件构建菌株H19的系统发育树(Neighbor-Joining法),见图3。将得到的测序结果提交到GenBank数据库中,获得登陆号为:MG383451。
2.4 抑菌物质的理化性质
2.4.1 温度稳定性 由图4可以看出,菌株H19抑菌物质在-20~80 ℃时具有良好的稳定性,100 ℃处理10 min抑菌活性下降为320 AU/mL,仍保留50%的抑菌活性,因此,H19抑菌物质在中低温条件下具有良好的稳定性,但不耐高温,此温度特性为后续试验研究提供了数据支撑。
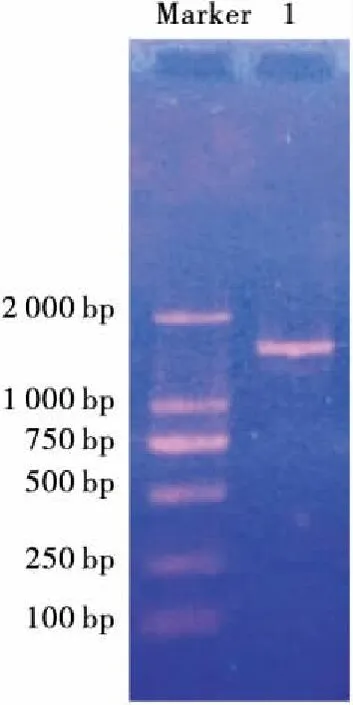
Marker. DL2000 1. 菌株H19的PCR产物

图3 基于16S rDNA基因序列构建的枯草芽孢杆菌H19系统发育树
Figure 3 Phylogenetic tree ofBacillussubtilisH19 constructed based on 16S rDNA gene sequence
2.4.2 酸碱稳定性 如图5所示,相对于对照组,菌株H19抑菌活性物质在pH 2.0~9.0时保持比较稳定的抑菌活性,但在pH 10.0~12.0时抑菌活性明显下降,仅保留微弱的活性,由此可见H19抑菌在酸性、中性以及弱碱性条件下稳定性较好且较稳定,而在强碱性条件下稳定性是极差的。因此为后续H19抑菌物质的分离纯化试验中所需pH条件提供了依据[26]。
2.4.3 紫外线稳定性 由图6可以看出,紫外线将菌株H19抑菌物质处理10~60 min对其抑菌活性均无影响,表明H19抑菌活性物质具有良好的紫外线稳定性。
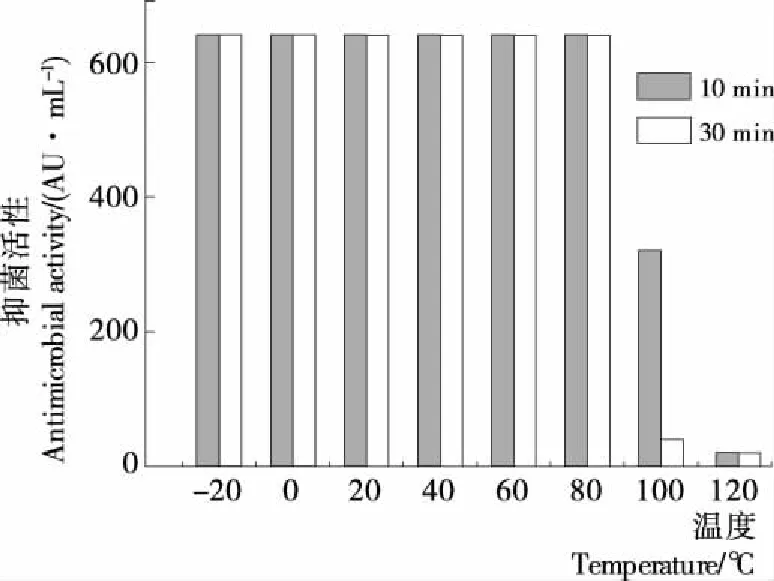
图4 温度对H19抑菌活性的影响
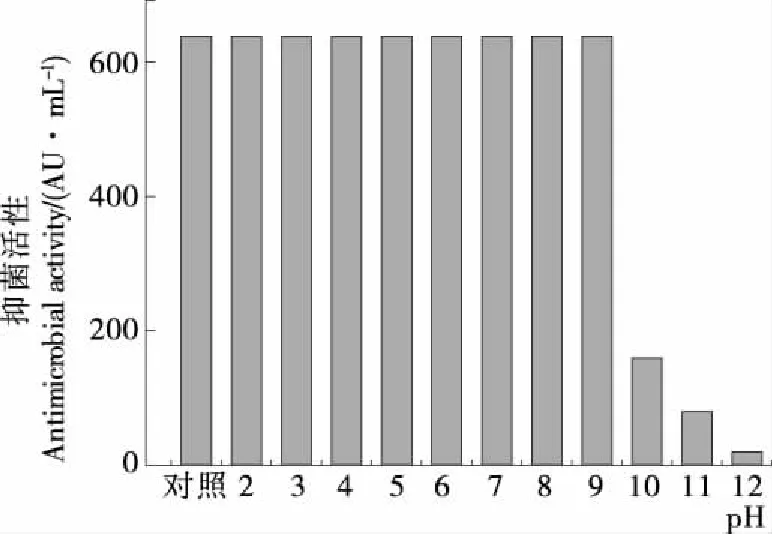
图5 pH对H19抑菌活性的影响
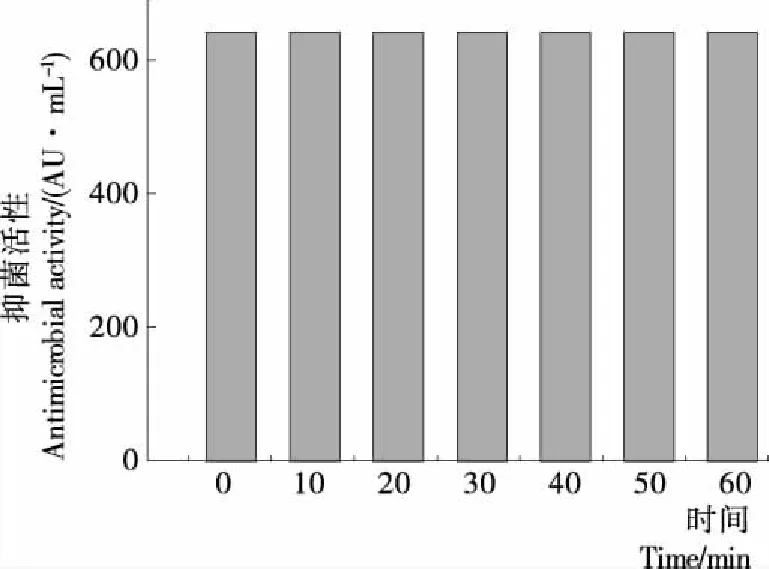
图6 紫外线对H19抑菌活性的影响
2.5 抑菌物质的初步鉴定
2.5.1 抑菌物质的粗提 为了验证枯草芽孢杆菌所产抑菌物质是否为抗菌肽,以及确定其分子量,抑菌物质经1,3.5,7,8~10 kDa透析袋处理后,得到4种粗提液,其抑菌活性分别为1 280,1 280,1 280,320 AU/mL(图7)。与未透析的悬浮液相比,用1,3.5,7 kDa透析袋处理抑菌活性均略有提高,但3组之间不存在明显差异,而当透析袋孔径增大至8~14 kDa 时,抑菌活性略有降低。表明前3种透析袋都能将主要抑菌成分有效截流,最后1种透析袋只能部分截留,初步判断抑菌物质的分子质量在7~8 kDa以及大于8 kDa。为防止粗提液中抗菌成分的遗漏,后续用1 kDa透析袋处理所得透析液进行下一步的Tricine-SDS-PAGE蛋白电泳原位抑菌试验。

图7 不同孔径透析袋处理对Bacillus subtilis H19 粗提液抑菌活性的影响
Figure 7 Effect of dialysis treatment on antibacterial activity of crude extract from fermentation supernatant ofBacillussubtilisH19 strain
2.5.2 H19抑菌物质分子量的测定 1 kDa透析袋处理的蛋白粗提液经过Tricine-SDS-PAGE分析,结果见图8。在考马斯亮蓝染色后的电泳胶中可以看出有5条蛋白条带,通过在VbrioparahaemolyticusATCC17802的LB固体培养基得到的2条抑菌条带位置与这5条蛋白条带进行对比可知,H19粗提物中有抑菌活性的蛋白质分子量在6.5~9.5 kDa以及27.0~35.0 kDa,同时验证了2.5.1的结论。
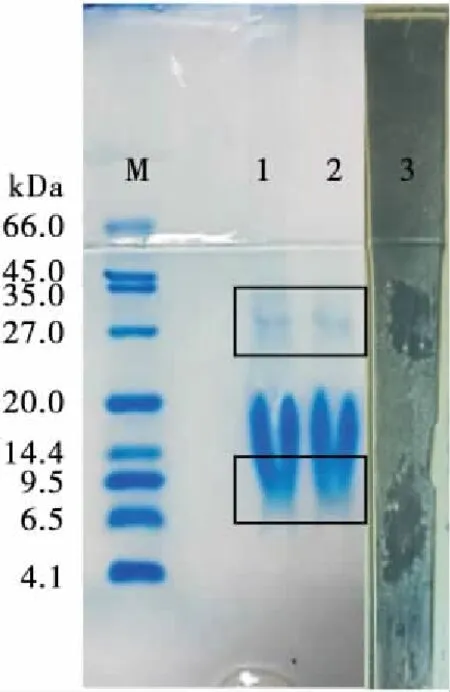
M. 蛋白质分子质量标准 1、2. 经过考马斯亮蓝染色的2条平行样品条带 3. 副溶血性弧菌(Vbrioparahaemolyticus,ATCC17802)平板上的抑菌活性条带
图8 Tricine-SDS-PAGE分析及电泳后抑菌活性的测定
Figure 8 Tricine-SDS-PAGE analysis and detection of antibacterial activity after Tricine-SDS-PAGE
枯草芽孢杆菌所产抗菌肽主要分为两大类:核糖体途径肽和非核糖体途径肽,核糖体途径肽主要包括subtilin、ericin、mersacidin、sublancin、bacillocin、subtilosin和TasA等,非核糖体途径肽主要包括surfacrin、iturin和fengycin三大抗菌脂肽[27],其中细菌素mersacidin[28]、subtilinUK4[29]、ericinA[30]、sublancin168[31]、bacillocin22[32]、subtilosinA[33]等的分子量为1.8~3.8 kDa,大分子抗菌蛋白TasA分子量大小为31.0 kDa[34],3大抗菌脂肽分子量为1.0~1.5 kDa[35],说明细菌素H19不在报道的枯草芽孢杆菌产生的抗菌肽范围之内。因此,初步判断菌株H19产生的抑菌物质可能为2种新型抗菌肽。
2.5.3 粗提液对蛋白酶的敏感性 由2.5.2可知H19抑菌物质的分子量在6.5 kDa以上,因此选择经3.5 kDa透析袋处理所得的粗提液进行蛋白酶敏感性试验,将此粗提液用5种不同蛋白酶处理,检测其抑菌活性。如图9所示,经木瓜蛋白酶、蛋白酶K处理后,菌株H19粗提液的抑菌活性完全消失,而用胰蛋白酶处理剩余64.61%的活性,用胃蛋白酶处理剩余83.07%的活性,对中性蛋白酶不敏感,表明H19抑菌物质为蛋白质性质。
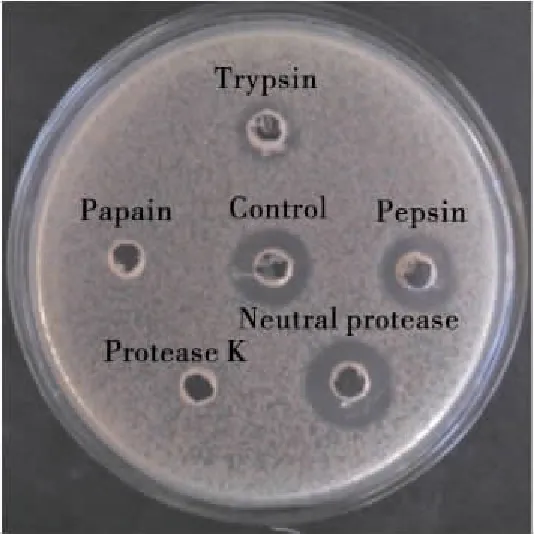
图9 蛋白酶处理对Bacillus subtilis H19 粗提液抑菌活性的影响
Figure 9 Effect of protease treatment on antibacterial activity of crude extract from fermentation supernatant ofBacillussubtilisH19 strain
3 结论
本研究从上海市东海海水样品中筛选出既可抑制水产致病菌又对食源性致病菌有抑制作用、产抑菌物质的枯草芽孢杆菌。菌株H19对绝大多数指示菌具有较好的抑菌作用,相比于Stein等[31]和孙珊等[37]报道的枯草芽孢杆菌产抑菌物质的抑菌谱,菌株H19抑菌物质的抑菌谱更广,对供试的所有革兰氏阳性菌株均具有较好的抑菌活性,对除副溶血性弧菌(Vbrioparahaemolyticus,ATCC33847)以外的所有供试革兰氏阴性菌株也都具有较好的抑菌活性,且对革兰氏阳性菌抑菌效果强于革兰氏阴性菌,可见,H19产生的抑菌活性物质具有广谱的抑菌作用。H19所产抑菌物质具有较好的热稳定性,在100 ℃处理10 min后仍保留50%的抑菌活性,在pH 2.0~9.0时仍保持较强的抑菌活性,H19抑菌活性物质具有良好的紫外线稳定性,在紫外线下照射10~60 min 对抑菌活性物质的抑菌效果均无影响。通过将H19抑菌物质粗提得粗提液,将粗提液进行5种蛋白酶处理以及Tricine-SDS-PAGE电泳原位抑菌试验,初步鉴定此粗提液为蛋白质性质,分子量在6.5~9.5 kDa以及27.0~35.0 kDa,由于该抑菌物质有别于已报道的抗菌肽分子量,推断可能为2种新型细菌素。
本研究将会继续对H19抑菌活性物质进行分离、纯化和结构鉴定,进一步确定H19所产细菌素的种类以及氨基酸成分等。
