化学作用力对皮蛋蛋黄凝胶形成的影响
2018-08-01艾民珉汤婷蒋爱民杨益嘉游玉婷
艾民珉汤 婷蒋爱民杨益嘉游玉婷
(1. 华南农业大学食品学院,广东 广州 510642;2. 畜禽产品精准加工与安全地方联合工程研究中心,广东 广州 510642;3. 广东省畜禽产品加工工程技术研究开发中心,广东 广州 510642;4. 广东省食品质量安全重点实验室,广东 广州 510642)
皮蛋是中国传统的生食蛋制品之一,具有色泽美观、风味浓郁、营养丰富等特点[1-2]。皮蛋的形成主要是利用氢氧化钠与蛋白质等成分作用,使其发生物理化学变化形成凝胶状态[3-5]。传统腌制工艺里会添加氧化铅,而铅的作用目前比较认可的说法是“堵孔”学说[6],即铅能与蛋白质等生成难溶物沉积于蛋壳和壳膜表面阻止氢氧化钠进一步进入蛋内部,避免蛋清“碱伤”现象的发生[7]。但是铅会在人体内积累,对人体健康造成危害,尤其对婴幼儿智力发育有不良影响[8]。故近年来,学者对于皮蛋无铅工艺研究较多[9-11],比如采用添加锌、铜等来替代铅的作用,同时与氢氧化钠等混合制成碱液,即清料法腌制液,解决了传统腌制泥中重金属超标和腌制出的皮蛋品质不稳定等问题。
蛋黄主要由33.8%的脂肪和14.5%的蛋白质[12]组成,也是皮蛋的主要构成部分。蛋清凝胶是依靠离子键与二硫键作用形成球状蛋白质聚集体,而蛋黄凝胶的形成受水分和盐分的影响[13]。目前,对于皮蛋中蛋清凝胶的形成机理及改性研究较多,也较为成熟,但对于蛋黄凝胶形成机理及金属离子调控等研究较少且仍未阐明[1]。本试验采用清料法腌制皮蛋,对皮蛋腌制过程中蛋黄内部化学作用力和凝胶强度进行了监测,旨在为蛋黄凝胶形成机理的探究及皮蛋品质控制提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜鸭蛋:广州市天河区长湴市场;
8-苯胺基-1-萘磺酸铵(ANS):分析纯,上海科顺生物科技有限公司;
5,5′-二硫代双(2-硝基苯甲酸)(DTNB):分析纯,北京索莱宝科技有限公司。
1.2 仪器设备
紫外分光光度计:UV-2600型,日本岛津公司;
荧光分光光度计:RF-5301PC型,日本岛津公司;
均质机:HPH2000/4型,德国IKA公司;
傅里叶变换红外光谱仪:Vertex70型,德国Bruker公司;
高速冷冻离心机:Eppendorf 5804R型,德国艾本德科技公司;
物性分析仪:TA.XT.Plus 型,英国SMS公司。
1.3 试验方法
1.3.1 工艺流程 选取65~75 g新鲜鸭蛋数枚,用流动水冲洗表面脏物,晾干后备用。按照以下配方配制腌制液:4.5% NaOH,3.5%食盐,0.1% CuSO4,0.1% FeSO4,0.1% ZnSO4,0.1% 红茶末。将晾干后的新鲜鸭蛋浸泡于腌制液中,腌制4周后出缸,流水冲净鸭蛋表面残留碱液后晾干,用石蜡包裹皮蛋,后熟2周。分别在腌制7,14,21,28,35,42 d时随机选取10枚进行分析测试。
1.3.2 凝胶强度测定 使用直径为50 mm的圆柱型探头P/50,对每个样品进行单轴向压缩,压缩距离4 mm,触发力4.0 g。测试前速0.5 mm/s,测试速度0.5 mm/s,测试后速0.5 mm/s。
1.3.3 表面疏水性的测定 称取1 g皮蛋黄,加入10 mL pH 7.0的磷酸缓冲液,均质后于4 000×g离心10 min,取上清液备用。将离心后的样品上清液蛋白质浓度稀释为0.01 mg/mL。取4 mL稀释液,添加20 μL 8 mmol/L的ANS为荧光探针,激发波长为390 nm,扫描范围为400~600 nm。
1.3.4 傅里叶转换红外线光谱分析 精确称取100 mg KBr和1.2 mg冷冻干燥后的样品,用玛瑙研钵研磨至没有光泽后压片。将压好的样品置于全反射附件(ATR)上进行全波段(4 000~600 cm-1)扫描,扫描次数为16次,分辨率为4 cm-1。以相应未添加样品的KBr为背景,扣除背景后得到红外光谱图。利用OMNIC 6.0数据处理软件和Peakfit 4.12 软件对数据进行处理,拟合后使残差<0.01,根据各积分面积计算二级结构所占百分含量。
1.3.5 游离巯基和总巯基的测定 参考文献[14]。
1.3.6 离子键、氢键、疏水相互作用和二硫键的测定 参考文献[15]。
1.3.7 凝胶电泳(SDS-PAGE) 凝胶电泳使用5%和12%分离叠加凝胶。称取3 g蛋黄加入27 mL 5% SDS,并于12 000 r/min 的匀浆器中快速分散1 min,将匀浆在85 ℃下加热1 h后,于7 500×g离心10 min。用样品处理液将蛋白质浓度调整到1 mg/mL,取20 μL进行电泳,凝胶电泳单元的恒定电压为200 V/板,凝胶的染色用考马斯亮蓝R-250(0.125%)、25 mL/100 mL 甲醇和10 mL/100 mL 醋酸。脱色用40 mL/100 mL 甲醇和10 mL/100 mL 醋酸。
1.3.8 统计分析 运用Origin 8.5和SPSS 16.0统计软件进行多重比较、LSD检验以及作图。
2 结果与分析
2.1 蛋黄凝胶强度的变化
由图1可知,腌制过程中蛋黄的凝胶强度变化显著(P<0.05),而在后熟期间变化不显著(P>0.05)。腌制过程中氢氧化钠逐渐透过蛋壳与蛋壳膜进入蛋清和蛋黄内,使得蛋清呈透明凝胶状,而蛋黄逐渐呈外部凝胶、溏心黏稠状。氢氧化钠与蛋黄中油脂发生皂化反应使得表面蛋黄开始凝固,同时蛋白质发生碱变性,生成的变性蛋白质之间发生交联,使得原本柔软的外层蛋黄呈凝胶状,凝胶强度在腌制期间显著增加。皮蛋出缸后,没有氢氧化钠的持续渗透,且水分逐渐散失,使得蛋黄凝胶强度在28~35 d时显著增加(P<0.05),而后熟期间皮蛋内部微环境趋于稳定,故在后熟过程中凝胶强度变化不明显(P>0.05)。
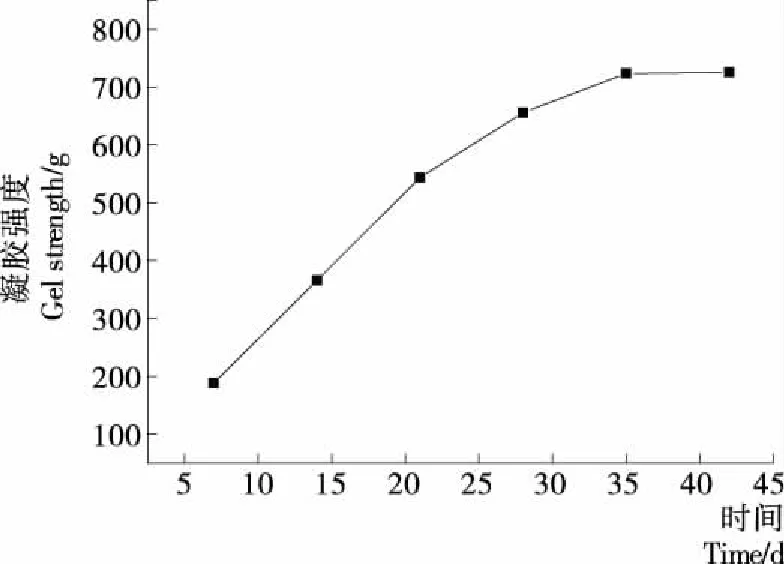
图1 凝胶强度的变化
2.2 蛋黄表面疏水性的变化
ANS可用作荧光标记来反映蛋白质的表面疏水特性及监测蛋白质的变性过程,其常与阴离子蛋白结合[16]。皮蛋在腌制和后熟过程中的外源性荧光光谱见图2。外层蛋黄和溏心蛋白质的荧光峰值随腌制时间的延长逐渐降低,其中外层蛋黄峰值在14~42 d时下降显著(P<0.05),而溏心峰值在7~14 d时下降显著(P<0.05),在14~42 d时下降不明显(P>0.05),说明外层蛋黄在14~28 d时发生了明显的变性,而溏心在整个腌制和后熟过程中的蛋白质变性较缓慢。氢氧化钠的渗入,改变了酸碱平衡环境,变性后的蛋白质结构逐渐变得有序,空间结构变得可延伸,使得更多极性基团暴露。极性基团以非共价键的方式与渗透的阴离子及蛋白质相结合,导致非极性基团和阴离子增加,荧光强度也相应增加。而蛋清凝胶的形成使得氢氧化钠渗透进入蛋黄的速率下降,凝固的外层蛋黄进一步减缓了氢氧化钠渗透进入溏心的速率,说明蛋黄蛋白质的变性会使表面疏水性下降。同时,溏心蛋白质的荧光峰值是外层蛋黄的3~10倍,说明外层蛋黄蛋白质比溏心蛋白质变性严重。
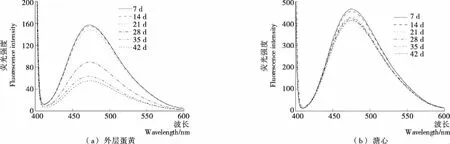
图2 表面疏水性的变化
2.3 FTIR结果分析
2.4 蛋黄腌制过程中游离巯基与总巯基的变化
皮蛋在腌制和后熟过程中游离巯基和总巯基的变化见图3。外层蛋黄的游离巯基下降缓慢(P>0.05),溏心的游离巯基和总巯基均下降显著(P<0.05),而外层蛋黄总巯基呈先增加后下降趋势,在第14天时达到最大值(32.34 μmol/g·Pro)。郑华等[20]曾报道新鲜蛋黄的巯基含量为57 μmol/g·Pro。说明蛋黄在腌制0~7 d时,巯基含量大幅度下降,而在腌制和后熟过程中游离巯基变化不明显,原因可能是外层蛋黄蛋白质的变性等因素使得巯基在前期转化成了二硫键。外层蛋黄总巯基含量比游离巯基平均高3.44 μmol/g·Pro,而溏心总巯基含量比游离巯基高0.29 μmol/g·Pro,表明外层蛋黄中分子内部巯基的数量要比溏心多。蛋黄中的蛋白质是与不同质量脂质结合的磷蛋白,共有316种,占比较高的有低密度脂蛋白(65%)、高密度脂蛋白(16%)、卵黄球蛋白(10%)和卵黄高磷蛋白(4%)[21]。其中高密度脂蛋白能在高碱度下形成聚集体但并不是依靠巯基或二硫键的作用,而二硫键是球形蛋白质形成凝胶的主要作用力,表明蛋黄中蛋白质巯基的变化主要来自于卵黄球蛋白[22-23]。蛋黄接触氢氧化钠的时间晚于蛋清,变性后的卵黄球蛋白快速通过化学键与其它蛋白质发生交联而形成凝胶,进一步渗透的氢氧化钠与溏心中油脂发生皂化反应,不同等电点的蛋黄蛋白质逐渐变性聚集转变为外层蛋黄凝胶,形成了皮蛋蛋黄色层分明的特点。

表1 二级结构的变化
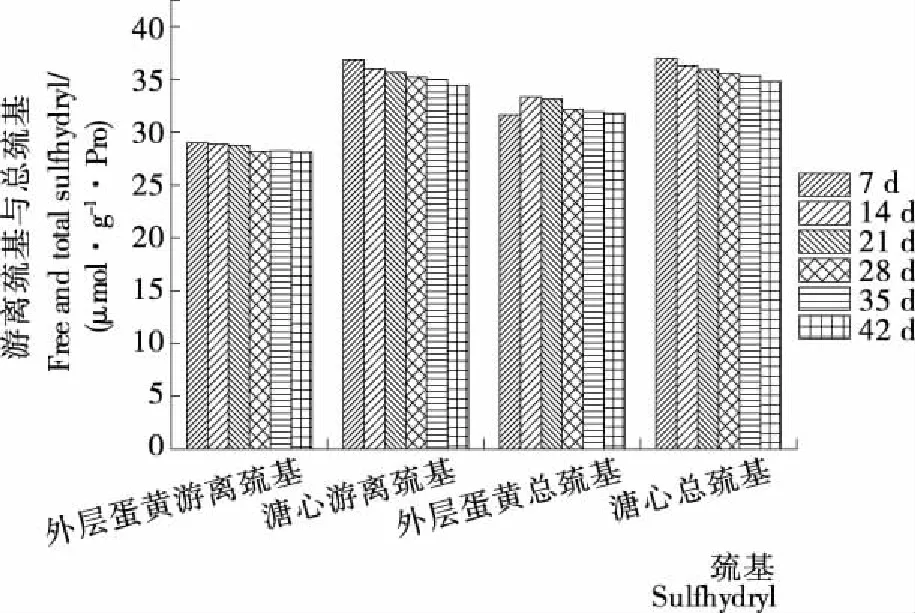
图3 腌制和后熟过程中蛋黄游离巯基和总巯基的变化
2.5 蛋黄离子键、氢键、疏水相互作用和二硫键的变化
蛋黄在不同腌制和后熟期间的化学作用力变化见图4。由图4可知,外层蛋黄中的SA和SD显著增加(P<0.05),溏心中的SA、SC和SD占比较大,表明外层蛋黄分子间作用力主要是离子键和二硫键,而溏心分子间作用力主要是离子键、疏水相互作用和二硫键。
离子键主要受负电荷的影响,能阻碍凝胶的形成,但外层蛋黄形成了凝胶,且其比例显著增加(P<0.05)。在腌制前期氯化钠较氢氧化钠渗透速度快,外层蛋黄表面正电荷较多,而后期氯化钠渗透速率下降及蛋白质变性使得表面覆盖较多负电荷,离子键含量增加。溏心离子键占比较大且呈先增大后降低趋势,在21 d时达到最大值66.41%。表明在前21 d时由于水分的降低以及氢氧化钠的渗入使得蛋白质表面负电荷增加,而后期氯化钠含量的增加降低了表面负电荷的相互作用,离子键降低。氢键是维持蛋白质二级结构的主要作用力,疏水相互作用是维持蛋白质三级结构的主导作用力,它对蛋白质结构的稳定和功能性质具有重要的作用。有研究[24]表明蛋白质的疏水性对蛋白质分子的凝聚作用有显著影响。外层蛋黄的SB与SC占比较小,说明氢氧化钠的渗透造成多肽链末端官能团被电离,使得氢键和疏水相互作用占比较小。溏心的SB下降显著(P<0.05),SC增加明显(P<0.05),表明溏心蛋白质在腌制过程中逐渐发生变性而聚集形成凝胶,增加凝胶强度。二硫键是形成凝胶的重要化学键,也是维持蛋白质空间结构的重要次级键,当蛋白质受到外界环境的影响时,二硫键会转化为巯基,从而破坏蛋白SA表示蛋黄在溶剂A中的溶解度,代表离子相互作用;SB表示蛋黄在溶剂A与B的溶解度之差,代表氢键;SC表示蛋黄在溶剂B与C的溶解度之差,代表疏水相互作用;SD表示蛋黄在溶剂C与D的溶解度之差,代表二硫键[13]质的空间结构。外层蛋黄和溏心的SD占比均较大,变化也显著(P<0.05),说明在强碱作用下蛋黄蛋白质在腌制和后熟过程中发生了变性,多肽链之间的巯基转化为二硫键,促进了蛋白质之间发生交联并形成凝胶,提高了凝胶强度。
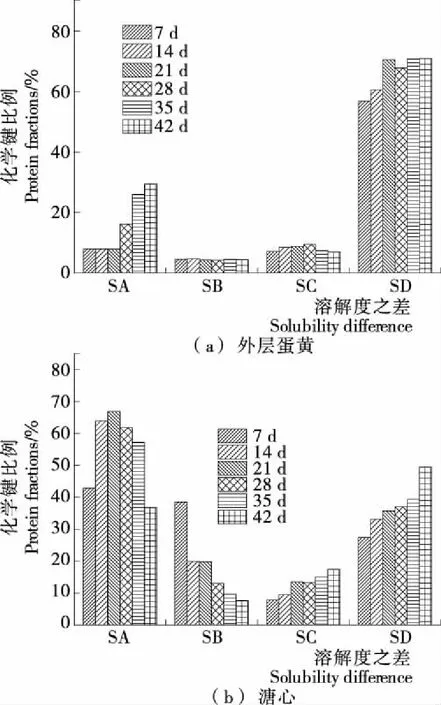
图4 化学作用力的变化
Figure 4 The changes of intermolecular interaction
2.6 SDS-PAGE分析
由图5可知,标准蛋白的分子量为14.4~97.2 kDa。以标准蛋白的迁移率作为对照,根据样品的相对迁移率,来判断不同腌制时期蛋黄蛋白质的变化。对比各样品的电泳结果发现,外层蛋黄蛋白质的主要条带集中在43.0 kDa附近,且条带数量从3条减少至1条,溏心蛋白质在7 d时主要有7条,碱浓度的增加使得部分溏心蛋白质分解,条带数量减少。外层蛋黄和溏心凝胶电泳中均在43.0 kDa附近存在条带,该蛋白质可能是高密度脂蛋白,说明与其它蛋白质相比,高密度脂蛋白能在碱性环境中稳定存在。在氢氧化钠的作用下,蛋黄脂蛋白被破坏,蛋白质与油脂分离,油脂与碱发生皂化反应使得外层蛋黄开始凝固,蛋白质分解成小片段多肽,这些多肽通过内部化学键发生交联包裹水分而富有弹性,凝胶强度增加。蛋黄蛋白质的电泳结果与其二级结构的变化一致。

M. 标准蛋白 外. 外层蛋黄 内. 溏心
3 结论
研究皮蛋加工过程中蛋黄内部化学作用力及其凝胶强度的变化,对揭示蛋黄凝胶的形成机理具有重要意义。结论如下:① 外层蛋黄蛋白质的变性程度强于溏心蛋白质,且其表现出的蛋白质表面疏水性显著下降,影响着蛋黄内蛋白质的聚集;② 外层蛋黄凝胶的形成主要依靠离子键和二硫键的作用,氢键和疏水相互作用贡献较小;③ 溏心逐渐转变为外层蛋黄凝胶,形成色层分明的特点,增强了蛋黄凝胶强度,其中疏水相互作用和二硫键起主要作用,离子键和氢键作用显著减弱;④ 皮蛋中大部分蛋黄蛋白质分解成小片段多肽,比较稳定的蛋白质可能是高密度脂蛋白。本试验对蛋黄的形成机理进行了讨论,但仅监测了各种化学作用力对蛋黄凝胶形成的影响,对于蛋黄内部各种成分对其凝胶形成的影响还有待进一步研究。
