海南芒果蒂腐病菌对吡唑醚菌酯的抗药性测定
2018-08-01陈芷岑林晓翠
贺 瑞, 赵 磊, 符 瑞, 陈芷岑, 林晓翠, 杨 叶*
(1. 海南大学热带农林学院, 海口 570228; 2. 海南医学院, 海口 571101)
芒果MangiferaindicaL.是著名的热带水果,是热带亚热带重要的经济作物。海南是芒果的主要产区,芒果产量和种植面积皆位居全国首位。芒果蒂腐病是芒果采后最为严重的病害之一,可导致果实迅速腐烂,造成芒果在贮藏、运输环节的巨大经济损失,严重制约芒果产业的发展[1-2]。可可球二孢Botryodiplodiatheobromae是引起芒果蒂腐病的主要病原菌[3-5],该菌具有潜伏侵染特性,通常在幼果期侵入并潜伏于果实中,直到芒果果实成熟时才在果实上表现症状,随后迅速扩展。由于该病原菌在大田期间就已侵入芒果,而芒果种植期间大量频繁使用杀菌剂防治各种病害,对芒果蒂腐病病原菌造成了很大的药剂选择压力[6],使得该病菌面临产生严重的抗药性风险。
甲氧基丙烯酸酯类杀菌剂通过与病原菌细胞线粒体中的cytb和c1复合体Qo部位结合,抑制线粒体的电子传递,抑制能量生成,达到杀菌的目的。甲氧基丙烯酸酯类杀菌剂具有广谱性和极高的杀菌活性,对环境也比较安全[7]。1996年该类杀菌剂开发应用后不久小麦白粉病便对其产生了抗性,随后在叶枯病的防治中也出现了严重问题。目前,抗药性已经成为甲氧基丙烯酸酯类杀菌剂的一个重要问题。2009年及2014年先后有研究者报道芒果蒂腐病病菌对甲氧基丙烯酸酯类杀菌剂醚菌酯、嘧菌酯及吡唑醚菌酯等杀菌剂产生抗药性[6,8]。目前在芒果生产上,甲氧基丙烯酸酯类杀菌剂尤其是吡唑醚菌酯的使用量非常大。本研究2016年从海南芒果主要产区采收生理成熟的果实,待其后熟后取蒂腐病病果进行病原菌分离、纯化和鉴定,并测定了分离菌株对吡唑醚菌酯的抗药性,旨在进一步明确芒果蒂腐病病菌对吡唑醚菌酯的抗性水平,为海南芒果蒂腐病的科学防治提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试药剂
96%吡唑醚菌酯原药由海南正业中农高科股份有限公司提供,用丙酮溶解,然后用0.2%吐温-80溶液定容,配制成2.5×104mg/L的母液。99%水杨羟肟酸由上海麦克林生化科技有限公司提供,用丙酮溶解并配制成5×104mg/L的母液,于4℃冰箱中保存,备用。
1.1.2 供试菌株
供试菌株为本实验室分离、鉴定的芒果蒂腐病菌Botryodiplodiatheobromae菌株。
1.2 试验方法
1.2.1 供试菌株的分离、纯化、鉴定与保存
将从海南儋州、昌江、乐东、东方、三亚及陵水6个芒果主要产区采回的芒果置于室温贮藏,待其后熟后挑选感染芒果蒂腐病的果实,采用组织分离法分离病原菌。从病果沿病斑边缘取3 mm×3 mm的小块若干,浸入0.1%升汞酒精消毒30 s,无菌水清洗3次后置于PDA平板上,待菌落长出后,从边缘取菌丝转移到新的PDA平板上进行纯化,观察菌落的形态、颜色等。培养20 d后在显微镜下根据分生孢子形态进行鉴定,按柯赫氏法则回接芒果确认为致病菌后将其转移到PDA斜面上培养7 d,保存在4℃下备用。
1.2.2 芒果蒂腐病菌B. theobromae对吡唑醚菌酯的抗药性检测
采用区分剂量法[9]测定95株芒果蒂腐病菌株对吡唑醚菌酯的抗药性。以不含药的PDA培养基为空白对照,加等量丙酮的PDA培养基为溶剂对照,吡唑醚菌酯的浓度为10 mg/L(质量浓度)。为降低旁路呼吸途径对药剂的影响,供试培养基中加入终浓度为50 mg/L的水杨羟肟酸。每处理设置3个重复。置于28℃培养箱中培养36 h 和48 h 后用十字交叉法测量菌落直径,并计算菌丝生长抑制率和校正后的生长抑制率(消除丙酮对菌丝生长的影响)。统计敏感、抗性菌株的发生频率。参照Kim等和乔广行等[10-11]的文献,将在含10 mg/L吡唑醚菌酯的PDA平板上菌落直径小于空白对照的40%的菌株判定为敏感菌株;菌落直径大于等于空白对照的40%的菌株判定为抗性菌株。
生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
1.2.3 吡唑醚菌酯对芒果蒂腐病菌的毒力测定
采用系列稀释法。在抗药性检测的基础上,分别配制吡唑醚菌酯终浓度为0.69 、2.06、6.17、18.52、55.56、166.67、500 mg/L的含药培养基,并在培养基中加入终浓度为50 mg/L的水杨羟肟酸。根据1.2.2的结果,去除部分遗传性状不稳定、来源及生长状况完全相同的菌株,最终选取57株菌作为供试菌株进行毒力测定,供试菌株在PDA上平板上培养3 d后用5 mm 直径打孔器取菌饼,分别接种到7个不同浓度梯度的含药培养基上,以不含药的PDA培养基为对照,每浓度设置3个重复,置于28℃培养箱中培养,于36 h和48 h用十字交叉法测量菌落直径,并根据药剂浓度对数和菌丝生长抑制率用DPS和Microsoft Excel 2013软件计算出各菌株的毒力回归方程、EC50及95% 置信区间。由各菌株所测的EC50构建吡唑醚菌酯对蒂腐病菌EC50的正态分布图。
根据测定结果及相关参考文献,本研究将蒂腐病菌对吡唑醚菌酯的抗性等级按以下标准划分:EC50≤10 mg/L的为敏感菌株,10
2 结果与分析
2.1 病原菌分离
从具有典型蒂腐病症状的芒果中分离的蒂腐病病菌大部分来自于昌江、乐东、三亚、陵水等市县,从昌江县分离菌株27个,乐东县分离菌株19个,三亚市分离菌株25个,陵水县分离菌株18个,东方市分离菌株3个和儋州市分离菌株3个。
2.2 芒果蒂腐病菌B. theobromae对吡唑醚菌酯的抗药性检测
采用区分剂量法对95个菌株进行抗药性测定的结果表明,在含10 mg/L吡唑醚菌酯的PDA平板上有39个菌株菌落直径小于空白对照的40%,判定为敏感菌株;有56个菌株菌落直径大于空白对照的40%,判定为抗性菌株,抗性菌株发生频率为58.95%(表1)。
海南不同芒果产区均检测到抗性菌株,各地抗性菌株的发生频率差异不大,抗性频率在52.63%~66.67%之间。其中,昌江、乐东、三亚及陵水4个芒果产区的抗性频率比较一致,说明海南省芒果蒂腐病病菌对吡唑醚菌酯普遍产生了抗药性,且各地区之间差异不大。另外,东方及儋州地区分离出的菌株数量太少,尚不能完全代表该地区的抗药性水平。
表1海南芒果蒂腐病菌对吡唑醚菌酯的抗性频率
Table1ResistancefrequenciesofBotryodiplodiatheobromaeisolatestopyraclostrobininHainanProvince

产区Region菌株总数/株Testedisolate 敏感菌株/株Susceptibleisolate抗性菌株/株Resistantisolate抗性频率/%Resistancefrequency昌江 Changjiang27121555.56 乐东 Ledong1991052.63 三亚 Sanya2591664.00 陵水 Lingshui1871161.11 东方 Dongfang31266.67 儋州 Danzhou31266.67 合计 Total 95395658.95
2.3 吡唑醚菌酯对芒果蒂腐病菌的毒力测定
吡唑醚菌酯对供试的57个菌株的EC50在3.12~1 525.43 mg/L之间(表2)。供试菌株中,5株敏感菌株的平均EC50为5.39 mg/L;低抗菌株有14株,平均EC50为45.34 mg/L;中抗菌株有18株,平均EC50为144.72 mg/L;20株高抗菌株的平均EC50为514.46 mg/L,高抗菌株的平均EC50是敏感菌株的95.45倍。其中2个菌株YZHJ90402和YCJH70401的EC50甚至超过1 000 mg/L。抗性水平在10~100倍的菌株有33个,占总菌株数的57.89%,大于100倍的菌株有13个,占总数的22.81%,而抗药性最高的菌株的抗性水平是最敏感菌株的488.92倍。
表2吡唑醚菌酯对57株蒂腐病菌的毒力
Table2Toxicityof57BotryodiplodiatheobromaeisolatestopyraclostrobininHainanProvince
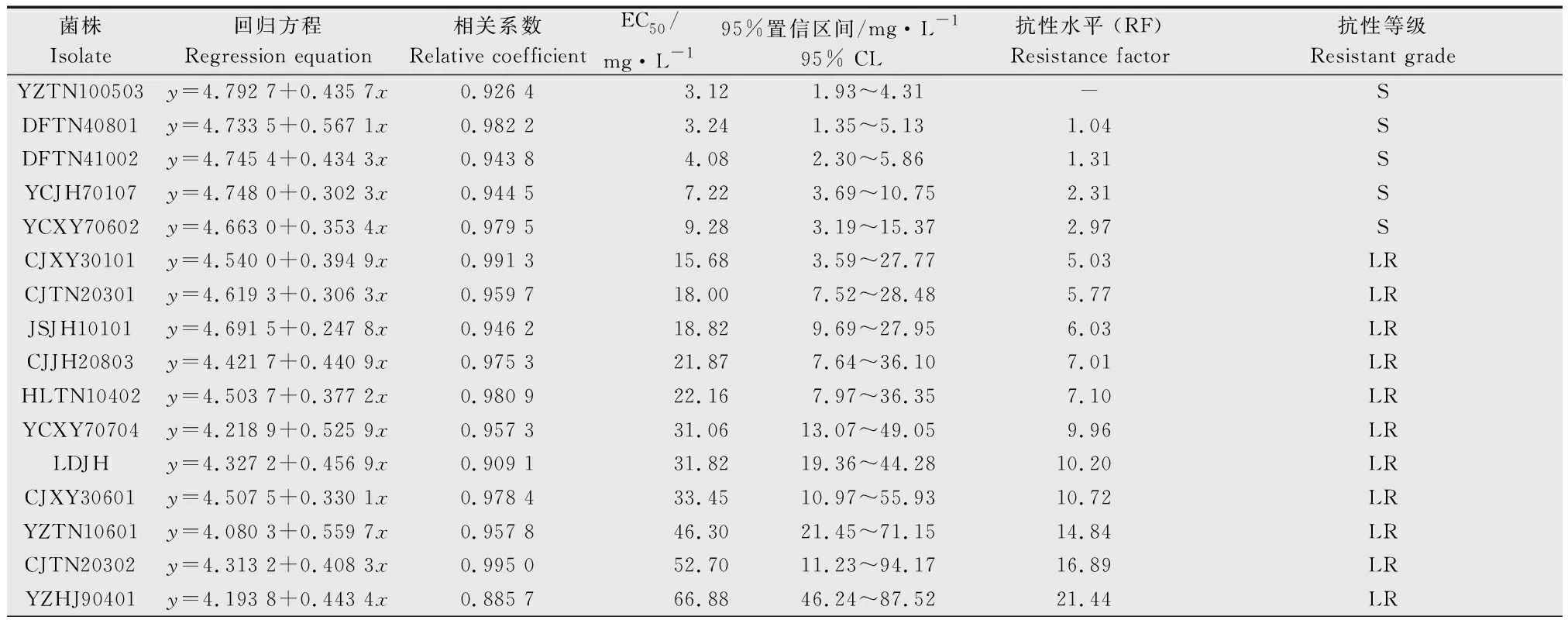
菌株Isolate回归方程Regression equation相关系数Relative coefficientEC50/mg·L-195%置信区间/mg·L-195% CL抗性水平 (RF)Resistance factor抗性等级Resistant gradeYZTN100503y=4.792 7+0.435 7x0.926 43.121.93~4.31-SDFTN40801y=4.733 5+0.567 1x0.982 23.241.35~5.131.04SDFTN41002y=4.745 4+0.434 3x0.943 84.082.30~5.861.31SYCJH70107y=4.748 0+0.302 3x0.944 57.223.69~10.752.31SYCXY70602y=4.663 0+0.353 4x0.979 59.283.19~15.372.97SCJXY30101y=4.540 0+0.394 9x0.991 315.683.59~27.775.03LRCJTN20301y=4.619 3+0.306 3x0.959 718.007.52~28.485.77LRJSJH10101y=4.691 5+0.247 8x0.946 218.829.69~27.956.03LRCJJH20803y=4.421 7+0.440 9x0.975 321.877.64~36.107.01LRHLTN10402y=4.503 7+0.377 2x0.980 922.167.97~36.357.10LRYCXY70704y=4.218 9+0.525 9x0.957 331.0613.07~49.059.96LRLDJHy=4.327 2+0.456 9x0.909 131.8219.36~44.2810.20LRCJXY30601y=4.507 5+0.330 1x0.978 433.4510.97~55.9310.72LRYZTN10601y=4.080 3+0.559 7x0.957 846.3021.45~71.1514.84LRCJTN20302y=4.313 2+0.408 3x0.995 052.7011.23~94.1716.89LRYZHJ90401y=4.193 8+0.443 4x0.885 766.8846.24~87.5221.44LR
续表2Table2(Continued)
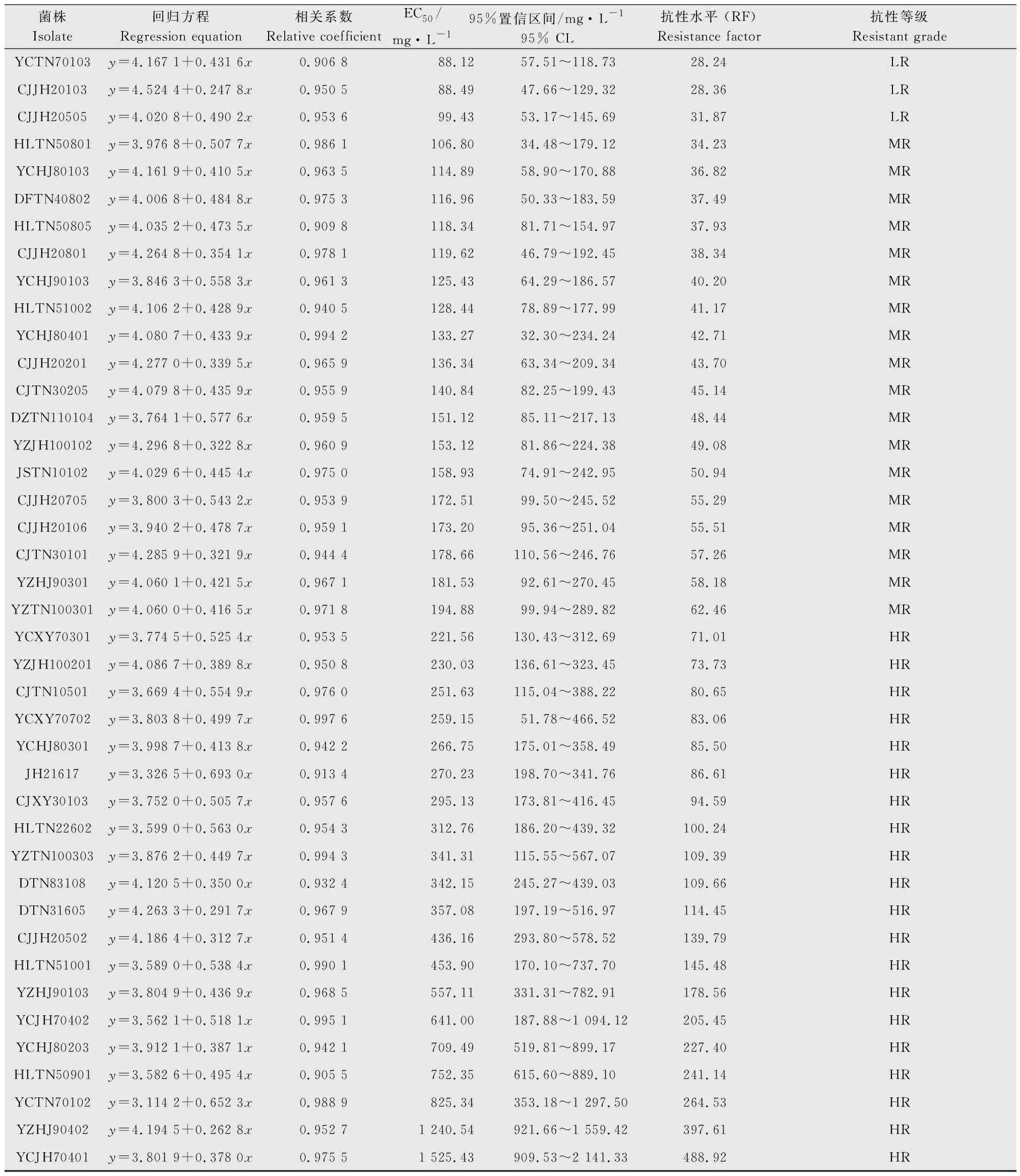
菌株Isolate回归方程Regression equation相关系数Relative coefficientEC50/mg·L-195%置信区间/mg·L-195% CL抗性水平 (RF)Resistance factor抗性等级Resistant gradeYCTN70103y=4.167 1+0.431 6x0.906 888.1257.51~118.7328.24LRCJJH20103y=4.524 4+0.247 8x0.950 588.4947.66~129.3228.36LRCJJH20505y=4.020 8+0.490 2x0.953 699.4353.17~145.6931.87LRHLTN50801y=3.976 8+0.507 7x0.986 1106.8034.48~179.1234.23MRYCHJ80103y=4.161 9+0.410 5x0.963 5114.8958.90~170.8836.82MRDFTN40802y=4.006 8+0.484 8x0.975 3116.9650.33~183.5937.49MRHLTN50805y=4.035 2+0.473 5x0.909 8118.3481.71~154.9737.93MRCJJH20801y=4.264 8+0.354 1x0.978 1119.6246.79~192.4538.34MRYCHJ90103y=3.846 3+0.558 3x0.961 3125.4364.29~186.5740.20MRHLTN51002y=4.106 2+0.428 9x0.940 5128.4478.89~177.9941.17MRYCHJ80401y=4.080 7+0.433 9x0.994 2133.2732.30~234.2442.71MRCJJH20201y=4.277 0+0.339 5x0.965 9136.3463.34~209.3443.70MRCJTN30205y=4.079 8+0.435 9x0.955 9140.8482.25~199.4345.14MRDZTN110104y=3.764 1+0.577 6x0.959 5151.1285.11~217.1348.44MRYZJH100102y=4.296 8+0.322 8x0.960 9153.1281.86~224.3849.08MRJSTN10102y=4.029 6+0.445 4x0.975 0158.9374.91~242.9550.94MRCJJH20705y=3.800 3+0.543 2x0.953 9172.5199.50~245.5255.29MRCJJH20106y=3.940 2+0.478 7x0.959 1173.2095.36~251.0455.51MRCJTN30101y=4.285 9+0.321 9x0.944 4178.66110.56~246.7657.26MRYZHJ90301y=4.060 1+0.421 5x0.967 1181.5392.61~270.4558.18MRYZTN100301y=4.060 0+0.416 5x0.971 8194.8899.94~289.8262.46MRYCXY70301y=3.774 5+0.525 4x0.953 5221.56130.43~312.6971.01HRYZJH100201y=4.086 7+0.389 8x0.950 8230.03136.61~323.4573.73HRCJTN10501y=3.669 4+0.554 9x0.976 0251.63115.04~388.2280.65HRYCXY70702y=3.803 8+0.499 7x0.997 6259.1551.78~466.5283.06HRYCHJ80301y=3.998 7+0.413 8x0.942 2266.75175.01~358.4985.50HRJH21617y=3.326 5+0.693 0x0.913 4270.23198.70~341.7686.61HRCJXY30103y=3.752 0+0.505 7x0.957 6295.13173.81~416.4594.59HRHLTN22602y=3.599 0+0.563 0x0.954 3312.76186.20~439.32100.24HRYZTN100303y=3.876 2+0.449 7x0.994 3341.31115.55~567.07109.39HRDTN83108y=4.120 5+0.350 0x0.932 4342.15245.27~439.03109.66HRDTN31605y=4.263 3+0.291 7x0.967 9357.08197.19~516.97114.45HRCJJH20502y=4.186 4+0.312 7x0.951 4436.16293.80~578.52139.79HRHLTN51001y=3.589 0+0.538 4x0.990 1453.90170.10~737.70145.48HRYZHJ90103y=3.804 9+0.436 9x0.968 5557.11331.31~782.91178.56HRYCJH70402y=3.562 1+0.518 1x0.995 1641.00187.88~1 094.12205.45HRYCHJ80203y=3.912 1+0.387 1x0.942 1709.49519.81~899.17227.40HRHLTN50901y=3.582 6+0.495 4x0.905 5752.35615.60~889.10241.14HRYCTN70102y=3.114 2+0.652 3x0.988 9825.34353.18~1 297.50264.53HRYZHJ90402y=4.194 5+0.262 8x0.952 71 240.54921.66~1 559.42397.61HRYCJH70401y=3.801 9+0.378 0x0.975 51 525.43909.53~2 141.33488.92HR
正态性检验表明,吡唑醚菌酯对57株蒂腐病菌株的EC50频率分布呈现近似连续性正态分布,趋势平缓(图1),Sk=0.86>0,σ1=0.661,Sig.=0.2>0.05;Ku=0.654>0,σ2=1.279,Sig.=0.533>0.05。说明供试的蒂腐病病菌对吡唑醚菌酯的敏感性存在一定分化。吡唑醚菌酯对供试蒂腐病菌株的EC50频率分布呈现先上升后下降趋势,多数菌株对吡唑醚菌酯的抗性处于中抗或高抗水平,敏感菌株则较少,其中EC50在700~2 000 mg/L范围的菌株对吡唑醚菌酯表现出极高的抗性。表明田间表现中抗菌株为优势群体,而抗性频率呈典型的单峰曲线,也说明该类药剂产生抗药性的风险极大。

图1 吡唑醚菌酯对海南芒果蒂腐病菌EC50的正态分布图Fig.1 Normal distribution for EC50 values of 57 Botryodiplodia theobromae isolates to pyraclostrobin in Hainan
3 讨论
海南省西南部冬、春干旱少雨,旱期长、气温高的“干热”气候适合发展芒果产业,现已成为海南省主要的芒果生产基地。但常常由于台风等自然条件的影响,病虫害发生十分严重。当前,芒果蒂腐病的防治主要依赖化学药剂,吡唑醚菌酯是推荐用药之一[14-15]。良好的防效使得吡唑醚菌酯的使用次数和使用量不断增加,导致芒果蒂腐病病菌对其产生了不同程度的抗性,因此定期检测该菌对吡唑醚菌酯的抗性分布及抗性水平,对该病菌进行抗性跟踪监测非常必要。王萌等[16]于2014年检测了海南省芒果蒂腐病病菌对甲氧基丙烯酸酯类杀菌剂的抗性,结果表明,对醚菌酯表现抗性的菌株频率达90.00%,对嘧菌酯和吡唑嘧菌酯表现抗性的菌株频率分别为76.67%和53.33%。2016年本课题组对海南省芒果蒂腐病病菌对吡唑醚菌酯的抗性进行了跟踪检测,表明对吡唑醚菌酯表现抗性的菌株频率为58.95%。与王萌等的测定结果相似,说明海南芒果蒂腐病病菌对吡唑醚菌酯的抗性已非常普遍。而本次研究发现田间该菌对吡唑醚菌酯的抗性有所增加,测试的57个菌株中EC50超过100 mg/L的菌株达38个,占供试菌株的66.67%, EC50大于500 mg/L的菌株有7个。吡唑醚菌酯对海南芒果蒂腐病病菌的EC50呈正态分布,以中抗和高抗菌株为优势群体。
来自海南不同产区的芒果蒂腐病菌株对吡唑醚菌酯的抗性频率差异不大,这与海南特殊的地理环境有关,海南省面积不大,各芒果产区的各种气候条件比较一致,而芒果生产期间在药剂选择及应用上以经验为主,种植户之间常常是盲目跟风,致使吡唑醚菌酯被大量频繁使用,造成了病原菌的抗性风险和抗性现状。
甲氧基丙烯酸酯类杀菌剂自1996年开发用于市场后不久便于1998年在德国北部小麦白粉病上发现了抗性菌株,并在北欧地区迅速蔓延,研究者于2003年在法国北部、瑞典和丹麦均检测到抗性菌株。随后又在美国密歇根州的苹果种植区发现甲氧基丙烯酸酯类杀菌剂抗性菌株。2010年,研究者在伊利诺伊州和田纳西州大学研究大豆灰斑病时发现了对该类杀菌剂产生抗性的菌株,并确定该类杀菌剂对引起大豆灰斑病的病原菌的抗性风险属于高风险[17]。在我国,对甲氧基丙烯酸酯类杀菌剂产生抗性的现象也很严重,2006年从山东省采集的黄瓜霜霉菌株中尚未检测到对该类药剂出现抗性的菌株[18],2007年再次采集该地区菌株时,出现了57株抗性菌株,抗性水平在21.15~2618.9倍之间,有些菌株的抗性水平甚至大于2618.9倍,这些研究结果与本研究类似,说明病原菌对该类杀菌剂的抗性风险很高,因此,科学合理使用该类药剂,对减缓抗药性的产生尤为重要。
甲氧基丙烯酸酯类杀菌剂是细胞呼吸抑制剂,芒果蒂腐病病菌对该类药剂已普遍产生抗性。随着分子生物学技术的快速发展,分子技术被用于病原菌对杀菌剂的抗性检测,对一些杀菌剂的作用机制和病原菌的抗性位点已有了较深入的研究,病原菌对杀菌剂敏感性降低是基因突变引起的,主要是Cytb基因的点突变引起。后续,我们将继续研究芒果蒂腐病菌对该类杀菌剂产生抗性的机制,进一步探索该类药剂的作用机理。
