海南橡胶树暹罗刺盘孢菌群体遗传结构分析
2018-08-01曹学仁车海彦罗大全
曹学仁, 车海彦, 罗大全
(中国热带农业科学院环境与植物保护研究所,农业部热带作物有害生物综合治理重点实验室, 海口 571101)
天然橡胶是我国四大战略物资之一。炭疽病是橡胶树上的一种重要叶部病害,该病于1906年在斯里兰卡被首次报道,目前在亚洲和非洲等橡胶种植国广泛发生[1]。该病害早期在我国只在苗圃和新植幼树上少量发现,自1962年首次在海南大丰农场开割胶树上发现后,各植胶区陆续有其发生危害的报道[2-3]。近年来炭疽病的发生日趋严重,是农业部橡胶树“两病”春防工作的防治对象之一。
一直以来胶孢炭疽菌ColletotrichumgloeosporioidesPenz.被认为是引起我国橡胶炭疽病的病原菌[4-5]。2010年李继锋等报道引起海南橡胶炭疽病的病原菌除胶孢炭疽菌外,还包括尖孢炭疽菌C.acutatumSimmonds[6]。随着分子系统学的发展,发现C.gloeosporioides和C.acutatum均是复合种[7-8]。作者通过研究发现,目前海南橡胶树炭疽病病原以C.gloeosporioides复合种为主[9]。通过分子系统学研究进一步表明,暹罗刺盘孢菌C.siamense是C.gloeosporioides复合种中的优势种。目前关于橡胶树炭疽菌的研究主要集中在复合种及种的鉴定方面[5-6,10],尚未见关于其种内的遗传多样性的研究报道。因此本研究对海南省橡胶树C.siamense群体的遗传结构、群体遗传多样性及单倍型地理分布进行了研究,从而为制定可持续控制该病害策略提供理论依据。
1 材料与方法
1.1 样品来源
2017年4-8月,从海南保亭、儋州、海口、琼海和屯昌等5个市县的橡胶种植园中随机采集炭疽病病叶,室内进行病原菌的分离和纯化,经形态和多基因分子鉴定,确定为暹罗刺盘孢菌C.siamense的菌株58个,具体分布为:保亭12个、儋州10个、海口12个、琼海15个和屯昌9个。
1.2 方法
1.2.1 样品DNA提取
用灭菌的牙签将在PDA平板上培养7 d的菌丝刮下,采用TIANGEN新型植物基因组提取试剂盒(天根生化科技(北京)有限公司)提取病原菌DNA,提取方法参见试剂盒说明书。
1.2.2 PCR扩增
采用真菌核糖体内转录间隔区(ITS)通用引物ITS1和ITS4扩增ITS1、ITS2和5.8S rDNA全序列及18S rDNA和 28S rDNA的部分序列。PCR反应体系(25 μL):12.5 μL TaKaRa PremixTaq,引物各1 μL(5 μmol/L),模板DNA 1 μL,ddH2O 9.5 μL。PCR反应条件:95℃变性4 min;95℃变性30 s,52℃退火30 s,72℃延伸45 s,共35个循环;72℃延伸7 min;4℃保存。
1.2.3 测序
PCR产物分别用正反向引物进行双向测序,以保证测序的准确率。测序委托北京诺赛基因组研究中心有限公司完成。
1.2.4 数据分析
原始双向序列,采用DNAstar中Seqman拼接序列。应用MEGA version 6.0[11]对拼接序列进行比对分析。利用DnaSP 5.0[12]计算多基因片段组合序列的标准多样性指数,如单倍型数H(number of haplotypes)、单倍型多样性Hd(haplotype diversity)、核苷酸多样性Pi(nucleotide diversity),并进行Tajima’sD中性检验,以及绘制核酸错配分布图(mismatch distribution of nucleotide)等。使用TCS1.21[13]构建暹罗刺盘孢菌单倍型的网络图。采用Arlequin 3.5.2.2[14]软件进行分子变异分析(analysis of molecular variance, AMOVA)。采用MEGA 6.0构建系统发育树,使用 Kimura 双参数模型,构建分子系统发育树(N-J tree),利用自展法(bootstrap,1 000 次重复)检验各分支的置信度。
2 结果与分析
2.1 海南橡胶树暹罗刺盘孢菌单倍型地理分布及其多样性
利用ITS通用引物ITS1/ITS4对海南58个橡胶树暹罗刺盘孢菌C.siamense扩增、测序、拼接和序列比对后,得到的ITS序列长度为591 bp,核苷酸组成分析结果表明:碱基A、T、G、C的平均含量分别为24.10%、24.24%、26.47%和25.2%,A+T含量为48.34%,G+C含量为51.66%。共发现多态性位点10个,其中简约信息位点8个,单碱基变异位点2个。58条ITS序列共检测到11种单倍型(haplotype,H)(表1),其中单倍型H11包含样品数最多,达16个,且在5个市(县)均有分布,其次为单倍型H4,有12个样品在4个市(县)有分布,说明各地理种群间存在频繁的基因交流。从地区来看,海口单倍型最多,为7种;琼海最少,为4种;保亭、儋州和屯昌分别有5种、6种和5种。保亭和儋州有自己独特的单倍型,其中保亭独特的单倍型有2种,说明各地区的病原菌存在一定的遗传分化现象。
海南橡胶树暹罗刺盘孢菌不同地理种群的单倍型多样性在0.724~0.889之间,其中儋州种群的单倍型多样性最高,为0.889;琼海种群的单倍型多样性最低,为0.724。核苷酸多样性(Pi)也处于较高的水平,在0.002 55~0.003 77之间(表1),结果表明,海南地区橡胶树暹罗刺盘孢菌具有丰富的遗传多样性。
表1海南橡胶树暹罗刺盘孢菌样品的分布及单倍型多样性
Table1DistributionsandhaplotypediversityofColletotrichumsiamensesamplesfromrubbertreeinHainan

地区Site样品数Number单倍型(数量)Haplotype (Number)单倍型多样性Haplotype diversity核苷酸多样性Nucleotide diversity保亭 Baoting12H1(4);H3(3);H7(1);H9(1);H11(3)0.8180.002 93儋州 Danzhou10H2(3);H4(2);H5(2);H6(1);H8(1);H11(1)0.8890.003 77海口 Haikou12H1(1);H2(1);H3(1);H4(4);H6(1);H10(1);H11(3)0.8640.003 60琼海 Qionghai15H4(2);H5(4);H6(2);H11(7)0.7240.002 55屯昌 Tunchang9H1(1);H2(1);H4(4);H10(1);H11(2)0.8060.003 30合计 Total58H1(6);H2(5);H3(4);H4(12);H5(6);H6(4);H7(1);H8(1);H9(1);H10(2);H11(16)0.8550.003 45
2.2 单倍型网络分析及种群扩张分析
利用TCS软件绘制单倍型网络结构图(见图1),可以看出病原菌发生了一定的遗传分化,各单倍型并没有依采样地点形成各自的分支,而是呈现一个非典型星状的发散图。单倍型H11处于辐射中心,推测为原始单倍型。此外,由核苷酸不配对分布图(图2)可以看出,分布曲线呈双峰形式。另外Tajima’s D中性检验结果为-0.164 55,无显著性,这些结果均表明海南橡胶树暹罗刺盘孢菌种群历史上未经历明显的扩张,其种群大小整体保持稳定。

图1 海南橡胶树暹罗刺盘孢菌单倍型网络图Fig.1 Parsimony network of the haplotypes of Colletotrichum siamense from rubber tree in Hainan
2.3 遗传分化分析
58个菌株ITS序列数据的AMOVA分析结果表明,海南橡胶树暹罗刺盘孢菌种群变异主要发生在种群内,占总变异的93.9%;而群体间遗传差异较小,占总变异的6.1%,说明病菌群体间基因交流频繁。种群内的遗传分化指数(Fst)值为0.061,说明海南橡胶树暹罗刺盘孢菌群体产生了遗传分化,这和单倍型的简约网络图分析结果一致。

图2 海南橡胶树暹罗刺盘孢菌群体核苷酸不配对分布Fig.2 Mismatch distribution of Colletotrichum siamense from rubber tree in Hainan
不同地理种群间的遗传分化Fst见表3。保亭病菌样品与其他四市(县)之间的遗传分化较大,Fst在0.215 74~0.324 8之间;琼海病菌样品与除保亭外的其他三市(县)之间的Fst都小于0.05,说明这些群体间遗传分化很弱,基因交流十分频繁;海口与儋州、海口与屯昌之间的Fst均小于0.1,表明这些种群间存在一定程度的遗传分化。
表2海南橡胶树暹罗刺盘孢菌种群内和种群间的分子变异分析
Table2AMOVAanalysisofgeneticvariationwithinandamongpopulationsofColletotrichumsiamensefromrubbertreeinHainan

变异来源Source自由度df平方和Sum of squares变异成分Variance components总变异百分比/%Percentage of variation统计Stat数值Value概率Prob群体间 Among populations42.8400.026 39 Va6.1群体内 Within populations5321.5390.406 39 Vb93.9Fst0.0610.023合计 Total5724.3790.432 78
表3海南橡胶树暹罗刺盘孢菌不同地理种群间遗传分化值
Table3PairwiseFstvaluebetweengeographicalpopulationofColletotrichumsiamensefromrubbertreeinHainan

群体Population保亭Baoting儋州Danzhou海口Haikou琼海Qionghai屯昌Tunchang保亭Baoting0 儋州Danzhou0.260 090 海口Haikou0.215 74-0.064 270 琼海Qionghai0.324 80-0.042 59-0.035 150 屯昌Tunchang0.317 12-0.065 51-0.083 01-0.023 620
2.4 基于 ITS 序列的系统发育关系分析
系统发育分析结果表明,来自同一地区的单倍型并没有聚在一个分支内,而是分布在系统树的不同分支中,不同地区菌株的单倍型交叉共存,说明其间存在有效的基因流,没有呈现出明显的地理差异,部分地理种群虽然具有独特的单倍型,但各单倍型的差异不大。
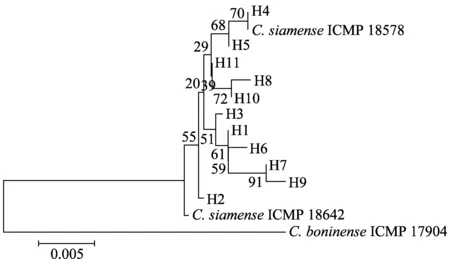
图3 采用邻接法构建的基于ITS序列的海南橡胶树 暹罗刺盘孢菌系统树Fig.3 Neighbour-joining tree based on ITS sequences of Colletotrichum siamense from rubber tree in Hainan
3 讨论
遗传多样性是评价一个物种的进化潜能和抵御自然界各种生存压力的重要遗传学指标。核糖体DNA内转录间隔区ITS(internal transcribed spacer)承受的选择压力较小,进化速率快,能提供比较丰富的核苷酸变异位点和信息位点,已经证实可用于研究真菌种内遗传多样性和群体遗传结构,如李河等[15]利用ITS 序列对引起油茶炭疽病的胶孢炭疽菌种群的遗传结构进行了研究,朱丹雪等[16]利用ITS 序列研究了果生刺盘孢菌C.fructicola的群体遗传结构。本研究利用 ITS 序列,分析了海南橡胶树暹罗刺盘孢菌的种群遗传结构,结果发现该病菌单倍型多样性较丰富,病菌种群历史上并没有发生显著的种群扩张,来自同一个地区病菌的单倍型未能聚在一起,这与海南省油茶及其他寄主植物果生刺盘孢菌群体和暹罗炭疽菌群体遗传结构分析的结果一致[17-18]。
11种单倍型中,除了3种单倍型由于只有一个样品而仅在一个市(县)分布外,其余8种单倍型都在2个或2个以上市(县)有分布,说明病菌在各地理种群间存在频繁的基因交流。而遗传分化指数结果说明海南橡胶树暹罗刺盘孢菌群体产生了一定的遗传分化,其中以保亭病菌样品与其他四市(县)之间的遗传分化较大,这可能与保亭位于海南省南部,有五指山山脉与其他4市(县)隔离,环境气候条件与其他市(县)区别较大。另外暹罗炭疽菌最早在泰国的咖啡浆果上发现[19],随后在草莓、油茶、可可、番木瓜、辣椒、葡萄等多种寄主植物上均有发现[8],而有研究发现不同寄主种群间的暹罗炭疽菌有一定的遗传分化[18],而海南不同地区作物种植存在一定差异,病菌为了适应寄主而产生变异,从而导致病菌具有丰富的遗传多样性。
