斑马鱼体内氧化损伤标志物筛选
2018-08-01李嘉蔚胡雪菲陈呢喃陆一鸣
李嘉蔚,胡雪菲,韩 鹏,陈呢喃,陆一鸣
1)上海交通大学医学院附属瑞金医院中法生命科学和基因组研究中心 上海 200025 2)上海交通大学医学院附属瑞金医院北院急诊科 上海 200025 3)上海交通大学医学院附属瑞金医院急诊科 上海 200025
氧化应激参与了糖尿病酮症酸中毒[1]、百草枯中毒[2-3]等多种急诊工作中常见疾病的发生发展。人类端粒由于富含鸟嘌呤,且存在3’单链突出结构,易受到氧化损伤;由于端粒结合蛋白复合体的保护作用,端粒受到氧化损伤后不能启动DNA损伤应答 (DNA damage response,DDR)通路,无法完成损伤的修复,因此端粒很可能是氧化损伤的重要靶点[4]。在端粒结合蛋白复合体的蛋白组分中,端粒重复结合因子2(teomere repeat binding factor 2,TRF2)的功能最为重要,它的低表达会导致端粒功能障碍[5];端粒功能障碍会导致活性氧(reactive oxygen species,ROS)水平升高[6]。基于此,本研究采用TRF2基因敲除(TRF2-/-)斑马鱼胚胎作为氧化损伤模型(TRF2-/-斑马鱼胚胎可能会出现小脑、小眼、脊柱侧弯与心包水肿等氧化损伤相关畸形),探讨TRF2是否能够影响氧化应激相关基因山松醇RNA结合蛋白家族3(pumilio RNA binding family member 3,PUM3)、神经元中蛋白激酶和酪蛋白激酶底物3(protein kinase C and casein kinase substrate in neuron 3,PACSIN3)的表达,筛选以端粒为靶点的氧化损伤标志物,为以后的临床决策提供参考。
1 材料与方法
1.1主要试剂Trizol、RNA过柱纯化试剂盒、SP6体外转录试剂盒购自Ambion公司,逆转录试剂盒购自TaKaRa公司,2×SuperReal Premix Plus(With SYBER Green)购自天根生化科技(北京)有限公司,SanPrep柱式质粒DNA小量抽提试剂盒购自上海生工生物工程有限公司。
1.2实验动物分组与处理采用本课题组保存的TRF2杂合子(TRF2+/-)斑马鱼进行自交。将后代胚胎饲养至3个月大小,剪尾抽提DNA,PCR后进行测序鉴定筛选TRF2-/-斑马鱼。TRF2-/-斑马鱼自交获得TRF2-/-斑马鱼胚胎。野生型斑马鱼胚胎组作为对照组,TRF2基因敲除斑马鱼(TRF2-/-)作为实验组。每组取30条存活胚胎进行RNA抽提,获得RNA。
1.3斑马鱼胚胎中TRF2、PUM3、PACSIN3mRNA表达的RT-qPCR检测使用Invitrogen公司的Trizol试剂按照说明书抽提斑马鱼胚胎总RNA,并采用TaKaRa公司逆转录试剂盒进行逆转录反应。PCR引物序列如下:PUM3上游序列5’-GCGTCT
TCAGTTGTGGAATAC-3’,下游序列5’-CATCCAAGATGCT-CTCCAATTT-3’;TRF2 上游序列5’-TCAGGATAACTGGAGTGATGAG-3’,下游序列 5’-AGTGTCCCACACCATAGC-3’;β-actin上游序列5’-CCGTATGCAGA-AGGAAATCAC-3’,下游序列5’-GGTGGCAACAGTTCTGTTTAG-3’;PACSIN3上游序列5’-GAGACCAAAGATGCTGATGAAG-3’,PACSIN3下游序列5’-GGTACATTTCTCTAGGCGATCT-3’。RT-qPCR反应程序:95 ℃预变性15 min; 95 ℃ 10 s,61 ℃ 20s ,72 ℃ 31 s,40个循环。基因相对表达量计算采用2-ΔΔCT法[7]。
1.4斑马鱼pCS2-PUM3、pCS2-PACSIN3载体的构建斑马鱼PUM3、PACSIN3编码序列全长由PCR法扩增得到。 PUM3 PCR引物的EcoRⅠ上游序列:5’-CATCGATTCGAATTCATGGAGGGTAAACCAAGAAG-3’,XhoⅠ下游序列:5’-TTCTAGAGGCTCGAGATTATGCAAGTTTTTCAAGCAGAAC-3’, PACSIN3 PCR引物的EcoRⅠ上游序列:5’-CATCGATTCGAATTCATGTCTTCCAACGGTGATCGC-3’,XhoⅠ下游序列:5’-TTCTAGAGGCTCGAGTCAGCAACTCTTCTCCTTCTCCTC-3’。PCR反应程序:95 ℃预变性2 min;95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 2 min,35个循环;72 ℃ 10 min。将扩增产物连接到pCS2质粒中,经过转化、挑选菌落、菌落扩增、质粒小量抽提后,将载体交由上海桑尼生物科技有限公司测序鉴定。
1.5载体的体外转录与显微注射采用Ambion公司SP6体外转录试剂盒按照使用说明书对构建成功载体进行体外转录。根据使用说明书以及本次线性化载体浓度,使用线性化载体6 μL(约300 ng)进行体外转录。体外转录完成并采用Ambion公司RNA过柱纯化试剂盒纯化后,将PUM3、PACSIN3 mRNA显微注射至TRF2-/-斑马鱼受精卵中。每个受精卵约注射5.5 ng mRNA。将斑马鱼受精卵置于平板培养皿中,加入适量蛋水,并置于28.5 ℃恒温培养箱中正常发育。使用间氨基苯甲酸乙酯将斑马鱼幼鱼麻醉后显微镜下观察斑马鱼是否畸形。斑马鱼中出现小脑、小眼、脊柱侧弯或心包水肿或出现多种者被认为是畸形斑马鱼。统计注射组与未注射组TRF2-/-斑马鱼畸形率。
1.6统计学处理采用SPSS 24.0进行分析。应用两独立样本t检验比较野生型和TRF2-/-斑马鱼胚胎中TRF2、PUM3、PACSIN3基因相对表达量的差异,应用χ2检验比较注射组与未注射组TRF2-/-斑马鱼畸形率的差异。检验水准α=0.05。
2 结果
2.1野生型和TRF2-/-斑马鱼胚胎中TRF2、PUM3、PACSIN3mRNA的表达见表1。
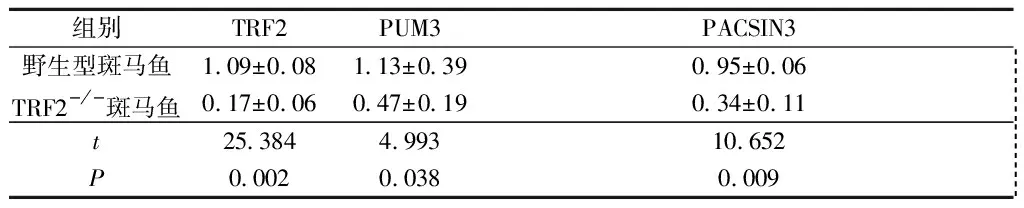
表1 野生型和TRF2-/-斑马鱼胚胎中TRF2、PUM3、PACSIN3 mRNA的表达(n=30)
2.2pCS2-PUM3、pCS2-PACSIN3载体体外转录及mRNA显微注射对TRF2-/-斑马鱼畸形率的影响
注射PUM3 mRNA组共注射94个TRF2-/-受精卵,成活85条。在存活的斑马鱼中,畸形斑马鱼共14条,畸形率约为16.5%。注射PACSIN3 mRNA组共注射85个TRF2-/-受精卵,成活79条。在成活的斑马鱼中,畸形斑马鱼共15条,畸形率约为19.0%。对照组共137个TRF2-/-受精卵,成活122条。在成活的斑马鱼中,畸形斑马鱼共36条,畸形率约为29.5%。与对照组相比,注射PUM3 mRNA斑马鱼畸形率显著下降(χ2=4.648,P=0.031),注射PACSIN3 mRNA斑马鱼畸形率差异无统计学意义(χ2=2.803,P=0.094)。
3 讨论
糖尿病酮症酸中毒是糖尿病病人最常见的并发症,也是急诊工作中常见的疾病。该病可引起大脑、肾等重要脏器的损伤[8],严重时甚至可导致患者死亡[9]。该病同时伴有系统性氧化应激,是病情加剧的十分重要的原因[10]。百草枯是一种氧化剂,中毒后可引起以肺为主要靶器官的多脏器功能损害:通过在肺组织中产生大量的氧自由基,来破坏肺泡毛细血管、肺泡上皮细胞等,最终可引起患者呼吸衰竭而死亡[11]。如果能够筛选出理想的氧化损伤标志物,则可能可以在病情发展过程中预报氧化损伤,从而有利于疾病的干预。端粒可能是氧化损伤的重要靶点,因此,以端粒为靶点,有可能可以筛选出合适的氧化损伤标志物,进而可能可以用来早期发现或预报氧化损伤。然而,目前国内外氧化损伤标志物筛选研究[12-13]较多,但以端粒为靶点的氧化损伤标志物研究较少,因此本研究一定程度上弥补了该领域研究的空白。
研究[14-15]表明,TRF2能结合端粒外的端粒间质重复序列(interstitial telomeric sequence,ITS)来调控附近相关基因的表达,提示TRF2不但具有结合、保护端粒的作用,同时可能具有反式作用因子的作用。本研究发现,野生型斑马鱼胚胎中PUM3、PACSIN3 mRNA的表达高于TRF2-/-斑马鱼,提示TRF2能影响斑马鱼胚胎中PUM3、PACSIN3 mRNA的表达。结合上述研究[14-15]结果,提示TRF2可能通过结合这些基因的ITS序列来影响它们的表达。
本研究发现,PUM3能补救TRF2缺失造成的氧化损伤相关器官畸形,PACSIN3可能能补救TRF2缺失造成的氧化损伤相关器官畸形,表明PUM3、PACSIN3表达量的降低可能是加重斑马鱼器官氧化损伤的一个重要原因。提示临床上通过检测患者TRF2、PUM3、PACSIN3水平可能可以作为即将发生氧化损伤的标志,用来早期预报氧化应激导致器官损伤,或可能通过检测血液等组织TRF2、PUM3、PACSIN3水平来预报体内发生的氧化损伤,但具体临床应用尚需更多证据。
本研究存在局限性:①TRF2影响PUM3、PACSIN3表达的确切机制不明,有待进一步研究。②本研究采用斑马鱼作为研究对象,未取人类样本进行研究。虽然斑马鱼与人类基因同源性高达87%,但研究结果尚无法应用于临床。具体临床应用尚需更多研究。
总之,临床上通过检测TRF2、PUM3、PACSIN3表达水平有望早期发现或预报氧化应激,并有望成为提高临床疗效的靶点。
