基于甘油的1,3-丙二醇生物合成的代谢局限及其改造策略
2018-07-30杨苗苗员君华张欢欢张国艳HossainZabed齐向辉
杨苗苗,员君华,张欢欢,张国艳,Hossain Zabed,齐向辉
基于甘油的1,3-丙二醇生物合成的代谢局限及其改造策略
杨苗苗*,员君华*,张欢欢,张国艳,Hossain Zabed,齐向辉
江苏大学 食品与生物工程学院,江苏 镇江 212013

金城. 2018酶工程专刊序言. 生物工程学报, 2018, 34(7): 1021−1023.Jin C. Preface for special issue on enzyme engineering (2018). Chin J Biotech, 2018, 34(7): 1021−1023.
粗甘油是生物柴油生产中的主要副产物,一些微生物可将甘油转化为重要化工原料1,3-丙二醇 (1,3-PD),而利用这些微生物野生菌株生物合成1,3-PD会存在一些局限性,如底物抑制、产物抑制等。文中从1,3-丙二醇的甘油生物转化途径与这些局限性出发,总结了生物合成中存在的问题,并针对这些问题提出了一些基于基因敲除或基因过表达等基因工程技术的改造方法,综述了利用基因工程菌生物转化甘油生成1,3-丙二醇的最新研究进展。
甘油,1,3-丙二醇,生物转化,生物合成,基因工程
1,3-丙二醇 (1,3-propanediol,1,3-PD) 是一种无色物质,味道微甜,具有粘性,易溶于水和乙醇,在化工、食品、医学、化妆品等领域具有十分广泛的应用[1-5]。1,3-PD可以通过化学途径合成,但合成工艺条件苛刻、能耗高、释放有毒中间体且产品精制难度较大,这些都增加了1,3-PD的生产成本[6]。因此,寻找一种低成本、低能耗的代替方法,将为1,3-PD的生产带来巨大效益。粗甘油是生物柴油生产中的一种主要副产物[7-9],自然条件下一些微生物可以直接利用甘油作为底物,高效地合成1,3-PD,这不仅解决了1,3-PD化学法生产成本较高的问题,又有效地回收利用了生物柴油生产中的副产品。这些1,3-PD生产菌株包括短乳杆菌、肺炎克雷伯菌、巴氏梭状芽孢杆菌、丁酸梭菌和弗氏柠檬菌等[10-16]。尽管上述自然界中分离的野生菌用于生产1,3-PD具有较高的效率,但这些菌本身的某些性质限制了其产率的继续提高,利用基因工程的技术对这些野生菌进行定向改造[17],可以打破这些限制,甚至可以对本身不能进行甘油转化生成1,3-PD的菌株进行基因工程手段的改造,引入1,3-PD代谢途径来生产1,3-PD。例如,美国杜邦公司利用利用玉米中的糖分为底物,将、和可转化糖为甘油的基因克隆到工程菌中,实现了以葡萄糖为底物生产1,3-PD,并用于工业化生产,被公认为是利用基因工程方法使代谢物产业化的典范。基因工程方法如敲除和相关基因的过表 达均可被用来构建高效或高产的1,3-PD工程菌株。
1 1,3-PD的生物合成
1.1 生物合成途径
在自然条件中,甘油歧化是1,3-PD的唯一生成途径,一般在厌氧条件下进行[18-21]。在这些微生物中,甘油可以通过简单扩散或促进扩散两种不同方式渗透到膜中[22],当甘油跨过细胞膜后,会进入两个平行的代谢途径:氧化代谢途径和还原代谢途径(图1)。
在氧化途径分支中,甘油在甘油脱氢酶 (Glycerol dehydrogenase,GDH)的催化下,生成二羟丙酮 (Dihydroxyacetone,DHA),这步反应需要NAD+作为辅酶;之后,DHA在ATP的参与下,经磷酸二羟丙酮激酶 (Dihydroxyacetone kinase,DHAK) 催化生成磷酸二羟丙酮 (Dihydroxyacetone phosphate,DHAP),再在NAD+辅酶参与下,生成磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP),之后进入碳代谢如糖酵解、三羧酸循环等主流代谢途径和其他代谢途径[23-24]。由PEP转化产生的丙酮酸会进一步产生次级代谢产物,如乙酸、琥珀酸、乳酸、丁酸、正丁醇、乙醇、2,3-丁二醇 (2,3-butanediol,2,3-BD) 等,这些代谢产物构成了利用微生物生产1,3-PD的主要副产物。
另一分支是还原途径分支。甘油首先在甘油脱水酶 (GDHt,glycerol dehydratase) 的作用下生成3-羟基丙醛 (3-hydroxypropanaldehyde,3- HPA),GDHt是控制甘油分解的限速酶,对甘油转化起着至关重要的作用。随后,经1,3-丙二醇氧化还原酶 (1,3-propanediol oxidoreductase,PDOR) 催化,3-HPA转化为1,3-PD[25]。在从甘油到1,3-PD厌氧转化的过程中,当所有的乙酰CoA均进入TCA循环,未经氧化磷酸化生成乙酸,其最大理论产量为0.875 mol/mol甘油。然而,在大多数情况下,为了产生更多的ATP,乙酸大量生成,此时以乙酸为唯一副产物的最大理论收率为0.72 mol/mol[17]。鉴于通过生物合成1,3-PD的诸多优点,利用甘油合成1,3-PD是目前的研究热点。然而,生物转化甘油生成1,3-PD亦存在着一些局限性,利用基因工程的方法来改造微生物菌株,可以有效改善这些问题,表1列出了这些工程菌生产1,3-PD的情况。

图1 甘油的代谢通路图[26]
1.2 转化途径中的关键酶及其基因
由上述甘油的还原途径可见,GDHt (EC 4.2.1.30) 和PDOR (EC 1.1.1.202) 是生物法生产1,3-PD的两种关键酶,而编码该关键酶的基因存在于dha调节子上,该调节子包括GDHt的编码基因 ()、PDOR的编码基因 ()、GDH的编码基因 ()、DHAK的编码基因 ()和调节基因 (),不同1,3-PD生产菌的调节子构成亦不同。
GDHt是甘油歧化途径中的关键功能性分子,是1,3-PD生物转化中的限速酶。在的调节子中,编码GDHt的基因是,由3个阅读框 (、、) 分别编码该酶的3个功能亚基,即α、β和γ亚基,它们共用一个启动子,以α2β2γ2二聚体的形式存在。而的GDHt是由、编码的,其结构与中的GDHt同源,具有较高的相似性,这两种GDHt均以辅酶维生素B12为辅基,在1,3-PD发酵过程中微量流加B12,可以满足微生物转化的需要。而在中,GDHt的编码基因由1、2组成,1编码2的激活蛋白,该菌中的GDHt对氧气极其敏感,与细胞膜的通透性有关,但中的GDHt并不是辅酶维生素B12依赖型,由于辅酶B12成本较高,这也使得工业上利用生物转化1,3-PD具有独特的优势。
PDOR由基因编码,是甘油与1,3-PD代谢途径中的另一关键性酶,直接将甘油还原途径中的中间产物3-HPA还原为1,3-PD,同时消耗NADH生产NAD+,微生物通过该反应步骤消耗还原力NADH,使微生物细胞内的还原力达到平衡。在中由连续基因编码,转录方向与甘油脱水酶基因相反,由另一启动子控制;而在调节子中,两种酶的编码基因在同一方向转录。在1,3-PD生产途径中,PDOR酶的活性会受到许多抑制,导致1,3-PD产量降低,因此,为实现、基因的高效表达,构建载体时须借鉴自然菌中基因簇的排布模式。表2列出了应用不同的蛋白改造方法对以上两种酶的改造策略。
2 甘油转化生成1,3-PD过程中的底物抑制与产物抑制
甘油以及1,3-PD产物的积累都对细胞的生长具有抑制作用,且导致了GDHt不可逆的失活,降低了1,3-PD的产率。Colin等[27]研究了CNCM1211中甘油和1,3-PD对细菌的抑制作用,结果表明,细菌的生长速率与甘油的浓度成反比,当甘油初始添加浓度达到150 g/L时菌体的生长受到明显抑制,浓度达到160 g/L时,细菌几乎不生长;当1,3-PD的初始添加量达到65 g/L时,细菌的生长率达到最大值,由于甘油的代谢产生1,3-PD,1,3-PD在培养基中的终浓度为70 g/L。Daria等[28]也研究了1,3-PD对DSP1生产性能的影响,在接种之前将1,3-PD添加到培养基中,得出了相近的结果,当外源添加的1,3-PD浓度达到60 g/L时,菌株的活性相对较高,添加的初始浓度达到80 g/L时,对菌体来说是致命的。
由于GDHt是1,3-PD发酵过程中的关键酶,尤其是在甘油浓度较高时,提高酶的浓度或活性可以有效提高1,3-PD的产率[29]。首先,利用基因工程的技术对GDHt编码基因进行过表达是一个有效的解决方案。Oh等[30]首先获得了一株不产生副产物的突变株,命名为AK-VOT,通过去除甘油氧化途径,阻断除乙酸外其他副产物的生成,获得了1,3-PD高产菌株,之后,过表达和/或基因,进一步研究以期提高1,3-PD产量。结果表明,相比于和基因同时过表达,单独过表达的突变株1,3-PD的产量较高。其次,采用定向进化、理性设计或非理性设计的方法对酶分子进行改造,获得活性更高、稳定性更好的新型GDHt,也可将甘油底物尽快转化。Qi等[31-32]采用生物信息学的方法对GDHt进行理性设计和非理性设计,并研究了重组酶在不同pH值下的酶活力及稳定性,酶学性质的分析表明,相比于原始酶,经过定点突变理性设计的酶的活力提高到1.5–2.0倍, 对pH的稳定性也提高到原始酶的1.5–2.0倍;采用易错PCR的非理性改造和定点饱和突变理性改造相结合的方法得到的改造GDHt酶活力提高到8.3倍。利用这种改造后的酶进行1,3-PD的发酵,也可以促进底物的尽快转化,减少抑制。一些对1,3-PD具有较高耐受性的菌种也被分离获得,例如,Papanikolaou等[33]选用的是从死水池中分离得到的F2b,该菌株表现出良好的1,3-PD耐受性,耐受水平达到80 g/L。VPI 3266和DSM 5431也具有较高的1,3-PD耐受性[23],其1,3-PD产量确有提高。利用诱变育种的方式对菌株进行定向进化,经过高通量筛选也可能获得1,3-PD的高耐受菌株,同时这也是解决底物抑制的方法之一。另外,采用连续发酵的方式将代谢产物移除,对于提高产量也有一定的益处。
3 中间产物3-HPA的及时转化
3-HPA能够阻止细菌细胞生长,广泛应用于生物杀菌剂和抗感染治疗剂。其确切机制目前尚不十分清楚[34]。在甘油还原生成1,3-PD时,3-HPA是其中间产物,它不仅会延缓细菌的生长,而且GDHt和PDOR都对高浓度的3-HPA极其敏感,培养基中3-HPA的积累会导致微生物中的反馈机制的触发,降低GDHt的合成以降低3-HPA的生成水平,减少对菌体的毒害作用[35],从而导致1,3-PD的生成水平也相应降低,这个过程会导致代谢活动中不可逆转的后果,成为1,3-PD生产中的一个严重缺陷,也是1,3-PD生产中一个主要的影响因素[36]。因此,PDOR的浓度或活性是代谢中的关键影响因子,在保证GDHt一定活力的情况下,研究者们主要采取以下方法来降低3-HPA的影响。
3.1 提高PDOR活力
PDOR是一种氧化还原酶,许多学者研究了其氧化与还原活性。Qi等[37]从中克隆出PDOR编码基因,转化获得高效表达的PDOR,研究了其酶学性质,发现相比于其氧化活力,PDOR的还原活力的作用条件更温和,最适反应pH为7.0,温度为37 ℃。Qi等[38]还从中克隆到,获得新型重组PDOR,最适反应pH为7.5,温度为37 ℃,这对于1,3-PD的最终生成是有利的,对酶的3D结构分析表明,不同来源的两种PDOR均属于Ⅲ型乙醇脱氢酶。
将进行原始菌株中的过表达是提高PDOR活力的最直接的一种方法。由于PDOR的酶促反应依赖于辅酶NADH[39],当副产物途径被阻断时,这些突变体内细胞的氧化还原力NADH/NAD+较高,因此,进一步研究过表达基因和,使用这些多余的NADH,以提高1,3-PD产量。Cui等[12]在两株KG1-3 (只阻断2,3-丁二醇途径的突变株) 和KG1-5 (阻断2,3-BD和乳酸途径的突变株) 中将基因过表达。结果表明,在菌株KG1-5中,氧化还原平衡力恢复正常,产量提高明显,甘油1,3-PD的产量也恢复到正常水平的60%。
还有学者将PDOR编码基因转化大肠杆菌,采用共转化的方法,达到提高酶浓度与活力的目的。Yun等[40]从中克隆得到基因,使其在BL21中高效表达,将转化与混合,采用全细胞生物催化的方法进行甘油到1,3-PD的转化,由于PDOR的催化需要辅酶NADH,因此额外添加了NADH来实现还原力的平衡。结果表明,PDOR的全细胞生物催化有效提高了1,3-PD的产量,相比于单独利用发酵提高了2倍,1,3-PD的产量为25.88 g/L,转化率为0.54 g/g甘油。
许多研究人员还在寻找生产1,3-PD自然菌株中原始酶以外的方法来转化3-HPA。其中一种方法是从其他的菌株中寻找可以催化3-HPA为1,3-PD的酶,通过代谢工程构建异源重组菌株。例如,大肠杆菌中存在一种PDOR的同工酶,被命名为PDORI,由基因编码,该酶被证实是与中的PDOR有相同功能的氧化还原酶。许多研究人员研究了该基因,并构建了含有该基因的工程菌来增加1,3-PD的产量。Zhu等[41]构建了的重组菌体,将原始菌株中导入基因来提高酶的浓度。重组突变体最终的1,3-PD浓度达到67.6 g/L,与原始株相比,产量提高了125.33%,摩尔转化率达到了0.62 mol / mol。重组酶活性检测表明,相比原始菌株,酶活力提高了10倍。此外,3-HPA浓度与原始菌株相比降低了22.4%。因此,利用基因的过表达相关基因是解决1,3-PD生物生产中中间代谢产物3-HPA对细菌的抑制问题的一种有效方法。
3.2 构建辅酶再生系统
如上所述,NADH/NAD+比较高时,NADH作为还原当量对1,3-PD的生物合成起着关键的作用,构建辅酶再生系统,将有利于1,3-PD的生产。黄志华等[42-43]选取NAD+依赖型的甲酸脱氢酶(Formate dehydrogenase,FDH) 为研究对象,利用基因工程的手段构建了含有该基因的重组质粒,在中表达了的甲酸脱氢酶的基因,构建了NADH再生系统,对甘油代谢过程进行调控。结果表明,通过分批补料发酵,1,3-PD的产量达到78.6 g/L,与原始菌株相比,产量提高了12.5 %。
3.3 3-HPA流向其他途径
减少1,3-PD发酵中3-HPA浓度的另一种方法是将其部分转化为其他代谢物。例如,中存在一种NAD+依赖型的γ-谷氨酰-γ-氨基丁酸醛脱氢酶(PuuC),由基因编码,可以将3-HPA氧化为3-羟基丙酸 (3-HP),3-HP也是一种重要的化工产品[10]。由于原始菌中的表达量较少,Ashok等[44]将DSM 2026中的基因过表达,PuuC催化3-HPA生成3-HP时,会产生较多的NADH,这些NADH也可以用于1,3-PD的合成,达到了还原当量的充分利用。分批补料发酵中,重组() 菌株产生16.0 g/L 3-HP和16.8 g/L 1,3-PD,经过24 h转化,甘油到1,3-PD的转化率可达0.51 mol/mol,转化率较高。这种将3-HPA流向其他途径的方式不仅降低了3-HPA对细胞的毒性,使细菌代谢正常有序地进行,而且为3-HP和1,3-PD的联产提供了参考。
4 生物转化中的副产物与应对策略
副产物的形成和维持氧化还原平衡是1,3-PD生产中的又一个瓶颈。如图1所示,在甘油的歧化过程中,除1,3-PD外可产生多种代谢产物如乙酸、琥珀酸、乳酸、丁酸等,这些物质成为1,3-PD生产中的主要副产物。在甘油氧化分支,甘油经几个ATP依赖的氧化还原酶催化,转化为磷酸烯醇式丙酮酸 (PEP)。同时,在糖酵解代谢途径中,葡萄糖也会转化为PEP。以上生成的PEP可由丙酮酸激酶转化为丙酮酸,生成一系列副产物。许多因素可以影响这一过程,如外部条件和遗传条件等[45]。因此,改变其中的任何一个环节,这些副产品的质量和数量都将受到影响。这些副产物的形成会消耗甘油或葡萄糖中的碳,从而导致流向其他产物的碳减少,使1,3-PD的产量下降[46]。另外,这些副产物对细胞的生长也有抑制作用。因此,利用基因工程的手段,通过敲除相关基因来降低这些副产物的生成是一个较好的应对策略。然而,这些途径可以调节细胞内氧化还原力的平衡,因此,在敲除这些相关基因时,应保持氧化还原电位以满足目标代谢反应的正常运转。要避免不必要的代谢产物的产生,同时需保持氧化还原力的平衡,这对提高1,3-PD产量也是一个挑战。在保证其氧化还原力的前提下,研究者们主要采取以下方法来降低副产物的形成。
4.1 与DHA或DHAP相关的基因敲除
GDH是由基因编码的,需要辅酶NAD+的参与,可将甘油氧化为DHA;DHAK是由基因编码的,参与催化DHA的磷酸化,生成DHAP。这是甘油氧化分支的第一步。阻断1,3-PD的生物生产中副产物生成的途径,最直接的是敲除与DHA和DHAP合成相关基因。Horng等[47]利用同源重组将中的和基因敲除,命名为TC100,采用的方法是将操纵子中的-基因中插入一段链霉素抗性基因,以便后续重组子的筛选。利用重组的TC100在50 mL三角瓶进行1,3-PD的摇瓶发酵,实验表明,在37 ℃下孵育48 h后,相比于野生菌株,TC100的产量增加了1.06倍;副产物如乳酸、2,3-丁二醇、乙醇均未检出。然而,这一突变菌株与野生菌株相比细胞的生长状况较差,生 物量少,生产1,3-PD的生产强度低,他们通过基因的过表达对其进行了优化,并调整了培养条件来解决这个问题,获得了较高的1,3-PD生产强度。
完全敲除甘油歧化的氧化分支来降低副产物形成方法使还原力NADH降低,导致生物量降低,反过来影响了甘油的还原分支,会对1,3-PD的生产造成一定影响。这一问题可通过割裂1,3-PD生成途径和生物量增长途径的方式来解决。Maervoet等[48]研究了的1,3-PD生产过程,利用基因工程的手段来构建DSM17579 ∆,即敲除基因,同时,利用葡萄糖作为共发酵底物,保证细菌主流代谢途径的正常运作,以增加生物量。最终使1,3-PD产量提高了1.5倍。
4.2 与丙酮酸还原相关基因的敲除
乳酸是丙酮酸的还原产物之一,每生成一个单位的乳酸,需要一个单位的NADH。它是在甘油歧化途径中从丙酮酸出发碳分流的主要产物,属于1,3-PD生产中的副产物。在细胞生长过程中,乳酸在指数期后期累积,抑制细胞生长。因此,许多研究人员通过敲除乳酸脱氢酶基因,获得乳酸缺陷突变体以抑制乳酸的合成,对1,3-PD发酵具有重要意义。Durgapal等[1]对J2B利用甘油产1,3-PD的能力进行了研究,他们构建了一个基因缺失突变体,比较野生型菌株和∆突变株在不同培养条件、不同培养模式下 (分批或补料培养) 的生长状况以及1,3-PD生成水平。当∆以补料培养方式发酵甘油时,1,3-PD的产量为58 g/L,产率为0.35 g/g,生产强度为1.3 g/(L·h)。碳流分析表明,∆突变株产生极其微量的乳酸,2,3-丁二醇 (2,3-BD) 比野生株产量高,产量为26.6 g/L,成为主要副产物。
2,3-BD也是从丙酮酸出发生成的另一个产物,成为甘油发酵生产1,3-PD中的又一个主要副产品。2,3-BD也是二醇,与1,3-PD有相似的沸点,且都与水互溶。因此,2,3-PD的这一性质导致了1,3-PD生产与纯化中一个棘手的问题[49],使获得纯度较高的1,3-PD成本大大增加[49-50]。通过敲 除合成2,3-丁二醇的编码基因,阻断其合成途 径,可以有效解决这一问题。Kumar等[2]在得到J2B ∆突变株后,为了改善2,3-BD的问题,进一步敲除了2,3-BD代谢相关的基因,包括整个bud操纵子上的、、和基因。结果表明,这种敲除完全阻断了2,3-BD的合成,不过1,3-PD的产量也下降了。他们认为,丙酮酸的大量积累是导致其产量下降的主要原因,细胞生长减慢。由于丙酮酸的积累,触发负反馈机制,导致上游产物如二羟基丙酮、3-磷酸甘油醛等的积累。GDHt活力测定表明,3-磷酸甘油醛抑制了该酶活力从而降低了1,3-PD的产量。也有其他学者研究了其他2,3-BD相关基因的敲除,如基因,该基因编码乙酰乳酸合酶,如图1所示,α-乙酰乳酸是2,3-BD的中间产物之一。Lee等[51]将中的基因敲除后,将异源的(编码丙酮酸脱羧化酶) 和(编码乙醛脱氢酶) 基因导入,减少了2,3-BD的积累,1,3-PD的产量也有一定提高。
4.3 与乙酰CoA还原相关的基因敲除
丙酮酸还原后,除了一部分流向生成乳酸和丙酮酸,还有大部分流入乙酰CoA,乙酰CoA是丙酮酸代谢过程中的重要中间产物,由丙酮酸脱氢酶催化,之后生成了更多的次级代谢物,如乙酸、乙醇和丁酸等。这些代谢物或多或少都对细菌的生长具有抑制作用,成为1,3-PD生物合成工业中的副产品[52]。目前,很多学者采取基因敲除的方法构建缺失菌株以减少这些副产物的产生,取得了较好的结果。
乙酸是抑制细胞生长的代谢产物之一。在乙酰CoA的代谢物中,乙酸对细菌的毒性最强[53]。因此,乙酸合成途径的阻断是基因工程改造的最重要的目标。Lin等[54]敲除了中乙酸合成两条途径中相关酶的编码基因、和,这些基因分别编码丙酮酸氧化酶、磷酸转乙酰化酶和乙酸激酶,并研究基因缺失菌株对细胞生长和1,3-PD生产的影响。分批发酵生产1,3-PD的最终产量达到76.8 g/L,与相同发酵条件下野生株的产量提高了15%。这些基因的缺失极大降低了乙酸的合成,使更多的碳流向TCA等代谢途径,不但增加了生物量,也提高了1,3-PD的产量。乙醇是1,3-PD形成的另一种主要产物,乙酰CoA在乙醛脱氢酶 (由基因编码) 催化下生成乙醛;之后在乙醇脱氢酶 (由基因编码) 催化下,乙醛还原成乙醇。这一过程需要消耗甘油还原途径中产生的NADH,因此许多学者同时阻断乳酸和乙醇的合成途径来提高1,3-PD产量。Chen等[55]采用λ Red重组技术对进行改造,获得2-1 ∆、2-1 ∆和2-1 ∆∆突变株。分批发酵结果表明,以上3株重组菌的副产 物浓度与原始菌株相比显著降低,1,3-PD的产量 也分别提高至85.7、82.5、87.5 g/L,而原始菌株提高至78.8 g/L。

表1 不同基因工程菌株生产1,3-PD情况比较表
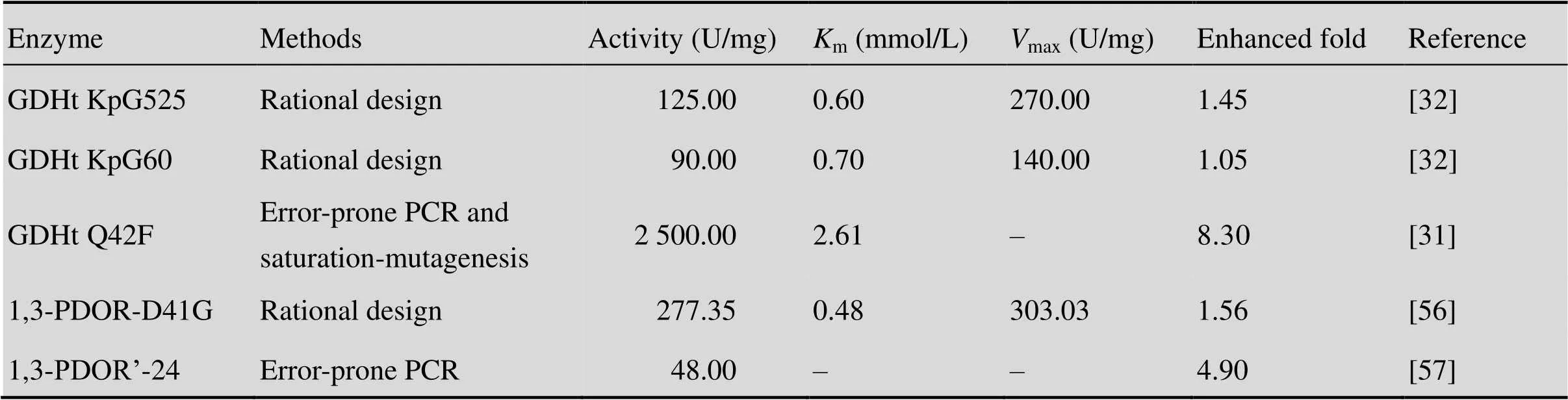
表2 不同方法改造K. pneumoniae来源关键酶的酶学数据
5 展望
利用生物柴油的副产物粗甘油进行1,3-PD的生物合成符合可持续发展的趋势。基因工程和生物技术的发展可有效解决1,3-PD生产中的局限,但是基因工程菌的潜力还有待发掘,具有较广阔的研究应用前景。首先,利用宏基因组中获得的新型相关基因构建高效基因工程菌,可进一步解决相关抑制问题。其次,上述提到的方法联合使用可以达到综合改善微生物特征的目的。此外,结合一些化学诱变、ARTP诱变、genome shuffling等育种技术,也可以最大限度地提高菌株耐受性从而提高1,3-PD的产量。再次采用更多理性、非理性或半理性的方法将1,3-PD发酵途径中的关键酶进行改造优化,可提高酶的催化活性,从而提高产量。另外,还可从发酵工艺入手,通过连续发酵或半连续发酵降低底物和产物对生产菌株的抑制作用,提高1,3-丙二醇的产量。
[1] Durgapal M, Kumar V, Yang TH, et al. Production of 1,3-propanediol from glycerol using the newly isolatedJ2B. Bioresour Technol, 2014, 159: 223–231.
[2] Kumar V, Durgapal M, Sankaranarayanan M, et al. Effects of mutation of 2,3-butanediol formation pathway on glycerol metabolism and 1,3-propanediol production byJ2B. Bioresour Technol, 2016, 214: 432–440.
[3] Otte B, Grunwaldt E, Mahmoud O, et al. Genome shuffling inDSM 15410 for improved 1,3-propanediol production. Appl Environ Microbiol, 2009, 75(24): 7610–7616.
[4] Kaur G, Srivastava AK, Chand S. Bioconversion of glycerol to 1,3-propanediol: A mathematical model-based nutrient feeding approach for high production using. Bioresour Technol, 2013, 142: 82–87.
[5] Guo Q, An YF, Yun JM, et al. Enhanced D-tagatose production by spore surface-displayed L-arabinose isomerase from isolatedPC16 and biotransformation. Biores Technol, 2017, 247: 940–946.
[6] Li XS, Zhang L, Gao DC, et al. Progress on the production of 1,3-propanediol by fermentation. Chem Ind Eng Prog, 2014, 36(4): 1395–1403 (in Chinese). 李晓姝, 张霖, 高大成, 等. 发酵法生产1,3-丙二醇的研究进展. 化工进展, 2014, 36(4): 1395–1403.
[7] Oh BR, Hong WK, Heo SY, et al. The production of 1,3-propanediol from mixtures of glycerol and glucose by amutant deficient in carbon catabolite repression. Bioresour Technol, 2013, 130: 719–724.
[8] Wang BG, Liu M, Du CY, et al. Screening ofmutation for the production of 1,3-propanediol. China Biotechnol, 2006, 26(6): 59–65 (in Chinese). 王宝光, 刘铭, 杜晨宇, 等. 产1,3-丙二醇菌株的诱变和筛选. 中国生物工程杂志, 2006, 26(6): 59–65.
[9] Dishisha T, Pereyra LP, Pyo SH, et al. Flux analysis of thepropanediol-utilization pathway for production of 3-hydroxypropionaldehyde, 3-hydroxypropionic acid and 1,3-propanediol from glycerol. Microb Cell Fact, 2014, 13: 76.
[10] Wang YP, Sun T, Gao XY, et al. Biosynthesis of platform chemical 3-hydroxypropionic acid (3-HP) directly from CO2in cyanobacteriumsp. PCC 6803. Metab Eng, 2016, 34: 60–70.
[11] Dong XY, Xiu ZL, Li S, et al. Dielectric barrier discharge plasma as a novel approach for improving 1,3-propanediol production in. Biotechnol Lett, 2010, 32(9): 1245–1250.
[12] Cui YL, Zhou JJ, Gao LR, et al. Utilization of excess NADH in 2,3-butanediol-deficientfor 1,3-propanediol production. J Appl Microbiol, 2014, 117(3): 690–698.
[13] Tsuruno K, Honjo H, Hanai T. Enhancement of 3-hydroxypropionic acid production from glycerol by using a metabolic toggle switch. Microb Cell Fact, 2015, 14(1):155.
[14] Pyne ME, Sokolenko S, Liu XJ, et al. Disruption of the reductive 1,3-propanediol pathway triggers production of 1,2-propanediol for sustained glycerol fermentation by. Appl Environ Microbiol, 2016, 82(17): 5375–5388.
[15] Przystałowska H, Zeyland J, Szymanowska- Powałowska D, et al. 1,3-Propanediol production by new recombinantcontaining genes from pathogenic bacteria. Microbiol Res, 2015, 171: 1–7.
[16] Drożdżyńska A, Pawlicka J, Kubiak P, et al. Conversion of glycerol to 1,3-propanediol byand—newly isolated strains from the enterobacteriaceae. Nat Biotechnol, 2014, 31(5): 402–410.
[17] Maervoet VET, de Mey M, Beauprez J, et al. Enhancing the microbial conversion of glycerol to 1,3-propanediol using metabolic engineering. Org Process Res Dev, 2011, 15(1): 189–202.
[18] Zhu CJ, Fang BS, Wang SZ. Bioresource Technology Effects of culture conditions on the kinetic behavior of 1,3-propanediol fermentation bywith a kinetic model. Bioresour Technol, 2016, 212: 130–137.
[19] Dong XY, Xiu ZL, Hou YM, et al. Enhanced production of 1,3-propanediol ininduced by dielectric barrier discharge plasma in atmospheric air. IEEE Trans Plasma Sci, 2009, 37(6): 920–926.
[20] Gungormusler-Yilmaz M, Cicek N, Levin DB, et al. Cell immobilization for microbial production of 1,3-propanediol. Crit Rev Biotechnol, 2015, 36(3): 482–484.
[21] Celińska E, Drożdżyńska A, Jankowska M, et al. Genetic engineering to improve 1,3-propanediol production in an isolatedstrain. Process Biochem, 2015, 50(1): 48–60.
[22] Saxena RK, Anand P, Saran S, et al. Microbial production of 1,3-propanediol: recent developments and emerging opportunities. Biotechnol Adv, 2009, 27(6): 895–913.
[23] Tan PF, Tan TW. Progress in metabolism and crucial enzymes of glycerol conversion to 1,3-propanediol. Chin J Biotech, 2007, 23(2): 201–205 (in Chinese). 田平芳, 谭天伟. 甘油歧化为1,3-丙二醇的代谢及关键酶研究进展. 生物工程学报, 2007, 23(2): 201–205.
[24] Jiang W, Wang SZ, Wang YP, et al. Key enzymes catalyzing glycerol to 1,3-propanediol. Biotechnol Biofuels, 2016, 9(1): 57.
[25] Kaur G, Srivastava AK, Chand S. Advances in biotechnological production of 1,3-propanediol. Biochem Eng J, 2012, 64: 106–118.
[26] Qi XH, Qi YL, Yun JH, et al. Research progress on the microbial fermentation of 1,3-propandiol from crude glycerol. J Food Saf Qual, 2015, 6(10): 3923–3927 (in Chinese). 齐向辉, 齐一琳, 员君华, 等. 微生物发酵粗甘油生成1,3-丙二醇的研究进展. 食品安全质量检测学报, 2015, 6(10): 3923–3927.
[27] Colin T, Bories A, Moulin G. Inhibition ofby 1,3-propanediol and diols during glycerol fermentation. Appl Microbiol Biotechnol, 2000, 54(2): 201–205.
[28] Daria SP, Piotr K. Effect of 1,3-propanediol, organic acids, and ethanol on growth and metabolism ofDSP1. Appl Microbiol Biotechnol, 2015, 99(7): 3179–3189.
[29] Zeng AP, Menzel K, Deckwer WD. Kinetic, dynamic, and pathway studies of glycerol metabolism byin anaerobic continuous culture: II. Analysis of metabolic rates and pathways under oscillation and steady-state conditions. Biotechnol Bioeng, 1996, 52(5): 561–571.
[30] Oh BR, Seo JW, Heo SY, et al. Efficient production of 1,3-propanediol from glycerol upon constitutive expression of the 1,3-propanediol oxidoreductase gene in engineeredwith elimination of by-product formation. Bioprocess Biosyst Eng, 2013, 36(6): 757–763.
[31] Qi XH, Chen YL, Jiang K, et al. Saturation-mutagenesis in two positions distant from active site of aglycerol dehydratase identifies some highly active mutants. J Biotechnol, 2009, 144(1): 43–50.
[32] Qi XH, Guo Q, Wei YT, et al. Enhancement of pH stability and activity of glycerol dehydratase fromby rational design. Biotechnol Lett, 2012, 34(2): 339–346.
[33] Papanikolaou S, Fick M, Aggelis G. The effect of raw glycerol concentration on the production of 1,3-propanediol by. J Technol Biotechnol, 2004, 79(11): 1189–1196.
[34] Kumar V, Ashok S, Park S. Recent advances in biological production of 3-hydroxypropionic acid. Biotechnol Adv, 2013, 31(6): 945–961.
[35] Guo NN, Zheng ZM, Mai YL, et al. Consequences of cps mutation ofon 1,3-propanediol fermentation. Appl Microbiol Biotechnol, 2010, 86(2): 701–707.
[36] Stevens MJA, Vollenweider S, Meile L, et al. 1,3-Propanediol dehydrogenases in: impact on central metabolism and 3-hydroxypropionaldehyde production. Microb Cell Fact, 2011, 10: 61.
[37] Qi XH, Deng WY, Wang F, et al. Molecular Cloning, co-expression, and characterization of glycerol dehydratase and 1,3-propanediol dehydrogenase from. Mol Biotechnol, 2013, 54(2): 469–474.
[38] Qi XH, Yun JH, Qi YL, et al. Expression and characterization of a novel 1,3-propanediol dehydrogenase from. Appl Biochem Biotechnol, 2016, 179(6): 959–972.
[39] Wang BG, Liu M, Du CY, et al. Recent developments in microbial metabolic engineering for the production of 1,3-propanediol. Chin J Proc Eng, 2006, 6(1): 144–149 (in Chinese).王宝光, 刘铭, 杜晨宇. 微生物法生产1,3-丙二醇过程的代谢工程研究进展. 过程工程学报, 2006, 6(1): 144–149.
[40] Yun JH, Yang MM, Magocha TA, et al. Production of 1,3-propanediol using a novel 1,3-propanediol dehydrogenase from isolatedand co-biotransformation of whole cells. Bioresour Technol, 2018, 247: 838–843.
[41] Zhu JG, Li S, Ji XJ, et al. Enhanced 1,3-propanediol production in recombinantcarrying the geneencoding 1,3-propanediol oxidoreductase isoenzyme. World J Microbiol Biotechnol, 2009, 25(7): 1217–1223.
[42] Huang ZH, Liu M, Zhang YP, et al. Improvement of 1,3-propanediol production by recombinant formate dehydrogenase in. J Chem Ind Eng, 2007, 58(4): 919–924 (in Chinese). 黄志华, 刘铭, 张延平, 等. 重组甲酸脱氢酶对合成1,3-丙二醇的促进作用. 化工学报, 2007, 58(4): 919–924.
[43] Huang ZH, Zhang YP, Liu M, et al. Expression and characterization of formate dehydrogenase gene in. Acta Microb Sin, 2007, 47(1): 64–68 (in Chinese). 黄志华, 张延平, 刘铭, 等. 甲酸脱氢酶在中的表达和功能分析. 微生物学报, 2007, 47(1): 64–68.
[44] Ashok S, Raj SM, Rathnasingh C, et al. Development of recombinantΔstrain for the co-production of 3-hydroxypropionic acid and 1,3-propanediol from glycerol. Appl Microbiol Biotechnol, 2011, 90(4): 1253–1265.
[45] Seo MY, Seo JW, Heo SY, et al. Elimination of by-product formation during production of 1,3-propanediol inby inactivation of glycerol oxidative pathway. Appl Microbiol Biotechnol, 2009, 84(3): 527–534.
[46] Abbad-Andaloussi S, Manginot-Durr C, Amine J, et al. Isolation and characterization ofDSM 5431 mutants with increased resistance to 1,3-propanediol and altered production of acids. Appl Environ Microb, 1995, 61(12): 4413–4417.
[47] Horng YT, Chang KC, Chou TC, et al. Inactivation ofandabolishes by-product accumulation during 1,3-propanediol production in. J Ind Microbiol Biotechnol, 2010, 37(7): 707–716.
[48] Maervoet VET, De Maeseneire SL, Avci FG, et al. 1,3-propanediol production withDSM17579: effect of aknock-out. Microb Cell Fact, 2014, 13(1): 70.
[49] Guo XK, Fang HY, Zhuge B, et al. Effects of knockout of 2,3-butanediol synthesis key enzyme genes on 1,3-propandediol production in. Chin J Biotech, 2013, 29(9): 1290–1300 (in Chinese). 郭欣坤, 方慧英, 诸葛斌, 等. 2,3-丁二醇代谢途径关键酶基因敲除对克雷伯氏菌发酵产1,3-丙二醇的影响. 生物工程学报, 2013, 29(9): 1290–1300.
[50] Qi XH, Zhang HH, Magocha TA, et al. Improved xylitol production by expressing a novel D-arabitol dehydrogenase from isolatedsp. JX-05 and co-biotransformation of whole cells. Bioresource Technol, 2017, 235: 50–58.
[51] Lee SM, Hong WK, Heo SY, et al. Enhancement of 1,3-propanediol production by expression of pyruvate decarboxylase and aldehyde dehydrogenase fromin the acetolactate-synthase- deficient mutant of. J Ind Microbiol Biotechnol, 2014, 41(8): 1259–1266.
[52] Jin P, Lu SG, Huang H, et al. Enhanced reducing equivalent generation for 1,3-propanediol production through cofermentation of glycerol and xylose by. Appl Biochem Biotechnol, 2011, 165(7/8): 1532–1542.
[53] Xu YZ, Guo NN, Zheng ZM, et al. Metabolism in 1,3-propanediol fed-batch fermentation by a D-lactate deficient mutant of. Biotechnol Bioeng, 2009, 104(5): 965–972.
[54] Lin J, Zhang YQ, Xu DF, et al. Deletion of,, andimproves 1,3-propanediol production by. Appl Microbiol Biotechnol, 2016, 100(6): 2775–2784.
[55] Chen LF, Ma CL, Wang RM, et al. Deletion ofandgenes into enhance 1,3-propanediol production. Biotechnol Lett, 2016, 38(10): 1769–1774.
[56] Ma CW, Zhang L, Dai JY, et al. Relaxing the coenzyme specificity of 1,3-propanediol oxidoreductase from, by rational design. J Biotechnol, 2010, 146(4): 173–178.
[57] Wei J, Yuan Z, Wang SZ, et al. Directed evolution and resolution mechanism of 1,3-propanediol oxidoreductase fromtoward higher activity by error-prone PCR and bioinformatics. PLoS ONE, 2015, 10(11): e0141837.
(本文责编 郝丽芳)
Bottlenecks and modification strategies of 1,3-propanediol biosynthesis from glycerol
Miaomiao Yang*, Junhua Yun*, Huanhuan Zhang, Guoyan Zhang, Hossain Zabed, and Xianghui Qi
School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, Jiangsu, China
Crude glycerol is the main by-product of biodiesel production. A few microorganisms can transfer crude glycerol to 1,3-propanediol (1,3-PD) that is an important chemical material. There exist many limitations such as substrate inhibition, product inhibition when wild strains are used in 1,3-PD biosynthesis. In this review, based on the microbial transformation of 1,3-propanediol from glycerol and its limitations, some strategies using genetic engineering such as knockout or gene overexpression were summarized. The latest research progresses in biosynthesis of 1,3-propanediol from glycerol by genetically engineered strains are discussed.
glycerol, 1,3-propanediol, bioconversion, biosynthesis, genetic engineering
December 25, 2017;
February 28, 2018
National Natural Science Foundation of China (No. 31571806), National Key Research and Development Program (No. 2017YFC1600806), China Postdoctoral Science Foundation (No. 2017M621657), High-level Talents Project of Six Talent Peaks in Jiangsu Province (No. SWYY-018).
Xianghui Qi. Tel: +86-511-88797059; Fax: +86-511-88780201; E-mail: qxh@ujs.edu.cn
*These authors contributed equally to this work.
国家自然科学基金 (No. 31571806),国家重点研发计划(No. 2017YFC1600806),中国博士后基金 (No. 2017M621657),江苏省“六大人才高峰”项目 (No. SWYY-018) 资助。
2018-03-26
http://kns.cnki.net/kcms/detail/11.1998.Q.20180326.0836.001.html
10.13345/j.cjb.170516
