鮸鱼鱼鳔多糖对四氯化碳引起的急性肝损伤的保护作用
2018-07-30葛雪筠周德健
葛雪筠,周德健,王 斌,陈 荫
(浙江海洋大学食品与医药学院,浙江 舟山 316022)
鮸鱼(nibecroaker),一作米鱼,敏子、敏鱼,属于鲈形目石首鱼科[1],中国有着悠久的鱼鳔食用历史,北魏时期的贾思勰所著《齐民要术》中就有加工食用石首鱼鳔的记载。到了唐朝,鱼鳔成为了贡品。在《新唐书·地理志》中记载:吴郡每年贡“压胞(鱼鳔)七斤”。而后到了清朝,鱼鳔列为补品。富有胶质的鱼鳔,与鱼翅、燕窝齐名,是“海洋八珍”之一,有“海洋人参”之誉。鱼鳔不仅是筵席名菜,更是有很高的滋补作用和药用价值,如滋阴养血、止血补血、补肾益精等[2]。现代研究表明鱼鳔的主要营养成分为高级胶原蛋白、粘多糖、多种维生素及钙、锌、铁、硒等多种微量元,蛋白质含量在80%以上,含有较低的而脂肪,是目前最理想的高蛋白低脂肪的食品[3]。多糖是鱼鳔中的有效活性物质之一,虽在鱼鳔中含量低但具有极高的研究价值。目前国内研究鮸鱼鱼鳔多为胶原蛋白及其活性[4-5],而对于鱼鳔多糖研究的甚少,故本实验研究探索了鱼鳔多糖(polysaccharide of swim bladder innibecroaker,PSB)的提取方法、单糖组成等理化性质及对小鼠急性肝损伤的保护作用,为进一步开发和研究鮸鱼鱼鳔中的营养成分提供了一定的理论依据。
1 材料与方法
1.1 材料与试剂
鮸鱼(购于舟山鱼市场);联苯双酯(浙江医药股份有限公司新昌制药厂);橄榄油;丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)、总超氧化物歧化酶(SOD)、总一氧化氮合成酶(NOS)测试盒,均购于南京建成生物科技有限公司;四氯化碳(CCl4)、多聚甲醛、单糖标准品(甘露糖、氨基葡萄糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、氨基半乳糖、葡萄糖、半乳糖、木糖)(中国药品生物制品检定所),胰蛋白酶(酶活≥50 000,上海源聚生物科技有限公司)、胃蛋白酶(酶活1∶3 000,国药集团化学试剂有限公司)其余试剂均为国产分析纯。
1.2 动物、仪器与设备
SPF级♂ICR小鼠,体重(22±2)g,购于浙江省医学科学院。许可证号:SCXK(浙)2014-0001。恒温水浴锅 HH-1 国华电器有限公司;酶标仪 iMark;高速离心机 TGL-16M (上海卢湘仪仪器有限公司);冷冻干燥机(美国LABCONCO FreeZone); 1260型高效液相色谱仪(美国Agilent公司);小鼠普通饲料等。
1.3 鱼鳔多糖提取方法
将市场购买的大小相仿的鮸鱼经解剖取出鱼鳔,用剪刀剪至数段后,用2倍体积丙酮浸泡,期间反复的搅拌进行脱脂。将脱脂完全后的鱼鳔置于干燥箱中45 ℃烘干。取干燥后的鱼鳔30 g经粉碎机粉碎过100目筛后置于烧杯中,并加入30倍体积的蒸馏水。然后首先用冰醋酸调节pH至4.5后加入4%胃蛋白酶,37 ℃下提取2 h后再用0.1 mol·L-1NaOH调节pH至8后加入4%胰蛋白酶[6],37 ℃下提取2 h,最后用冰醋酸调回至中性,再升温至80 ℃提取1 h将酶灭活。将得到的水提物于8 000 r/min高速离心机离心20 min后留上清液。残渣按上述提取方法再重复提取一次。合并两次所得上清液,经50℃旋转蒸发仪浓缩至原体积的1/10,加入4倍体积无水乙醇醇沉过夜,然后醇沉物再经过Sevege法反复脱除蛋白,经透析袋(截留分子量3 500 Da)流水透析72 h后,冷冻干燥即得1.5 g淡黄色粉末状鱼鳔多糖。
1.4 单糖组成分析
多糖的完全酸水解[7]准确吸取1.0 mL 2 mol/L 的三氟乙酸(Trifluoroacetic acid, TFA)滴入装有5.0 mg的多糖样品的安瓿管中,然后经酒精喷灯封管后置于105 ℃烘箱内水解反应 8 h。水解反应完全后将样品用甲醇溶解并转移到鸡心瓶内,用甲醇反复旋蒸以除去样品中TFA,最后转移至 离心管中40 ℃烘箱烘干备用。
标准品溶液的配制 干燥至恒重的等摩尔的10种单糖标准品,加入纯水充分溶解,配制成1.0 mg/mL的溶液。采用PMP柱前衍生高效液相色谱法[8]对等摩尔配制的单糖标准品溶液和多糖完全水解后产物进行衍生,最后进行高效液相色谱分析。
色谱条件 色谱柱:KP-C18色谱柱(4.6 mm×150 mm,5 μm);流动相:PBS(pH=6.7):乙腈=82∶18(V/V);流速:1 mL/min;柱温:30 ℃;进样量:20 μL;检测器:紫外检测器(254 nm)。
1.5 总糖含量测定
以甘露糖为标准品,采用硫酸-苯酚法测定总糖含量[9]。
1.6 硫酸基含量测定
采用氯化钡-明胶比浊法测定[10]。
1.7 分子量测定
采用高效凝胶渗透色谱法(HPGPC)测定。色谱条件:色谱柱:Shodex Ohpak SB-804HQ凝胶色谱柱(300 mm×7.8 mm);柱温:35 ℃;流动相:0.1 mol/L的Na2SO4;流速:0.5 mL/min;检测器:示差检测器(RID)[11]。以标准葡聚糖分子量的对数(logMw)对色谱保留时间(tR)作图,得标准曲线,计算样品分子量。
1.8 动物分组给药
共计60只雄性小鼠,随机分为组,分别标记为药物组(高剂量组、中剂量组、低剂量组)模型组、阳性对照组和正常组共6组。置于校动物房内饲养(室温22~25 ℃,湿度45%~60%)。正常饲养3日后,于每日固定时间11点进行灌胃,其中正常组和模型组分别灌以生理盐水0.4 mL;高、中、低分别灌以200、100和50 mg/(kg·d)的PSB0.4 mL;阳性对照组则灌以0.4 mL的联苯双酯溶液。正常给予饲料、水和光照。连续喂养15 d,在末次给药1 h后,除正常组灌以纯橄榄油外,其余五组小鼠分别灌以0.8% CCl4-橄榄油混合液0.4 mL。造模后禁食不禁水,于12 h后进行摘眼球取血,并制备血清。测定血清中AST、ALT和GSH-PX的活力;取出肝脏,其中每组选取一部分肝脏溶于4%多聚甲醛溶液[12]用来制作肝脏病理组织切片,其余保存于-80℃超低温冰箱内,为制备10%肝脏组织匀浆液[13]用来测定SOD、MDA和NOS含量做准备。
1.9 光学显微镜检查
4%多聚甲醛固定的肝脏组织经脱水、石蜡包埋,苏木-伊红染色后,在光学显微镜下观察肝脏组织的形态变化,并拍照记录。
1.10 指标检测方法和数据处理
血清中ALT、AST和GSH-PX,肝脏匀浆液的MDA、SOD和NOS得测定方法,均参照南京建成测试盒提供的方法。使用SPSS11.5对所得数据进行统计学处理和分析。
肝脏指数=肝脏质量(mg)/小鼠体重(g)。
2 结果与分析
研究表明联苯双酯具有很强的抗氧化作用,能够抑制肝脏的脂质过氧化反应,稳定肝细胞膜表面结构,保护肝组织的结构免受如CCl4等各种致病因子的损伤,明显的抑制肝细胞中AST和ALT的释放[14]。故本实验的阳性对照组选取了联苯双酯作为参照,用来评价PSB对肝脏的保护能力。
2.1 单糖组成分析
根据单糖标准品对比可知,鱼鳔多糖由6种单糖组成,分别为甘露糖、氨基葡萄糖、葡萄糖醛酸、氨基半乳糖、葡萄糖和半乳糖组成,其比为1.4∶1.2∶0.5∶2.0∶0.1∶0.1。通过单糖组成对比可知,鮸鱼鱼鳔多糖应该也属于海洋类糖胺聚糖,氨基半乳糖的比例相对要更高,但是缺乏海洋低等动物中常见的岩藻糖。
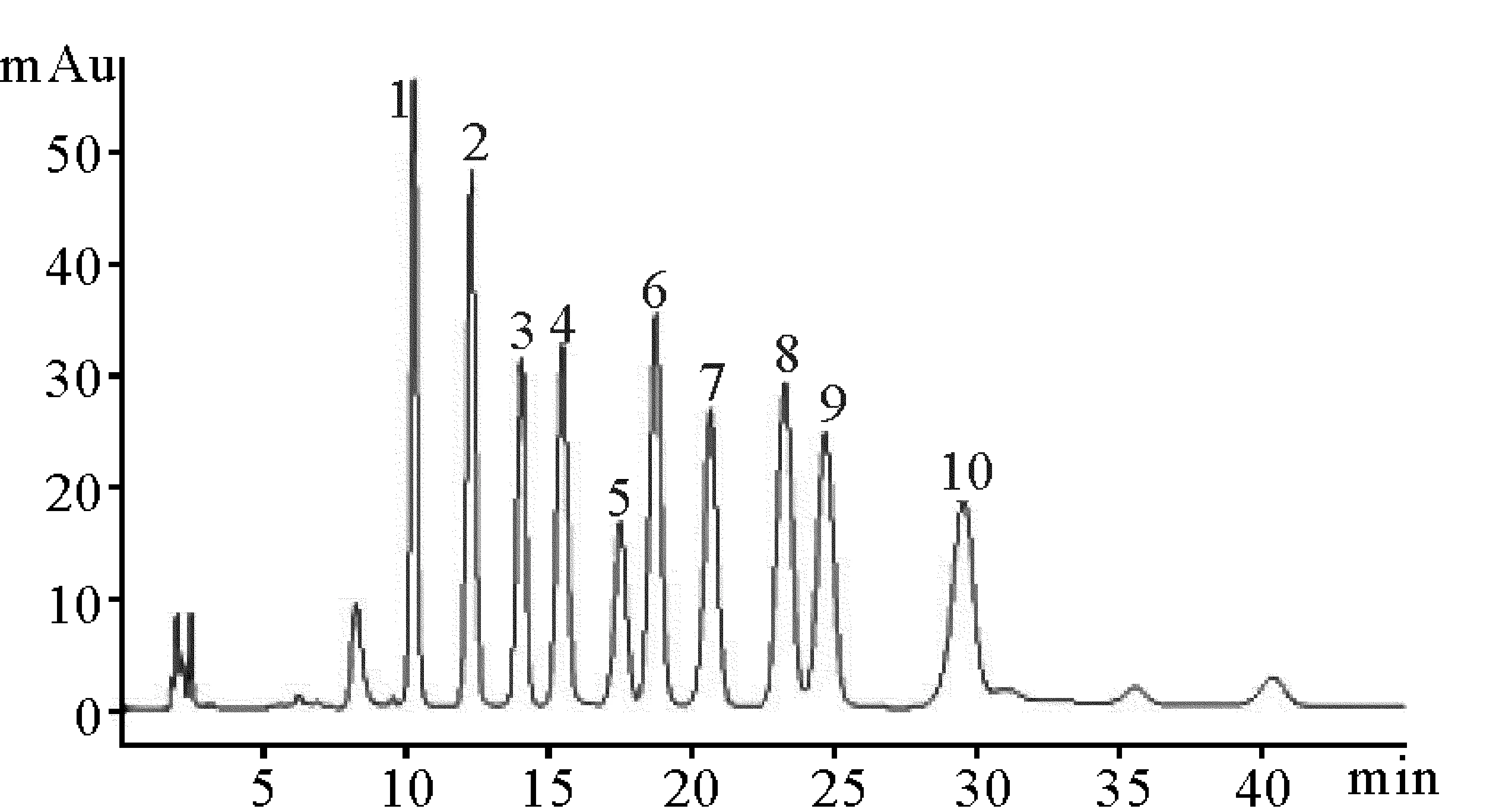
(1.甘露糖mannose;2.氨基葡萄糖glucosamine;3.鼠李糖rhamnose;4.葡萄糖醛酸glucuronic acid;5.半乳糖醛酸galactolic acid;6.氨基半乳糖galactose;7.葡萄糖glucose;8.半乳糖galactose;9.木糖xylose;10.岩藻糖fucose.)
图1 单糖标准品的PMP柱前衍生液相色谱图
Fig.1 HPLC chromatogram of the PMP pre-column derivative standard monosaccharides
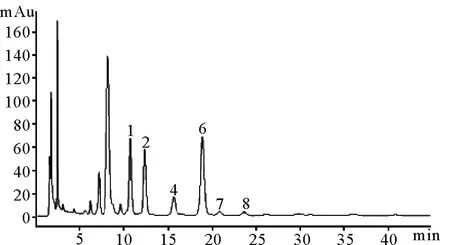
图2 PSB的PMP柱前衍生液相色谱图Fig.2 HPLC chromatogram of the PMP pre-column derivative PSB
2.2 总糖含量和硫酸根含量
根据标准曲线计算可知PSB总糖含量为52.4%,硫酸基含量为14.5%。
2.3 分子量测定
利用高效凝胶色谱法,测定纯度的同时根据已知分子量的标准品(6.1,9.6,21,47.1,107和194 kD,)的出峰时间即可推算出多糖的分子量。由PSB的高效凝胶色谱图3可看出,PSB的出峰且呈现单一对称狭窄的峰,表明PSB分子量均一,根据标准曲线y=-0.331 7x+9.840 4计算可知PSB的分子量为89.7 kDa。
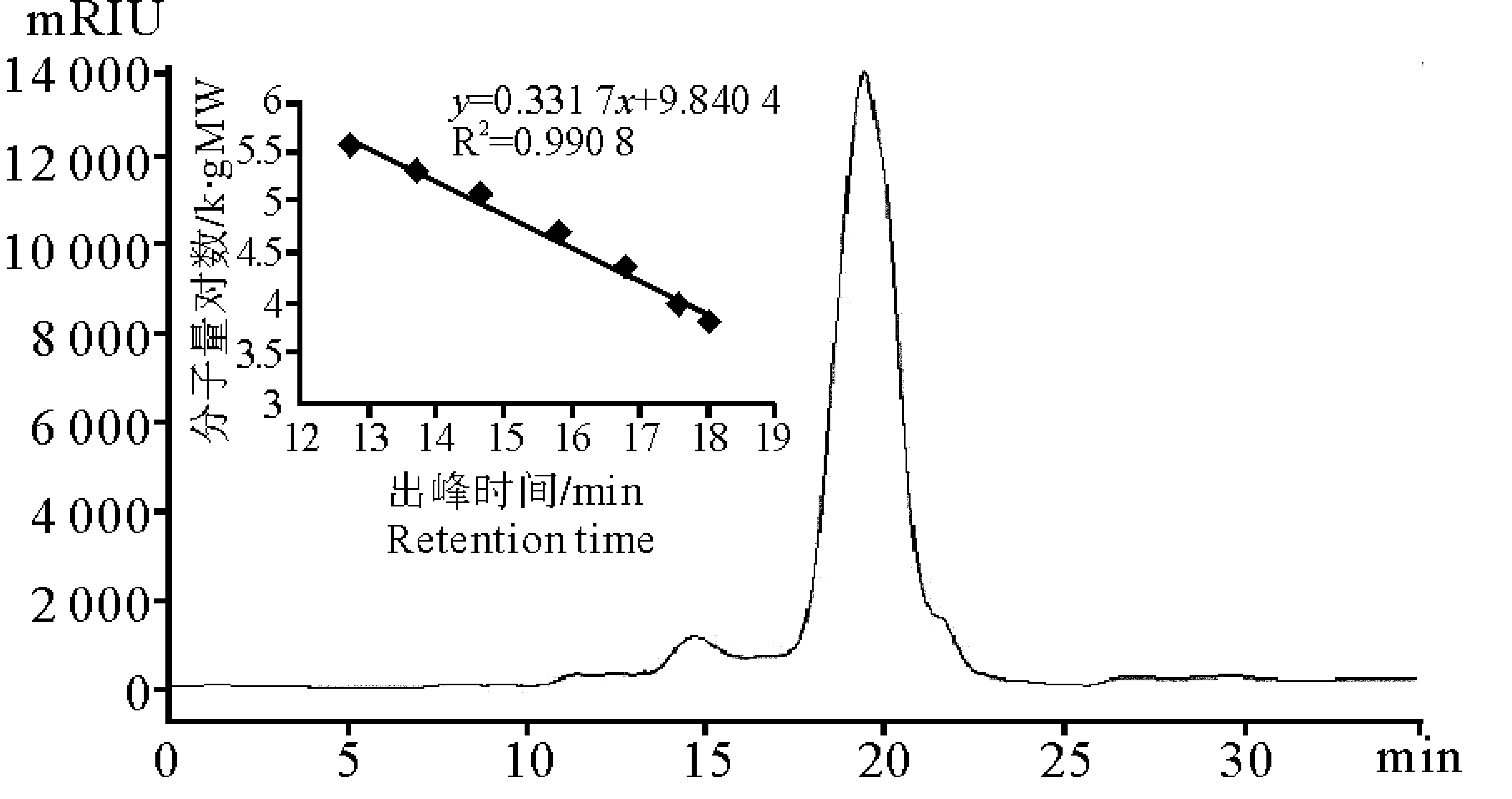
图3 PSB的高效凝胶色谱图Fig.3 HPGCP chromatogram of PSB
2.4 PSB对CCl4诱导小鼠急性肝损伤的作用
2.4.1 PSB对CCl4诱导小鼠急性肝损伤肝脏指数的影响 肉眼观察模型组小鼠肝脏组织与正常肝脏组织对比肝脏表面出现不同程度的紫色瘀斑和肿大;药物组中随着鱼鳔多糖质量浓度的增加肝脏肿胀程度出现明显减轻。且综合表1可以看出,与正常组小鼠肝脏指数相比,模型组肝脏指数显著增大(P<0.01),说明造模成功。除低剂量组外,药物组与模型组对比,肝脏指数均显著下降(P<0.05或P<0.01)。阳性药物组与模型组相对比肝脏指数也明显的降低。由此说明鱼鳔多糖能够有效的抑制小鼠出现肝脏肿大,其效果接近于阳性药物组。
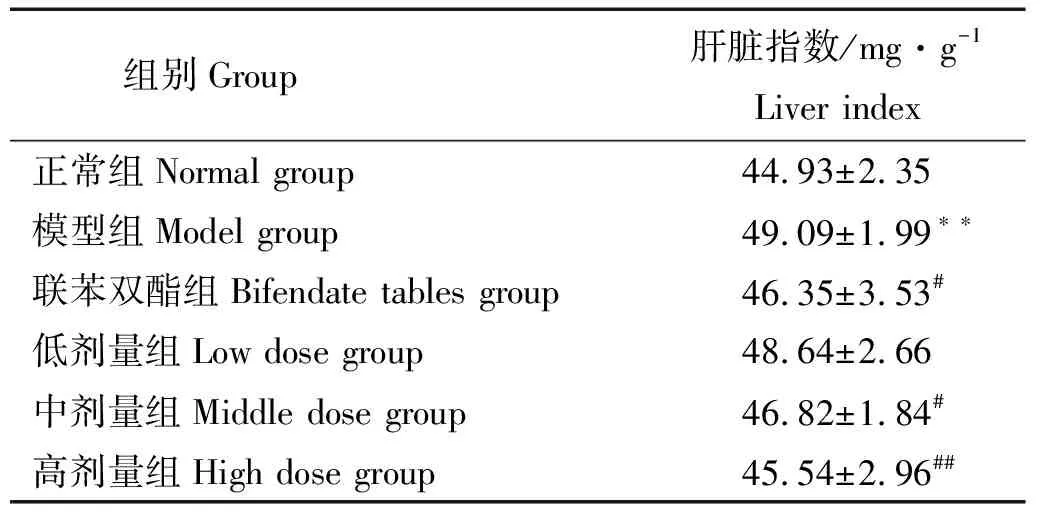
表1 PSB对CCl4致小鼠急性肝损伤肝脏指数的影响(x±s,n=10)Table 1 Effect of PSB on liver index of mice suffering from CCl4-induced acute liver injury
注:*与正常组相比P<0.05,**与正常组相比P<0.01;#、##与模型组相比P<0.05和P<0.01,下同。
Note:*meansP<0.05 compared with the normal group,**meansP<0.01 compared with the normal group;#,## meansP<0.05 andP<0.01 compared with model group,respectively,the same bellow.
2.4.2 PSB对CCl4诱导致急性肝损伤小鼠血清ALT、AST和GSH-PX的影响 由表2可知,模型组ALT、AST和GSH-PX的活力与正常组相比显著升高(P<0.01)。且高剂量组效果与联苯双酯组对比效果接近;与模型组对比高剂量与中剂量药物组显著降低AST活力(P<0.01);与模型组对比高、中、低剂量组的GSH-PX含量显著升高(P<0.01),且高剂量与中剂量均接近联苯双酯组,说明随着鱼鳔多糖质量浓度的增加保护肝脏的程度也随着增强。
2.4.3 PSB对CCl4诱导致急性肝损伤小鼠肝脏MDA、SOD和NOS的影响 由表3可知,模型组小鼠肝脏MDA含量相比于正常组显著升高(P<0.01),而SOD和NOS含量显著降低(P<0.01)。药物组肝脏中MDA含量相对于模型组皆显著降低(P<0.01),肝脏中SOD和NOS含量相比于模型组含量显著升高(P<0.01)。说明PSB对于肝脏有一定的保护作用,效果接近阳性药物组。
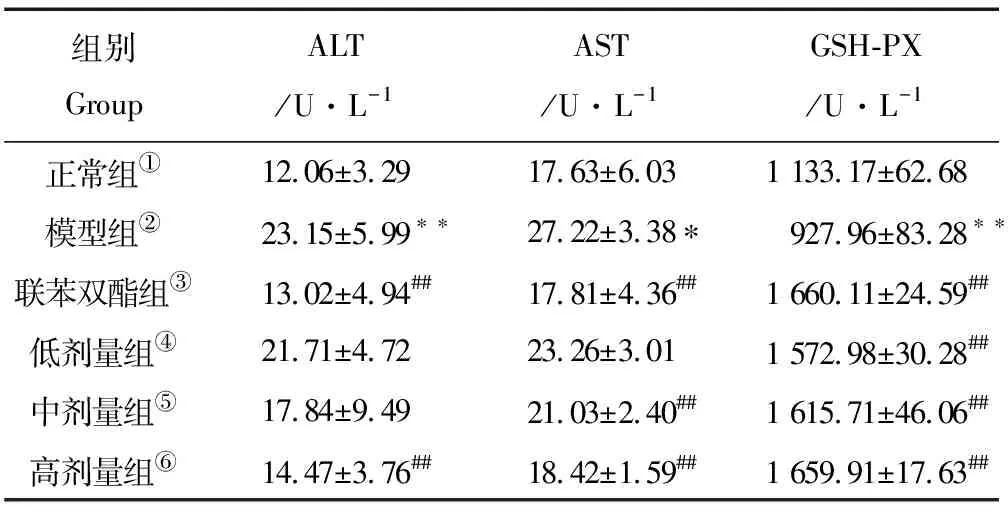
表2 PSB对CCl4诱导致急性肝损伤小鼠血清ALT、AST和GSH-PX的影响(x±s,n=10)Table 2 Effect of PSB on ALT、AST and GSH-PX of serum from CCl4-induced acute liver injury
Note:①Normal group;②Model group;③Bifendate tables group;④Low dose group;⑤Middle dose group;⑥High dose group
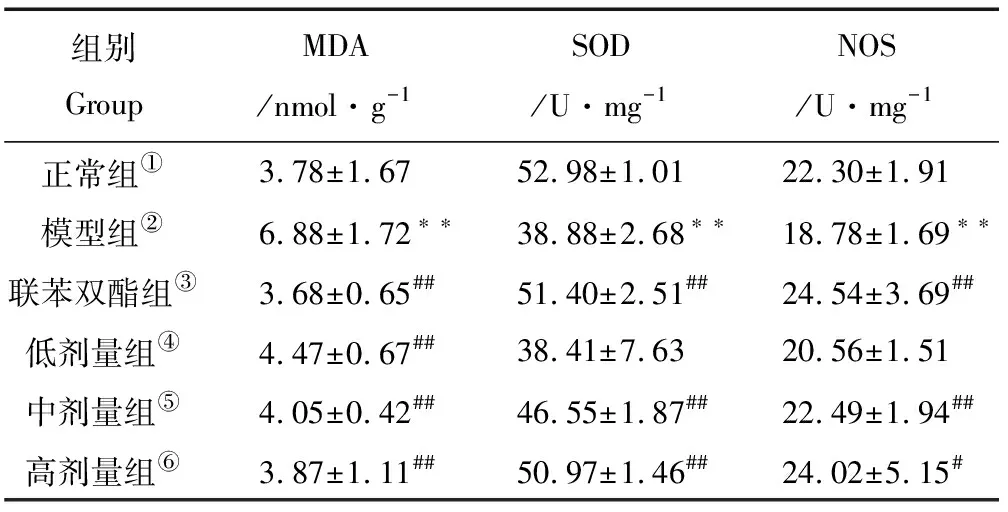
表3 PSB对CCl4诱导致急性肝损伤小鼠肝脏MDA、SOD和NOS的影响(x±s,n=10)Table 3 Effect of PSB on MDA、SOD and NOS of liver from CCl4-induced acute liver injury
Note:①Normal group;②Model group;③Bifendate tables group;④Low dose group;⑤Middle dose group;⑥High dose group
2.5 PSB对CCl4诱导致急性肝损伤小鼠肝脏组织的形态学变化
由图4可知,在光学显微镜下A组正常小鼠细胞中央静脉周围肝索排列整齐,如图箭头所指:细胞核大小正常、居中,可见少量双核细胞存在,未见细胞变性、坏死及炎性细胞浸润;B组模型组肝小叶模糊中央静脉附近出现大片的细胞坏死,且细胞核消失,发生气球样变性等; C、D和E药物组肝小叶界限模糊不清,但坏死区域明显减少,有炎性细胞侵润,且随着鱼鳔多糖PSB质量浓度的增加,呈现一定的量效关系;F组阳性药物组细胞未见坏死区域,且细胞核大小正常居中,可见双核细胞如箭头所示,细胞形态接近于正常组。
2.6 讨论
由于肝脏是机体重要的代谢器官,具有分泌、排泄和生物转化等功能,在糖类、脂类及蛋白质三大代谢过程中起着重要作用[15]。一旦肝脏出现损伤,机体的整个物质代谢将发生紊乱,继而能够影响到其它器官的功能,甚至出现生命危险。
CCl4作为是一种常用的化学性肝损伤诱导剂,其诱导所致的小鼠出现的肝损伤表现的症状及病理改变特征等与真实的病毒性肝炎类似[16-18]。当肝细胞受到损害时,肝细胞内ALT和AST就会渗入到血液中,使得血清中AST和ALT活性升高[19]。联苯双酯作为我国独立开发的一种肝脏保护药物,在临床上显示其具有显著的降低肝脏转氨酶作用,具有良好的保肝效果。综上可知在肝脏的急性损伤方面,联苯双酯确实表现出了明显的保护作用,在ALT和AST活性方面其效果接近于正常组。而鱼鳔多糖组与模型组相比随着浓度的增加,血中AST和ALT活性显著降低,说明鱼鳔多糖具有一定的保护肝脏的作用;谷胱甘肽过氧化物酶(GSH-Px)能催化GSH变为GSSG是机体内广泛存在的一种重要的过氧化物分解酶,使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2的分解,并消耗体内GSH保护细胞膜的结构及功能免受过氧化物的干扰及损害[20-21],在实验中可见鱼鳔多糖组可以显著地提高小鼠血液中的GSH-PX的含量,且受鱼鳔多糖的浓度影响。

(A.正常组normal group;B.模型组model group;C.低剂量组low dose group;D.中剂量组middle dose group;E.高剂量组high dose group;F.联苯双酯组 bifendate tables group.)
图4 PSB对CCl4诱导小鼠肝脏组织形态改变(HE,x100)
Fig.4 Effect of PSB on hepatic histopathological changes in mice suffering from CCl4-induced acute liver injury(HE,x100)
自由基和脂质过氧化是引发肝损伤重要因素[22-23],而MDA是脂质过氧化产物,其含量的变化可反映肝细胞的损伤程度[24]。在实验结果中可知模型组相比于正常组MDA的含量显著地提高,说明肝脏受到了一定的损害,造模成功,而鱼鳔多糖组随着浓度的增加可以显著地降低肝脏组织中的MDA含量,从而有效的保护了肝脏免受损害;SOD能够有效清除生物氧化产生的氧自由基是机体内重要的抗氧化酶,从而防止自由基对细胞结构的损伤,其活力的大小可以反映了机体抗氧化和清除自由基的能力[25]。由本实验结果可知联苯双酯组和鱼鳔多糖除低剂量药物组外能都够显著的升高体内SOD的含量,且呈现一定的量效关系;NOS可以参与调节NO生成,是一种一氧化氮合成的限速酶,现已认识到NO不仅是一个有细胞毒性效应器作用的分子,也是组织损伤的诱发因子和各种病变的增强因子,从而能够维持正常的生理功能[26-27],由本实验结果可知,除低浓度PSB组外,其余各组都能显著提高小鼠体内NOS的含量。各指标结合肝脏组织切片,可以看出随着PSB浓度的增加,呈现一定的量效关系。
3 结语
综合以上研究结果,鮸鱼鱼鳔多糖PSB总糖含量为52.4%,硫酸基含量为14.52%。由甘露糖、氨基葡萄糖、葡萄糖醛酸、氨基半乳糖、葡萄糖和半乳糖组成,分子量为89.7 kDa是一种富含氨基糖和糖醛酸的硫酸化杂多糖。目前海洋鱼类鱼鳔多糖还没有研究过,但是海洋动物多糖如扇贝多糖,海参多糖等研究较多。海洋动物多糖主要含有葡聚糖和杂多糖或类糖胺聚糖[28],通过单糖组成可知,鮸鱼鱼鳔多糖应该也属于海洋类糖胺聚糖,氨基半乳糖的比例相对要更高,但是缺乏海洋低等动物中常见的岩藻糖。且PSB中含有一定量的硫酸基团表明其为部分硫酸化的多糖,而硫酸化修饰也符合了海洋动物多糖的特征[29-30]。
在抗肝损伤的实验中,不论从小鼠血清和肝脏组织的生化指标检测,还是从肝脏组织切片病理学观察来看,都可以看出鮸鱼鱼鳔多糖PSB对CCl4诱导所致的小鼠肝急性损伤具有一定的保护作用,随着鱼鳔多糖质量浓度的增加,肝损伤程度随之降低,说明鱼鳔多糖对小鼠肝脏的保护程度与其剂量有一定相关性。而对于PSB对小鼠肝脏的保护机理,则需要进行更深一步的去研究,同时本文也为以后进一步的研究鮸鱼鱼鳔多糖提供了一定的理论基础。
