牡蛎源菌株蛋白酶共价固定及其防污性能评价
2018-07-30李跃瑞于良民蔺存国
王 利,李跃瑞,于良民,蔺存国
(1.中国海洋大学,化学与化学工程学院,山东 青岛 266100;2.中国船舶重工集团公司第七二五研究所,海洋腐蚀与防护国防科技重点实验室,山东 青岛 266101)
海洋生物污损是指海水环境中污损生物在结构物表面的聚集与附着,以及由此带来的不良影响。海洋生物污损会增加船舶航行阻力和燃油消耗,降低海水冷却系统热交换效率,加快金属材料腐蚀,对海洋设施和平台等造成严重危害,因此采取措施防除海洋生物污损具有重要意义。在海生物污损防除方法中,涂刷防污涂料是最为经济有效的方法之一。有机锡类防污剂因严重危害海洋生态环境,《控制船舶有害防污底系统国际公约》已完全禁止有机锡防污剂的使用[1]。
目前市场上以氧化亚铜类防污涂料为主,但由于铜元素可在海港富集,同样危害生态环境,也面临限用和禁用趋势。因此,开发新型对环境友好、高效的防污材料势在必行。
依靠良好的环境友好性和高效的防污性能,酶基防污技术逐渐发展为氧化亚铜、生物杀生剂等毒杀型传统防污方法的重要替代技术之一[2-6],而蛋白酶基于对污损生物黏附物质良好分解作用,已成为酶基防污涂料中关键防污活性酶之一。Leroy[5,7]和Mariana[8]等研究了固定化枯草杆蛋白酶的防污性能,发现枯草杆菌蛋白酶能够减少石莼孢子,硅藻和细菌的附着,有效降低硅藻的黏附强度,清除已附着细菌。Peres等[9]用含有木瓜蛋白酶涂层在地中海做了为期七个月的测试,发现木瓜蛋白酶具有优良的防污作用。Nick Aldred研究发现丝氨酸蛋白酶对藤壶分泌的胶质有明显的降解作用。
由于酶的活性及其稳定性受到诸如海水温度、pH值等海洋环境参数的影响,游离的酶在水溶液中的稳定性较差,容易发生自消化反应,使酶催化反应难以控制,催化效率下降;另外防污酶中的蛋白酶除了能催化降解污损生物黏附蛋白质,也能催化降解其他的酶。因此,防污酶在应用过程中须通过载体材料包封以使之彼此隔离,即进行酶的固定化处理。防污酶的固定化,使水溶性酶脱离溶液环境,极大提高了酶的稳定性,并使酶在一定的空间范围内进行催化反应和重复利用,避免了酶的释出、流失,从而发挥防污酶持久、高效的催化水解作用[10]。因此防污酶的固定化是酶基防污涂层技术发展中的重要环节。
酶固定化载体主要分为无机载体和有机载体两大类,在酶基防污涂层中,无机纳米载体由于具有比表面积高,载酶量大[11-12]和易于在涂层中应用等优点而占据比较突出的位置。目前已有多种无机纳米材料用于酶的固定,例如双层氧化碳纳米管[13]、纳米二氧化钛[14]、纳米磁性粒子[15-17]、金纳米颗粒[18]等。此外,纳米二氧化硅由于价格低廉、易于制备、结构稳定,并可以提高涂层硬度、抗冲击性和耐磨性等机械性能而备受关注。
海洋环境是具有防污活性天然产物的重要来源,包括酶类物质[19],大多数产出蛋白酶、淀粉酶和脂肪酶的细菌多从海水中分离获取[20],直接从大型污损生物表面的生物膜分离菌株获取防污酶的研究相对较少。研究表明,典型污损生物藤壶、贻贝等的甲壳分解现象与细菌产生的酶类物质直接相关[21],因此污损生物外壳生物膜中细菌产出的酶类物质对于海洋防污具有积极的作用。
基于上述原因,本文选取一种从牡蛎外壳生物膜中分离获取的菌株产生的蛋白酶[22]作为固定化与防污性能评价研究对象,以正硅酸乙酯为原材料,采用反相乳液聚合法制备了活性表面纳米二氧化硅微球(NPSiO2)作为蛋白酶固定化材料,并通过共价结合法对防污蛋白酶进行固定化。将固定化酶通过丙烯酸树脂黏附于载玻片表面制备出测试样片,通过贻贝足丝附着实验和底栖硅藻的附着与脱除实验测试了防污性能。
1 材料与方法
1.1 药品与仪器
药品 3-氨丙基三乙氧基硅烷(APTES),正硅酸乙酯(TEOS),氨水(28%),戊二醛(50%),环己烷,正己醇,曲拉通X-100,福林酚试剂等,以上试剂均从上海麦克林生化科技有限公司购得,牡蛎源菌株蛋白酶为自制。
仪器 离心机(TGL-20M)、紫外分光光度计(日立,U-2800)、场发射扫描电镜(日本,ULTRA55)、傅里叶红外光谱仪(美国,NICOLET 8700)、真空冷冻干燥机(ALPHA2-4/LD-PLUS)、生物附着强度测试系统[23](自制)。
1.2 载体制备
采用Dandavate等人的方法[24],向2 000 mL三口瓶中加入500 mL环己烷,120 mL正己醇及118 mL曲拉通X-100,搅拌5 min至澄清,然后缓慢加入22.6 mL超纯水作为分散相,继续搅拌30 min,形成透明稳定的反相微乳液,随后再加入6.67 mL正硅酸乙酯及2 mL氨水,在室温下连续搅拌24 h,用无水乙醇破乳,在10 000 r/min下离心10 min收集二氧化硅纳米颗粒,再用无水乙醇清洗5次,在真空干燥箱中60 ℃下干燥6 h,得到纳米二氧化硅微球(NPSiO2)。
1.3 蛋白酶的固定化
将NPSiO2分散于含有一定量APTES的甲苯中,超声分散形成悬浊液,然后于80℃下搅拌回流6h,使得NPSiO2表面氨基化,离心收集,用无水乙醇清洗3次。
将氨基化NPSiO2超声分散于一定量的磷酸盐缓冲液中,通入氮气,并加入戊二醛至浓度为分散体系的0.5%,在40 ℃下搅拌2 h,离心去除上清液,再用磷酸盐缓冲液清洗3次,除去残余戊二醛。将经戊二醛交联处理过的硅纳米颗粒分散在磷酸盐缓冲液中,加入一定量的蛋白酶溶液,在30 ℃下搅拌6 h。所制样品通过磷酸盐缓冲液清洗3次,然后通过真空冷冻干燥机冷冻干燥,得到固定化蛋白酶。
1.4 NPSiO2与固定化蛋白酶的表征
通过场发射扫描电镜观察NPSiO2、NPSiO2-P形貌并分析粒径;通过Zeta电位仪测定NPSiO2及固定化酶的Zeta电位,通过傅立叶变换红外光谱仪(IR)分别测试NPSiO2、氨基化NPSiO2、戊二醛处理NPSiO2及固定化酶的基团特征,分析蛋白酶的共价固定情况。
1.5 固定化蛋白酶活性测试
采用福林酚法测试固定化蛋白酶活性。首先将固定化酶加入到1 mL缓冲液中,置于35 ℃恒温水浴中预热2 min,然后加入浓度为1%的酪素溶液1 mL,摇匀,立即放于35℃水浴中保温10 min。取出后迅速加入0.4 mol·L-1的三氯乙酸溶液2 mL,终止蛋白酶的催化水解反应。取滤液1 mL加入碳酸钠溶液5 mL,摇匀,然后加入1 mL的福林酚试剂使用液,在35 ℃水浴中显色20 min,用分光光度计于680 nm波长下比色,记录消光值。在同组试验中活性最高点记为100%,其余试验点活性与该点的比值为酶的相对活力,用百分数表示。
1.6 固定化蛋白酶防污性能测试
1.6.1 底栖硅藻附着与脱除性能测试 选择底栖硅藻——舟形藻作为固定化蛋白酶防污性能测试生物之一,考察固定化蛋白酶抑制舟形藻在试样表面附着的情况。对照空白组为涂覆丙烯酸树脂的载玻片,实验组为表面黏附有固定化酶的丙烯酸树脂涂片,所用固定化酶在最优固定化条件下制备,载酶量达到稳定值。将对照空白组和实验组样片浸入浓度为1.0×105个/L的硅藻溶液中,20 ℃下于人工气候箱中培养3h。将样片通过考马斯亮兰G250染色,然后分别于显微镜下随机抽取10个视野,统计硅藻在样品表面附着密度;通过生物附着强度测试系统在1.5 m/s流速下冲刷试样表面,测试水流剪切条件下硅藻的脱除情况,从而考察蛋白酶对硅藻附着强度的影响。
1.6.2 固定化蛋白酶抑制贻贝足丝附着试验 贻贝是一种世界范围内的典型污损生物,其足丝腺分泌足丝蛋白黏附于材料表面。本文将吐丝能力活跃的贻贝分别固定于空白组和实验组试样表面,分别设置3组平行样,浸入天然海水中,4 h后观察并统计贻贝足丝在样品表面的附着数量,分析固定化蛋白酶对贻贝足丝附着行为的抑制性能。实验组所用固定化酶与底栖硅藻附着实验相同。
2 结果与讨论
2.1 APTES用量及戊二醛浓度对蛋白酶固定化的影响
如图1所示,经该流程完成NPSiO2的制备、氨基化与蛋白酶固定化。

图1 防污蛋白酶固定化流程图Fig.1 Porcedure of antifouling protease immobilization
通过有机元素分析仪测试氨基化NPSiO2失重显示(见图2),氨基化NPSiO2失重率随着硅烷偶联剂APTES用量的增加而提高,当APTES与NPSiO2重量比(mL/g)超过0.4时,失重率趋于稳定,这表明APTES在NPSiO2表面的接枝达到最大程度。
蛋白酶与载体共价结合是连接剂戊二醛分别与蛋白酶氨基残基和载体表面氨基反应形成的,因此戊二醛含量对蛋白酶的固定化有直接的影响。从图(3)可以看出,戊二醛质量百分比浓度在0.25%~1.5%范围内,酶载量随戊二醛浓度增大而增大,当戊二醛浓度达到1.5%后,酶载量趋于稳定。

图2 APTES用量对氨基化NPSiO2失重率的影响Fig.2 Effect of APTES on weight loss of amino-functionalized NPSiO2
2.2 NPSiO2与固定化蛋白酶表征
通过NPSiO2的扫描电镜照片(见图4a)可以看出,硅纳米颗粒为规则球形,颗粒大小均匀,粒径在200 nm左右;硅纳米颗粒表面固定蛋白酶后(见图4b),微球的直径没有显著的变化,仍为200 nm左右,但是受表面蛋白酶的影响,微球呈团聚状态。

图4 NPSiO2扫描电镜照片Fig.4 SEM images of (a)NPSiO2 and (b)NPSiO2-P
载体的Zeta电位反应了其化学特性和表面电荷性质[25]。NPSiO2氨基化后,其Zeta电位由-17.4 mV变为44.3 mV,Zeta电位的绝对值明显增大,纳米粒子间静电斥力增大,这减小了它们之间的碰撞频率,可使其团聚的几率降低,从而提高了相对稳定性。Zeta电位由负变为正,表明氨基硅烷接枝到了NPSiO2表面。

表1 NPSiO2的Zeta电位Table 1 Zeta potential of NPSiO2
NPSiO2(a)、氨基化NPSiO2(b)、戊二醛处理NPSiO2(c)、蛋白酶(d)、固定化蛋白酶(e)的傅里叶变换红外光谱图如图5所示。

((a)NPSiO2,(b)氨基化NPSiO2,(c)戊二醛处理NPSiO2,(d)蛋白酶,(e)固定化蛋白酶。(a)NPSiO2, (b)amino-functionalized NPSiO2, (c)glutaraldehyde-treated NPSiO2, (d)protease, (e)immobilized protease.)
图5 傅里叶变换红外光谱图
Fig.5 FTIR spectra
在NPSiO2的光谱图中,于3 400 cm-1附近出现较宽的SiO—H特征伸缩振动吸收峰,在1 080 cm-1附近出现Si—O—Si特征伸缩振动吸收峰。氨基化NPSiO2在2 950 cm-1附近出现C—H伸缩振动吸收峰,于1 642和1 558 cm-1处出现N—H变形振动吸收峰,在3 100~3 500 cm-1间存在N—H的伸缩振动峰,与SiO—H特征伸缩振动吸收峰发生重叠。这些都与Zeta电位表征一致,说明NPSiO2实现氨基化改性。戊二醛处理后,在1 700 cm-1出现醛基的C=O的伸缩振动峰。随后对防污蛋白酶进行固定化,固定化后醛基在1 700 cm-1的吸收峰消失,防污蛋白酶在1 630~1 670 cm-1范围内出现N—H变形振动吸收峰,这表明完成了蛋白酶在NPSiO2表面的共价固定。
2.3 固定化蛋白酶的环境适应性
2.3.1 温度对固定化蛋白酶活性的影响 在pH=6.5、20~50 ℃温度范围下,分别测试固定化酶和游离酶的活性。从图6可以看出,游离酶和固定化酶的活性随温度变化而变化的趋势是一样的,都是随温度升高,它们的活性先增大后减小;游离酶的最适反应温度是25 ℃,固定化酶最适反应温度为35 ℃,固定化酶的最适反应温度相比于游离酶提高10 ℃,在50 ℃下,游离酶几乎失活,而固定化酶保持有将近20%的活性,并且可以看出固定化酶保持较高活性的温度范围较宽。
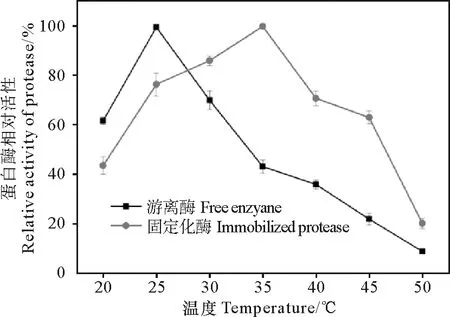
图6 温度对蛋白酶活性的影响Fig.6 Effect of temperature on relative activity of protease
2.3.2 pH对固定化蛋白酶活性的影响 pH对游离酶和固定化蛋白酶酶活的影响如下图所示,游离酶和固定化酶的最适pH分别为6和7,防污蛋白酶经过改性纳米二氧化硅固定后最适反应pH向碱性偏移,在较为酸性环境中,固定化酶的相对活性也较高。此外,固定化酶在7~10范围内保持有较高的活性,可能因为蛋白酶与载体之间通过强有力的共价键作用在一起,从而稳定了酶分子构象,减小了pH变化对酶活的影响,相对于游离酶,固定化酶在较为宽泛的pH范围区域具有较好的适应性。
2.3.3 固定化酶储存稳定性 酶在储存过程中是不稳定的,会发生变性导致酶活变低。而在实际应用中,酶活要有一定的保质期,因此,酶的储存稳定性是一个重要参数[26]。
将固定化蛋白酶和游离酶储存在4 ℃的环境下,不同时间后对固定化酶及游离酶的活性进行测试,测试结果如图8所示。在最初的20天时间内,固定化酶的活性保持在80%以上,50天后,固定化酶仍保持一半以上的活性,而游离酶的活性只剩下16.6%,即固定化酶在储存50天后活力为游离酶的3倍。游离酶由于分子结构不稳定,在储存时酶分子构象易发生改变,而酶经过共价固定后,酶分子构象比较稳定,储存时酶活下降相对较慢,可以看出这种固定化方法改善了防污蛋白酶的储存稳定性,使酶活保持更长的时间。

图7 pH对蛋白酶活性的影响Fig.7 Effect of pH on relative activity of protease

图8 防污蛋白酶的储存稳定性Fig.8 The storage stability of free and immobilized protease
2.4 固定化蛋白酶防污性能评价
2.4.1固定化蛋白酶对底栖硅藻附着与脱除性能的影响 本文采用载酶量约22 mg/g NPSiO2的固定化蛋白酶试样完成底栖硅藻附着实验,固定化蛋白酶质量百分数约为2.2%。底栖硅藻在空白丙烯酸树脂样片和表面黏附固定化酶样片表面的附着情况如图9所示,底栖硅藻在固定化酶样片表面的附着数量显著低于空白样片表面。
如图10所示,空白丙烯酸树脂样片表面底栖硅藻平均附着密度达到1 237 个/mm2,而在黏附固定化酶样片表面密度仅为286 个/mm2,抑制率达到76.8%。经1.5 m/s的水流冲刷后,空白丙烯酸树脂样片表面底栖硅藻的脱除率约为54.4%,黏附固定化酶样片表面底栖硅藻的脱除率约为79.3%。相同流速下,黏附固定化酶样片表面底栖硅藻的脱除率较高,表明底栖硅藻的含酶表面的附着强度较低,蛋白酶影响了底栖硅藻的附着行为,体现出较好的抑制硅藻附着的性能。

图9 底栖硅藻在空白丙烯酸树脂样片a和表面黏附固定化酶样片b表面的附着照片Fig.9 Images of diatom attachment on the surfaces of acrylic resin a and immobilized protease b

图10 水流冲刷测试前后底栖硅藻附着密度Fig.10 The density of diatom before and after water scouring
2.4.2 固定化蛋白酶对贻贝足丝附着性能的影响 贻贝足丝附着实验如图11所示,经统计对照空白涂层表面贻贝足丝平均附着数量约为11条左右,而含酶涂层表面贻贝足丝平均附着数量仅有2.5条左右,足丝附着抑制率可达77.3%。可以看出,牡蛎源菌株产出蛋白酶对贻贝足丝附着具有较明显的抑制作用。

(a.附着前 Before settlement;b.附着后 After settlement.)图11 NPSiO2固定化酶对贻贝足丝附着的影响Fig.11 Effect of immobilized protease on the settlement of mussels
3 结语
本文采用反相乳液聚合法制备了NPSiO2,确定了NPSiO2氨基化所需APTES适当加入量和共价固定牡蛎源菌株产出蛋白酶所需戊二醛浓度,并通过底栖硅藻和贻贝足丝附着实验评价了固定化蛋白酶的防污性能。实验表明,当APTES与NPSiO2重量比达到0.4、戊二醛浓度为1.5%时,可较好地完成蛋白酶在所制备NPSiO2表面的固定化。相对于游离酶,固定化蛋白酶对温度、pH值耐受性显著提高,储存50天后固定化酶活力为游离酶的3倍,储存稳定性良好。另外,固定化蛋白酶对硅藻附着的抑制率达到76.8%,并可显著降低硅藻附着强度,对贻贝足丝附着抑制率也达到了70%以上。与传统防污剂相比,酶具有突出的环境友好性和高效的防污活性,通过固定化处理可显著提升其应用性能[27-29],因此,固定化蛋白酶对发展新型防污涂层材料与技术具有积极的意义。
