外周血CD4+T细胞Foxp3基因CNS2去甲基化与绝经后骨质疏松症的关系
2018-07-27李子祺葛鸿庆王君鳌王慧敏胡杏平陈文治
李子祺 葛鸿庆 王君鳌 王慧敏 胡杏平 陈文治
广东省中医院芳村医院骨科(广州510120)
绝经后骨质疏松症(postmenopausal osteoporo⁃sis,PMO)是指绝经后妇女由于卵巢功能衰退,雌激素水平下降,导致骨吸收-骨形成失衡,出现以骨强度下降、骨折风险增加为特征的骨骼系统疾病[1-3]。PMO患者骨骼中骨小梁的强度、密度和数量发生显著的改变,其血液循环及骨髓腔内的微环境中的炎症相关细胞及促炎症细胞因子的数量与成分也显著提高。在炎症状态下,多种免疫细胞可通过释放炎症因子促进破骨细胞形成[4]。
调节性T细胞(regulatory T cells,Treg)是CD4+T细胞的重要亚群,在多种自身免疫性疾病中起到抑制炎症作用[5]。大量研究[6-11]表明Treg细胞通过抑制破骨细胞活性进而参与了骨代谢调节。Foxp3基因保守非编码序列2(conserved noncoding sequence 2,CNS2)的低甲基化状态是Treg细胞分化并发挥免疫抑制功能的前提[5,12-13]。本研究观察了PMO患者外周血CD4+T细胞中Foxp3 CNS2去甲基化水平,及其与骨代谢指标的相关性,现报告如下。
1 资料与方法
1.1 一般资料 选择2014年7月至2015年7月我院收治的PMO患者42例为观察组,38例绝经后骨量正常妇女作为对照组,记录入组病例年龄、身高、体质量、体质指数等一般资料。本研究经过本院医学伦理委员会批准,所有患者知情同意。
1.2 纳入及排除标准
1.2.1 纳入标准 PMO的诊断标准参考WHO推荐标准[3],DXA测定骨密度值低于同性别、同种族健康成人的骨峰值不足1个标准差为正常(T值≥-1.0 SD);降低1~2.5个标准差为骨量低下或骨量减少(-2.5 SD<T值<-1.0 SD);降低程度≥2.5个标准差为骨质疏松(T值≤-2.5 SD);降低程度符合骨质疏松诊断标准,同时伴有一处或多处骨折为严重骨质疏松。根据诊断标准,绝经后妇女DXA测定骨密度测定中T值≤-2.5 SD则诊断为PMO,纳入观察组。绝经后妇女T值≥-1.0 SD则纳入对照组。
1.2.2 排除标准 (1)合并可能影响骨代谢的内分泌疾病,如糖尿病、甲状腺功能亢进、甲状旁腺功能亢进等;(2)罹患慢性胃炎、肠炎、派杰氏病,以及骨与其他组织恶性肿瘤患者;(3)合并肝肾功能异常;(4)合并类风湿性关节炎、强直性脊柱炎等免疫性疾病;(5)6个月内使用过糖皮质激素或其他影响骨代谢的药物;(6)1年内出现骨折或其他原因导致的运动障碍的患者。
1.3 实验方法
1.3.1 血清Ⅰ型前胶原氨基端前肽(P1NP)、β胶原特殊序列(β⁃crosslaps)及血Ca2+测定 所有患者清晨空腹抽取静脉血2 mL,利用美国Bio⁃Rad酶联免疫检测仪测定骨代谢生化标志物P1NP、β⁃crosslaps,试剂盒由武汉云克隆科技股份有限公司提供。使用美国罗氏公司生产的Cobas 8000酶标仪检测血Ca2+,试剂盒由中国中生北控生物科技有限公司提供。
1.3.2 外周血CD4+T细胞分离 将抽取的新鲜抗凝血转移至15/50 mL离心管内,按每1 mL全血加入 50 μL 的比例加入 Human CD4+T cell Enrich⁃ment Cocktail(Stemcell,15022),轻轻混匀。室温静置20 min。向离心管内加入等体积含2%FBS的PBS混匀,稀释血液。将稀释的血液滴加至淋巴细胞分离液液面上。于室温1 200 g离心20 min;小心从分离液:血浆中间层吸取富集的CD4+T细胞至一新离心管内。用PBS+2%FBS洗涤细胞1次。重复此步骤1次。加RPMI 1640培养基(含10%FBS+1%Pen/Strep)重悬细胞,并调整细胞密度,于37℃,5%CO2培养箱中培养。
1.3.3 实时定量PCR检测外周血CD4+T细胞Foxp3 mRNA表达 使用Trizol一步法提取细胞总RNA,逆转录后得到cDNA(试剂盒DBI⁃2220),以GAPDH为内参基因,行实时定量PCR法(试剂盒Genecopies,AOPR⁃1200),Foxp3正义引物5′⁃CA⁃CTCACCTCACTCCCATTC⁃3′,反义引物 5′⁃GGGCC⁃TTGGATCCCAAATAA⁃3′。PCR反应条件95℃预变性10 min;95℃变性10 s,55℃退火20 s,72℃延伸35 s,共40个循环。每个样本重复检测两次。Foxp3 mRNA相对表达量以2-△△Ct表示。
1.3.4 亚硫酸氢盐测序法检测外周血CD4+T细胞Foxp3 CNS2甲基化 按照DNA提取试剂盒(Tian⁃gen,DP304)说明书进行操作,对所提取DNA进行定量分析后严格按照试剂盒说明书操作,取基因组DNA 1 μg进行亚硫酸盐转化并纯化回收。引物信息B281⁃F:TTGGGTTAAGTTTGTTGTAGGATAG;B281⁃R:ACATCTAAACCCTATTATCACAACC。在50 μL体系进行PCR扩增,PCR Mix 25 μL,上下游引物各 1 μL,模板 DNA 2 μL,补水至 50 μL。PCR产物纯化按照试剂盒中的产品说明操作,将目标片段割胶纯化(Generay,cat:GK2043)。采用Generay的pTG19⁃T作为载体,按照试剂盒中的产品说明操作,转化采用XL10⁃Gold感受态,按照产品说明进行转化、复苏和涂板。酶切法鉴定阳性菌落挑取质粒送测序。
1.4 统计学方法 采用SPSS 19.0统计软件进行数据分析。计量资料采用均数±标准差表示,根据数据是否符合正态分布,组间比较分别采用独立样本t检验或 Mann⁃WhitneyU检验;Pear⁃son相关性检验分析PMO中骨代谢指标与CD4+T细胞Foxp3 mRNA相对表达量、Foxp3 CNS2去甲基化的关系。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 观察组共纳入PMO患者42例,平均年龄(57.9±7.5)岁;对照组纳入绝经后无骨质疏松症患者38例,平均年龄(56.0±5.0)岁。两组患者年龄、身高、体质量、体质指数等一般资料比较差异均无统计学意义(表1)。
2.2 两组患者外周血CD4+T细胞Foxp3 mRNA相对表达量、Foxp3 CNS2去甲基化率比较 观察组Foxp3 mRNA相对表达量0.9±0.3,显著低于对照组1.8±0.6,其差异具有统计学意义(z=-7.1,P<0.01)。观察组Foxp3 CNS2去甲基化率为(7.3±1.3)%,显著低于对照组(9.6±1.4)%,其差异具有统计学意义(t=-7.4,P<0.01)。根据Pearson相关性分析,所有患者外周血CD4+T细胞Foxp3 CNS2位点非甲基化率与Foxp3 mRNA相对表达量呈正相关,其相关性差异具有统计学意义(r=0.5,P<0.01)。见图1。
表1 两组患者一般资料对比Tab.1 Comparison of demographic characteristics between two groups ±s

表1 两组患者一般资料对比Tab.1 Comparison of demographic characteristics between two groups ±s
组别观察组对照组t值P值例数42 38年龄(岁)57.9±7.5 56.0±5.0 1.3 0.2身高(m)1.5±0.1 1.6±0.1-1.6 0.1体质量(kg)63.3±8.1 63.2±7.4 0.1 0.9体质指数26.5±3.5 25.7±3.7 1.0 0.3
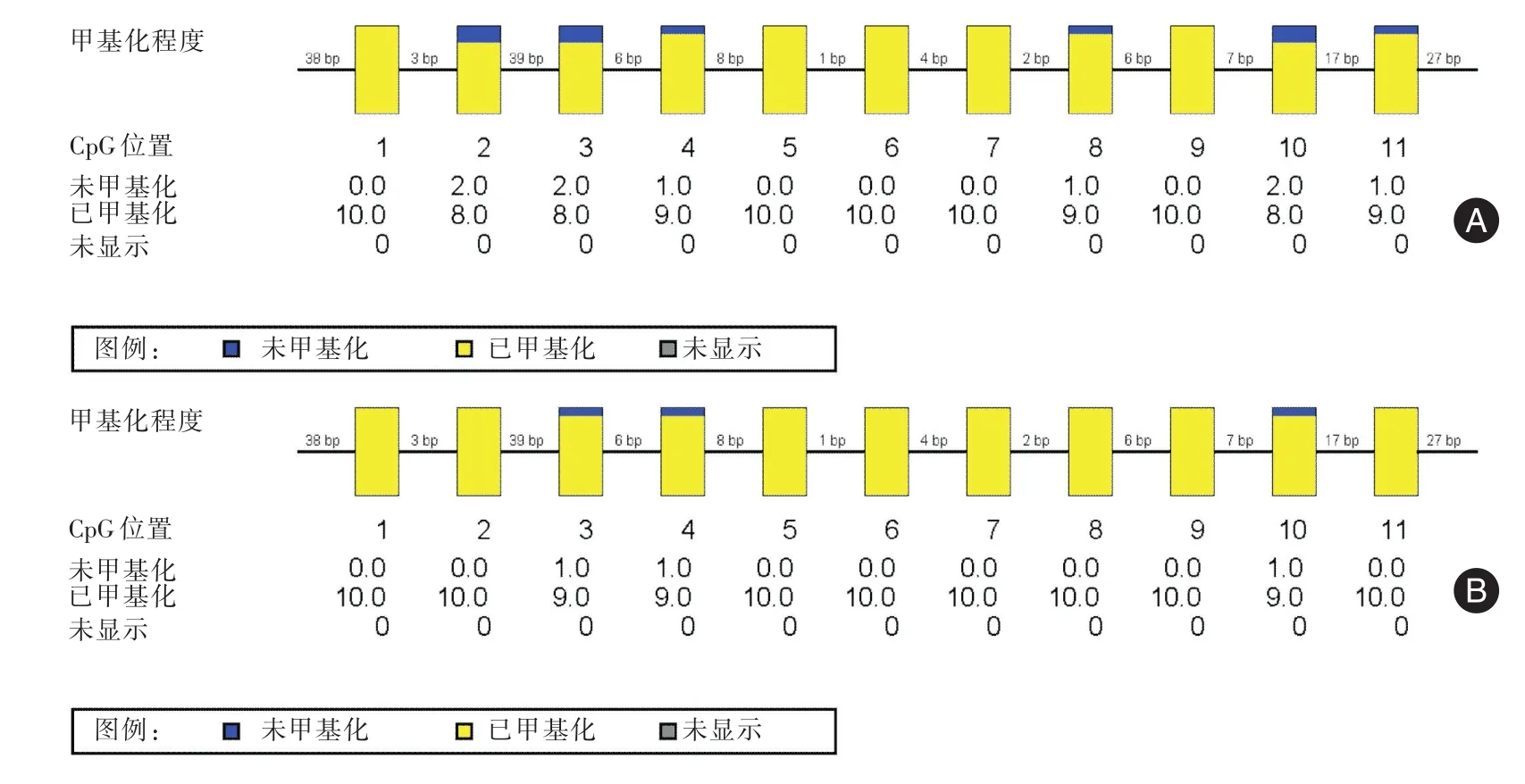
图1 PMO患者外周血CD4+T细胞Foxp3基因CSN2去甲基化程度比较Fig.1 Comparison of DNA methylation of Foxp3 CNS2 region in CD4+T cells between patients with postmenopausal osteoporosis and control group
2.3 PMO中骨代谢指标与CD4+T细胞Foxp3 mRNA相对表达量、Foxp3 CNS2去甲基化的关系 观察组与对照组血清PINP含量分别为(43.6±4.0)ng/mL与(24.0±3.6)ng/mL,观察组PINP含量显著高于对照组,其差异具有统计学意义(t=23.6,P<0.01)。观察组血清β⁃crosslaps含量(1.2±0.2)ng/mL,显著高于对照组(0.8±0.1)ng/mL,其差异具有统计学意义(z=6.7,P<0.01)。观察组与对照组血钙含量分别为(2.4±0.2)mmol/L及(2.4±0.1)mmol/L,其差异无统计学意义(t=1.2,P=0.2)。根据Pearson相关性分析,PMO中外周血CD4+T细胞Foxp3 CNS2位点非甲基化率与β⁃crosslaps呈负相关,其相关性差异具有统计学意义(r=-0.5,P<0.01);CD4+T细胞Foxp3 CNS2位点非甲基化率与血清PINP含量无显著的相关性(r=-0.1,P=0.6);CD4+T细胞Foxp3 mRNA相对表达量与血清PINP(r=-0.2,P=0.2)、β⁃crosslaps含量(r=-0.1,P=0.6)均无显著的相关性。
3 讨论
绝经后妇女由于卵巢功能衰退,雌激素水平下降,导致骨代谢中破骨细胞介导的骨吸收作用增强,与成骨细胞介导的骨形成作用失衡,最终导致了骨质疏松症。正常人体中90%的骨基质由Ⅰ型胶原组成。骨代谢指标PINP由成骨细胞分泌,是I型胶原形成的重要的代谢产物,与骨形成密切相关;而β⁃crosslaps是Ⅰ型胶原分解的产物,可作为骨吸收的重要指标[14]。本研究发现PMO患者外周血CD4+T细胞中Foxp3 CNS2位点去甲基化显著降低,并且与血清中β⁃crosslaps含量呈负相关。这提示在PMO中Treg细胞可能通过抑制骨吸收作用参与骨代谢调节。
Treg细胞是CD4+T细胞的重要亚群,可通过细胞间直接接触以及TGF⁃β、IL⁃4、IL⁃10等因子介导的间接途径抑制破骨细胞,从而在骨代谢平衡中起到骨保护作用[9-10]。李文艳等[6]通过临床研究发现在老年性骨质疏松症患者中外周血中Treg细胞数量随着年龄的增长而降低,推测Treg细胞的减少促进了骨质疏松症的发生。而动物实验发现Treg细胞占CD4+T细胞比例与骨质疏松大鼠骨密度呈正相关[7]。
Foxp3是Treg细胞区别于其他CD4+T细胞的特异性基因,其稳定表达是Treg细胞发挥骨保护作用的前提。ZAISS等[11]研究发现Foxp3转基因小鼠(Foxp3⁃tg)的骨髓细胞能够抑制肿瘤坏死因子转基因小鼠体内由炎症因子介导的骨破坏。LIU等[15]研究发现在绝经后骨质疏松的大鼠模型中Treg细胞数量显著低于假手术组,而在脾及股骨局部的Foxp3蛋白表达显著降低。越来越多的文献表明,表观遗传因素与Foxp3的表达、Treg细胞分化与功能维持密切相关。其中Foxp3 CNS2去甲基化是Treg细胞特异的表观遗传标记[12],也是Foxp3稳定表达的前提[13]。
本研究采用Foxp3 CNS2去甲基化程度来反应Treg细胞数量与功能,是因为部分CD4+T细胞能够短暂地表达Foxp3,但并不具备类似Treg细胞的免疫抑制功能[16]。而少量Treg前体细胞Foxp3 CNS2位点去甲基化后即可获得免疫抑制功能,即使暂无Foxp3表达[17]。因此相对于Foxp3基因mRNA的表达,Foxp3 CNS2去甲基化程度是反应外周血CD4+T细胞中Treg细胞比例的可靠指标,更为准确地反应了Treg细胞对骨吸收的抑制作用。本研究结果也印证了这一推论,虽然PMO患者中CD4+T细胞Foxp3 CNS2去甲基化程度与Foxp3基因mRNA的表达均显著降低,但仅Foxp3 CNS2去甲基化程度与血清中β⁃crosslaps含量具有显著负相关性。
本研究具有一定的局限性。本研究纳入了42例PMO患者与38例绝经后无PMO妇女进行对照,由于PMO的发生与发展受多种因素影响,本研究的样本数需进一步扩大,并通过多因素分析探讨Foxp3 CNS2去甲基化水平与PMO的关系。另一方面,本研究为横断面研究,Foxp3 CNS2去甲基化水平与疾病发生发展的动态关系尚不明确,有待进一步研究。
综上所述,本研究发现PMO外周血中CD4+T细胞中Foxp3 CNS2去甲基化水平显著降低,且与血清β⁃crosslaps含量呈负相关。可见PMO中外周血中CD4+T细胞Foxp3 CNS2去甲基化水平是与骨代谢关系密切的生物标志,可能反应了Treg细胞对骨吸收的抑制作用。
