肿瘤抑制基因PTEN对体外活化肝星状细胞骨架蛋白vinculin的影响
2018-07-27郝礼森张明婷王玉兰宋小杰宋洁章广玲莫艳波靳丽敏张朋垒
郝礼森 张明婷 王玉兰 宋小杰 宋洁 章广玲 莫艳波 靳丽敏张朋垒
1华北理工大学附属医院消化内科(河北唐山 063000);2华北理工大学基础医学院(河北唐山 063000)
肝纤维化是肝脏对各种损伤产生的修复反应,持续发展可演变为肝硬化。而肝星状细胞(hepatic stellate cell,HSC)则是肝纤维化病理过程中的最重要的细胞。当肝脏受到损伤因子刺激时,HSC活化为肌成纤维细胞,并向损伤区域迁移,产生大量以胶原为主的细胞外间质,导致肝纤维化的形成与发展[1]。因此,活化HSC的迁移在肝纤维化病理过程中发挥重要作用。已有研究证实细胞迁移与细胞骨架的重构有关[2-3],而细胞骨架是由微丝、微管及中间纤维组成的蛋白纤维网状结构,其中微丝是由肌动蛋白(actin)构成的螺旋状纤维。Actin作为构成微丝的重要骨架蛋白,其功能除了参与维持细胞的正常形态外,还参与对细胞黏附、迁移的调控[4]。纽蛋白(vinculin)是一种与黏着连接形成有关的细胞骨架蛋白,存在于细胞-细胞及细胞间质间的黏着部位,因此也是一种黏着斑蛋白,其作用是将纤维状肌动蛋白(filamentous actin,F⁃actin)锚着于连接点形成部位的细胞膜上,通过与多种细胞骨架蛋白、黏着斑蛋白相互作用,在细胞黏附、迁移、增殖等过程中发挥重要作用[5-6]。第10号染色体缺失的磷酸酶张力蛋白同源物基因(phosphatase and tensin homology detected on chromosome ten,PTEN)是第一个被发现的具有双重磷酸酶活性的肿瘤抑制基因,其突变或表达缺失与多种恶性肿瘤的发生发展密切相关[7]。本课题组前期发现,胆总管结扎肝纤维化大鼠肝组织及在体肝星状细胞的PTEN表达降低[8];并且体外研究发现,野生型PTEN过表达可显著抑制体外活化大鼠肝星状细胞骨架的重构及细胞骨架蛋白F⁃actin的形成[9],而PTEN表达下调则可明显促进体外活化大鼠肝星状细胞骨架的重构及细胞骨架蛋白F⁃actin的形成[10]。但PTEN表达变化对活化肝星状细胞骨架蛋白vinculin的影响仍不清楚。为此,本研究以活化大鼠肝星状细胞系HSC⁃T6为研究对象,分别将携带野生型PTEN基因及靶向PTEN的RNA干扰序列短发夹RNA(short hairpin RNA,shRNA)的重组腺病毒 Ad⁃PTEN及Ad⁃shRNA/PTEN转染体外活化大鼠HSC,构建体外活化大鼠肝星状细胞PTEN过表达及低表达模型,应用免疫荧光法检测了PTEN过表达及低表达对体外活化肝星状细胞骨架蛋白vinculin的影响,以期为深化对肝纤维化病理生理机制的认识提供实验依据。
1 材料与方法
1.1 试剂 带有绿色荧光蛋白(green fluorescent protein,GFP)基因并携带野生型PTEN基因的重组腺病毒(Ad⁃PTEN)及仅携带GFP基因的空病毒(Ad⁃GFP)由祝善俊教授(第三军医大学)惠赠,带有GFP基因并携带靶向PTEN的shRNA的重组腺病毒(Ad⁃shRNA/PTEN)由浙玛生物技术公司(武汉)协助构建。表型活化的大鼠肝星状细胞系HSC⁃T6(中国医学科学院肿瘤医院);胎牛血清及山羊血清(以色列Biological Industries公司);DMEM培养液(美国Gibco公司);兔抗vinculin单克隆抗体(美国Affinity公司);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗兔IgG(美国KPL公司);DAPI及TritonX⁃100(美国Sigma公司);荧光防淬灭封片剂(美国Bioworld公司);Platinum SYBR Green qPCR SuperMix⁃UDG、逆转录反应体系(上海英俊生物技术有限公司)。
1.2 腺病毒转染体外活化肝星状细胞 以含8%胎牛血清的DMEM培养HSC⁃T6,细胞生长至80%融合时,按感染倍数100进行腺病毒转染,并于37℃、5%CO2细胞培养箱中孵育2 h,2 h后补充适量完全培养基继续培养至实验所需时间。分别于倒置荧光显微镜下在腺病毒感染肝星状细胞12、24、48、72 h观察HSC的荧光表达、计算转染效率。腺病毒感染肝星状细胞48 h转染效率>80%,并且48与72 h GFP阳性表达的HSC数量无明显差异,但72 h细胞脱落现象更广泛,表明腺病毒感染肝星状细胞48 h转染效率已达到最高,故后续实验仅采用腺病毒感染48 h的HSC。实验分组:(1)Control组:以无血清无抗生素的DMEM培养液代替腺病毒液转染体外活化HSC;(2)Ad⁃GFP组:以仅带有GFP基因的载体空病毒Ad⁃GFP转染体外活化HSC;(3)Ad⁃PTEN组:以带有GFP基因并携带野生型PTEN基因的重组腺病毒 Ad⁃PTEN 转染体外活化HSC;(4)Ad⁃shRNA/PTEN组:以带有GFP基因并携带靶向PTEN的shRNA的重组腺病毒Ad-shRNA/PTEN转染体外活化HSC。
1.3 实时荧光定量PCR检测体外活化肝星状细胞的PTEN mRNA表达 腺病毒感染肝星状细胞48 h,收集各组肝星状细胞,依照TRizol试剂盒说明提取总RNA,并逆转录合成cDNA。目地基因PTEN与内参照3⁃磷酸甘油醛脱氢酶(glyseralde⁃hyde⁃3⁃phosphate dehydrogenase,GAPDH) 基因引物由上海生工生物公司合成。引物序列:PTEN的上游引物为 5′⁃TCCTGCAGAAAGACTTGAAGGT⁃3′,下游引物为 5′⁃GCTGTGGTGGGTTATGGTCT⁃3′,扩增产物大小为182 bp;GAPDH的上游引物为5′⁃GGCTCATGACCACAGTCCAT⁃3′,下游引物为 5′⁃ACATTGGGGGTAGGAACACG⁃3′,扩增产物大小为202 bp。在Master cycler ep Real Plex4实时荧光定量PCR仪上进行扩增。采用相对定量2⁃△△Ct法比较各组HSC的PTEN mRNA表达差异[11]。
1.4 免疫荧光法检测体外活化肝星状细胞的vinculin表达 腺病毒感染肝星状细胞48 h,将上述各组肝星状细胞的培养液吸净,用PBS清洗细胞2次,并加入4%多聚甲醛室温下固定10 min,再吸去多聚甲醛并用PBS清洗3次(每次10 min)、加入0.5%TritonX⁃100室温下透膜处理5 min;经透膜处理后,细胞于室温条件下用PBS清洗3次(每次10 min),滴加山羊血清,室温下封闭1 h;吸去封闭液,滴加一抗兔抗vinculin单克隆抗体(1∶200稀释)于4℃下过夜;于次日用PBS清洗细胞4次(每次5 min);加入荧光二抗(FITC标记的羊抗兔IgG),于室温下孵育1 h;PBS清洗3次(每次5 min),用DAPI溶液(浓度5 mg/L)复染细胞核30 s,用PBS清洗细胞,在共聚焦小皿底部滴加荧光防淬灭甘油,并立即置于激光扫描共聚焦显微镜(laser scanning confocal micro⁃scope,LSCM)下观察,随机选取6个视野进行荧光图像分析。
1.5 统计学方法 实验结果以均数±标准差表示,采用SPSS 17.0进行统计学分析,多组间均数比较采用单因素方差分析,两两比较采用LSD检验,P<0.05表示差异有统计学意义。
2 结果
2.1 成功构建体外活化大鼠HSC的PTEN过表达及低表达模型 应用实时荧光定量PCR检测各组HSC的PTEN mRNA表达,Control组HSC的PTEN mRNA 表达量认定为 1,则 Ad⁃GFP组、Ad⁃PTEN组及Ad⁃shRNA/PTEN组HSC的PTEN mRNA相对Control组的表达倍数分别为0.92倍、1.90倍、0.64倍。很明显Ad⁃PTEN组HSC的PTEN mRNA表达量明显高于Control组及Ad⁃GFP组(P< 0.05),而Ad⁃shRNA/PTEN组 HSC的 PTEN mRNA表达量则显著低于Control组及Ad⁃GFP组(P<0.05),但Control组与Ad⁃GFP组之间HSC的PTEN mRNA表达量差异无统计学意义(P>0.05)。上述结果表明外源性野生型PTEN基因和靶向PTEN的shRNA分别成功转染体外活化大鼠HSC,并在HSC内大量表达,体外活化大鼠HSC的PTEN过表达及低表达模型均成功构建(表1)。
表1 实时荧光定量PCR显示腺病毒感染HSC 48 h各组HSC的PTEN mRNA相对表达Tab.1 PTEN mRNA expression of HSC in each group at 48 h after adenovirus infection ±s
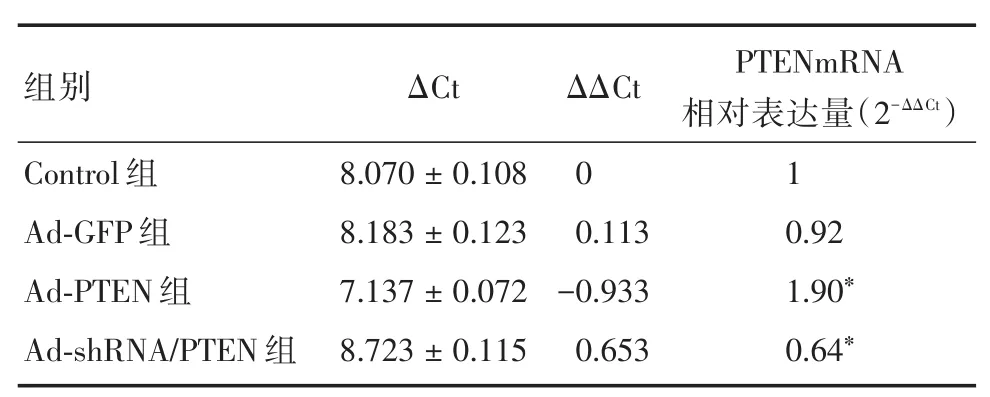
表1 实时荧光定量PCR显示腺病毒感染HSC 48 h各组HSC的PTEN mRNA相对表达Tab.1 PTEN mRNA expression of HSC in each group at 48 h after adenovirus infection ±s
注:△△Ct=腺病毒转染组 △Ct(CtPTEN-CtGAPDH)-Control组 △Ct(CtPTEN-CtGAPDH);*P<0.05,与Control组及Ad⁃GFP组比较
组别Control组Ad⁃GFP 组Ad⁃PTEN 组Ad⁃shRNA/PTEN 组ΔCt 8.070±0.108 8.183±0.123 7.137±0.072 8.723±0.115 ΔΔCt 0 0.113-0.933 0.653 PTENmRNA相对表达量(2-ΔΔCt)1 0.92 1.90*0.64*
2.2 野生型PTEN过表达对体外活化大鼠HSC vinculin的影响 肝星状细胞经染色后,于激光扫描共聚焦显微镜下观察,可见细胞内vinculin被激发出黄绿色荧光,主要表达于胞浆。Ad⁃PTEN组HSC的vincuin荧光强度较Control组及Ad⁃GFP组HSC的vincuin荧光强度显著降低(P<0.05),Control组与Ad⁃GFP组之间HSC的vinculin荧光强度差异无统计学意义(P>0.05),而HSC的vincuin亚细胞分布在各组HSC无明显变化(表2、图1)。
2.3 下调PTEN表达对体外活化HSC vinculin的影响 肝星状细胞经染色后,于激光扫描共聚焦显微镜下观察,可见细胞内vinculin被激发出黄绿色荧光。Ad⁃shRNA/PTEN组HSC的 vincuin荧光强度较Control组及Ad⁃GFP组HSC的 vincuin荧光强度显著增加(P<0.05),而HSC的vincuin亚细胞分布未发生明显变化,主要表达于细胞浆(表2、图1)。
表2 腺病毒感染HSC 48 h各组HSC的vinculin荧光强度Tab.2 The fluorescence intensity of vinculin in HSC at 48 hours after adenovirus infection(n=6) ± s
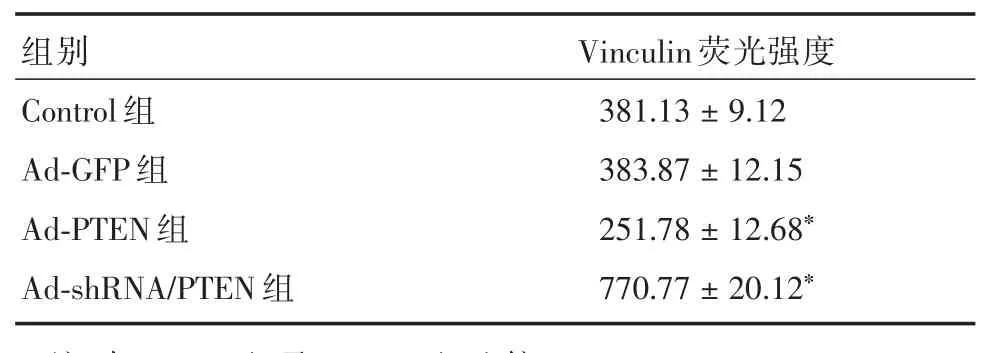
表2 腺病毒感染HSC 48 h各组HSC的vinculin荧光强度Tab.2 The fluorescence intensity of vinculin in HSC at 48 hours after adenovirus infection(n=6) ± s
注:与Control组及Ad⁃GFP组比较,*P<0.05
组别Control组Ad⁃GFP 组Ad⁃PTEN 组Ad⁃shRNA/PTEN 组Vinculin荧光强度381.13±9.12 383.87±12.15 251.78±12.68*770.77±20.12*
3 讨论
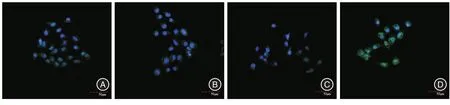
图1 LSCM下显示腺病毒感染HSC 48 h各组HSC的vinculin荧光表达及分布(×200)Fig.1 The expressions of vinculin in HSC were observed under LSCM at 48 hours after adenovirus infection(× 200)
细胞骨架是一种蛋白纤维网状结构,位于真核细胞核和细胞膜内侧面,由微丝、微管和中间纤维组成。细胞骨架的功能除了参与细胞形态的维持,还参与对细胞黏附、迁移、增殖、凋亡等的调控[4]。细胞骨架功能的完成与构成它的骨架蛋白密切相关,其中组成微丝的主要成份actin是完成细胞骨架功能不可缺少的重要骨架蛋白。而vinculin则是另一重要的细胞骨架蛋白,其由8个α螺旋束组成,存在于细胞—细胞及细胞间质间的黏着部位,因此也是一种黏着斑蛋白。Vinculin的功能与黏着连接形成有关,它可将F⁃actin锚着于连接点形成部位的细胞膜上,通过与多种细胞骨架蛋白及黏着斑蛋白相互作用,参与细胞黏附、伸展、迁移、增殖、存活等的调控[5-6]。
众所周知,肝纤维化是肝脏对各种损伤产生的修复反映,HSC是参与肝纤维化病理过程中的最重要细胞。在肝纤维化过程中,活化HSC向肝损伤部位迁移,导致损伤区域活化HSC的数量增多,进而促进肝纤维化的发展。如上所述,细胞骨架,尤其是细胞骨架蛋白F⁃actin及vinculin与细胞迁移有关。我们前期的研究发现,在多种组织及细胞中广泛表达的肿瘤抑制基因PTEN表达下调可显著促进体外活化肝星状细胞的迁移[12],并明显促进体外活化肝星状细胞骨架的重构及细胞骨架蛋白F⁃actin的形成[10];而野生型PTEN过表达则可显著抑制体外活化肝星状细胞骨架的重构及细胞骨架蛋白F⁃actin的形成[9]。但PTEN 表达变化对体外活化肝星状细胞骨架蛋白vinculin的影响尚不清楚。为此,本研究应用腺病毒瞬时转染技术,将野生型PTEN基因及靶向PTEN的shRNA分别转染体外培养的活化HSC,在证实活化HSC的PTEN过表达及低表达模型成功构建后,应用免疫荧光法检测了PTEN过表达及低表达对体外活化肝星状细胞骨架蛋白vinculin的影响。结果显示,野生型PTEN过表达可显著抑制体外活化肝星状细胞骨架蛋白vinculin的表达,而PTEN低表达则可上调活化肝星状细胞骨架蛋白vinculin的表达,但PTEN表达变化对体外活化HSC的vinculin亚细胞分布无明显影响。结合我们前期的研究发现胆总管结扎肝纤维化大鼠肝组织及在体肝星状细胞的PTEN表达降低[8],体外研究发现PTEN表达下调可显著促进体外活化肝星状细胞的迁移[12],以及有研究发现在大鼠肝纤维化进程中其纤维化肝组织的vinculin表达上调[13],本研究结果提示在肝纤维化病程中PTEN表达下调可能通过使活化HSC的vinculin表达上调,进而促进活化HSC的迁移参与肝纤维化病理过程。如PTEN过表达则可通过下调活化HSC的vinculin表达抑制活化HSC的迁移,进而抑制肝纤维化的发展。但本研究为体外实验,仅对体外活化HSC的PTEN表达变化对其vinculin的影响进行了探讨,而在体HSC的PTEN表达变化对其vinculin的影响仍不清楚,并且尽管我们前期的研究已发现PTEN过表达可通过抑制丝氨酸-苏氨酸蛋白激酶B(serine⁃threo⁃nine protein kinase B,Akt)及黏着斑激酶(focal ad⁃hesion kinase,FAK)的磷酸化而抑制体外活化HSC的磷脂酰肌醇⁃3 激酶(phosphoinositol⁃3⁃kinase,PI3K)/Akt及FAK信号通路[14-15],但上述信号通路是否参与了PTEN对HSC的vinculin调控仍需进一步探讨,这些问题均是下一步的研究方向。
