离子液体辅助提取刺玫果中木犀草素与金丝桃苷的工艺研究
2018-07-27雷永平钟方丽王晓林陈铎鑫
雷永平,钟方丽,王晓林,陈 帅,陈铎鑫
(吉林化工学院 化学与制药工程学院,吉林 吉林 132022)
山刺玫属于喜光的蔷薇科小灌木,主要生长在杂木林及山坡灌木中,其果实称为刺玫果,属于可在保健食品中添加的中药材。刺玫果系蔷薇科蔷薇属植物山刺玫Fruit of Rosa davurica Pall.的成熟果实,其味酸甜,具有浓郁的香甜气息,广泛分布于我国东北地区,其富含黄酮类、皂苷类等活性成分及维生素、氨基酸等物质[1-3],具有显著的抗氧化、降血脂、降血糖、健脑增智、延年益寿等功效[4-6],故其具有广泛种植的价值[7-8]。
本课题组对刺玫果总黄酮、总皂苷的提取、纯化工艺进行了详细研究[9-14]。市场上含有刺玫果的保健食品或中成药其主要含量测定指标为总黄酮,总黄酮具有抗氧化、增强人体免疫力等生理活性[15]。离子液体是在室温下呈液体的有机离子体系,具有性质稳定、挥发性低、溶解能力强等独特的物理化学性质,与传统有机溶剂相比,具有绿色环保、不易燃烧等特点,其在天然植物活性成分提取领域已有所应用[16-18]。因此,本研究采用离子液体辅助超声技术,通过单因素和正交试验优化了刺玫果中木犀草素、金丝桃苷的提取工艺条件,为刺玫果的深入开发提供了试验依据。
1 材料与方法
1.1 材料与试剂
试材:供试刺玫果采自吉林省吉林市丰满区小白山,经吉林化工学院药学系薛健飞博士鉴定为蔷薇科植物山刺玫Fruit of Rosa davurica Pall.的果实,样品保存于吉林化工学院药学系研究室。
试剂:木犀草素、金丝桃苷对照品,成都曼思特生物科技有限公司;氯化-1-丁基-3-甲基咪唑、溴化-1-丁基-3-甲基咪唑、1-丁基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑硝酸盐、1-丁基-3-甲基咪唑硫酸氢盐,上海成捷化学有限公司;甲醇、乙腈(色谱纯),天津大茂化学试剂公司;水为重蒸馏水;其余所用试剂均为分析纯。
1.2 仪器与设备
UV-1201型高效液相色谱仪,大连依利特分析仪器有限公司;W5-100SP型恒温水浴锅, 上海申生科技有限公司;FA2004N型电子分析天平,上海精密科学仪有限公司;JBT/C-YCL型超声波药品处理机,济宁金百特电子有限责任公司。
1.3 刺玫果提取液中木犀草素、金丝桃苷的HPLC含量的测定方法研究
以刺玫果提取液为原料,采用高效液相色谱法测定刺玫果提取液中木犀草素、金丝桃苷的峰面积,并对检测波长的确定、流动相的选择、线性关系的考察、重复性、精密度、供试品溶液的稳定性、加样回收率等进行了试验研究。
1.4 刺玫果中木犀草素、金丝桃苷的提取工艺研究
称取刺玫果粉适量,精密称定,放入圆底烧瓶中,按照一定的料液比加入一定浓度的离子液体乙醇水溶液,放入超声机中,设定适宜的水浴温度和超声波功率,提取一定时间,过滤,滤液转移到50 mL的容量瓶中,定容,摇匀,用微孔滤膜(0.45 μm)滤过,弃去初滤液,取续滤液作为供试品溶液。按文中选定的色谱条件,分别进样20 μL,测定木犀草素、金丝桃苷的峰面积。
2 结果与分析
2.1 HPLC含量测定方法的研究结果
2.1.1 混合对照品溶液的制备
精密称取干燥至恒质量的木犀草素、金丝桃苷对照品各1.90 mg,置于10 mL的容量瓶中,加入甲醇使之溶解并定容至刻度,摇匀,配制成质量浓度为0.19 mg·mL-1的混合对照品贮备液。吸取上述混合对照品贮备液2.5 mL于25 mL的容量瓶中,加入甲醇稀释至刻度,制成质量浓度为19.00 μg·mL-1的混合对照品溶液,置于冰箱中避光保存以备用[19]。
2.1.2 供试品溶液的制备
精密称定5 g刺玫果粉,放入圆底烧瓶中,以一定的料液比加入离子液体乙醇水溶液,超声提取,过滤,收集提取液[20-21],转移至50 mL的容量瓶中并用乙醇稀释至刻度,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液,作为供试品溶液。
2.1.3 色谱条件及检测波长的选择
根据相关文献报道,采用高效液相色谱法同时测定木犀草素与其他黄酮类成分、金丝桃苷与其他黄酮类成分的含量时,一般可以在360 nm[22-23]的检测波长条件下测定,故本试验确定的检测波长为360 nm。
色谱柱为大连依利特ODS2 C18(4.6 mm×250 mm,5 μm)。流动相:A为乙腈,B为0.2%磷酸溶液(V/V),程序为0~21 min,17% A;22~27 min,20%~24% A;28~36 min,28%~32% A;37~41 min,35%~45% A。流速为1.0 mL·min-1,柱温为35 ℃,进样量为20 μL,检测波长为360 nm。在此条件下,木犀草素、金丝桃苷的保留时间分别为35.57、12.41 min。HPLC色谱图见图1。

图1 对照品溶液及供试品溶液的HPLC图谱Fig. 1 HPLC chromatograms of reference solution(A) and sample solution(B)
2.1.4 流动相的选择
试验中主要考察了甲醇-0.25%醋酸溶液、乙腈-0.25%磷酸水溶液、乙腈-0.2%磷酸水溶液梯度洗脱各种流动相对刺玫果提取液中木犀草素、金丝桃苷保留时间和分离度的影响情况。试验结果表明:适宜的流动相为乙腈-0.2%磷酸水溶液梯度洗脱,能够将刺玫果提取液中的木犀草素、金丝桃苷与其他物质分开,故选择在上述流动相条件下进行相关研究。另外,试验设计中原本准备同时测定刺玫果提取液中的木犀草素、金丝桃苷、山柰酚,但试验中发现,刺玫果提取液中山柰酚的峰面积较小且不稳定,所以在试验中只测定了木犀草素与金丝桃苷。
2.1.5 线性关系的考察
吸取木犀草素与金丝桃苷的混合对照品溶液,配制成质量浓度分别为0.19、0.95、1.90、3.80、7.60、11.40、15.20 μg·mL-1的系列混合对照品溶液,分别进样20 μL,测定木犀草素、金丝桃苷的峰面积[24]。以木犀草素、金丝桃苷对照品进样质量浓度C(μg·mL-1)为横坐标,各自的峰面积A为纵坐标,绘制标准曲线。木犀草素、金丝桃苷的回归方程分别为:
Y=102.01X+12.02(r=0.997 7);
Y=48.30 X+6.96(r=0.998 1)。
分析结果表明:木犀草素、金丝桃苷进样质量浓度在0.19~15.20 μg·mL-1范围内呈良好的线性关系。
2.1.6 重复性试验
取同一批号刺玫果粉6份,按2.1.2中说明的方法制备供试品溶液,各进样量均为20 μL,测定木犀草素、金丝桃苷的峰面积。试验结果表明,供试品中木犀草素的峰面积分别为40.75、39.45、41.79、42.08、42.69、39.32 mv·min-1,RSD为3.43%;金丝桃苷的峰面积分别为33.28、35.22、35.04、35.16、35.22、36.48 mv·min-1,RSD为2.92%。这一结果表明,含量测定方法具有较好的重复性。
2.1.7 仪器精密度试验
吸取混合对照品及供试品溶液,连续进样6次,每次进样20 μL,分别测定对照品及供试品溶液中木犀草素、金丝桃苷的峰面积。试验结果表明:供试品中木犀草素的峰面积分别为42.72、42.80、45.24、42.39、46.20、43.65 mv·min-1,RSD为3.53%;金丝桃苷的峰面积分别为35.39、36.01、36.91、34.99、36.92、35.90 mv·min-1,RSD为2.18%。对照品中木犀草素的峰面积分别为1 756.98、1 789.63、1 854.15、1 733.21、1 789.83、1 761.12 mv·min-1,RSD为2.35%;金丝桃苷的峰面积分别为852.80、880.68、822.32、852.80、855.24、850.00 mv·min-1,RSD为2.18%。这一结果表明,仪器精密度符合要求。
2.1.8 供试品溶液稳定性试验
吸取供试品溶液,分别放置0、1、2、3、4、5 h后,进样20 μL,测定木犀草素、金丝桃苷的峰面积。试验结果表明:供试品中木犀草素的峰面积分别为41.89、42.75、44.24、42.72、45.38、44.26 mv·min-1,RSD为2.98%;金丝桃苷的峰面积分别为35.60、36.41、36.86、34.81、35.49、35.94 mv·min-1,RSD为2.02%。这一结果表明,供试品溶液在室温条件下放置5 h内稳定,能满足测定的要求。
2.1.9 加样回收率试验
称取已知木犀草素、金丝桃苷含量的刺玫果粉各6份,每份中加入浓度为19.00 μg·mL-1的木犀草素对照品溶液0.9 mL及浓度为38.00 μg·mL-1的金丝桃苷对照品溶液0.9 mL[25],按照2.1.2中说明的方法制备供试品溶液,在上述色谱条件下,测定木犀草素、金丝桃苷的峰面积,测定结果见表1。表1表明:木犀草素的平均回收率为97.49%,RSD为1.76%;金丝桃苷的平均回收率为101.07%,RSD为1.83%。
2.2 离子液体辅助提取刺玫果中木犀草素、金丝桃苷工艺条件的优化
2.2.1 单因素试验结果
2.2.1.1 离子液体类型的选择
称取5 g刺玫果粉,精密称定,放入圆底烧瓶中,加入浓度为0.5 mol·L-1的不同离子液体的50%乙醇水溶液,离子液体分别为:溴化-1-丁基-3-甲基咪唑、氯化-1-丁基-3-甲基咪唑、1-丁基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑硫酸氢盐、1-丁基-3-甲基咪唑硝酸盐。放入超声机中[26-27],料液比为1∶16,设定水浴温度50 ℃,超声波功率180 W,提取30 min,过滤,滤液转移到50 mL的容量瓶中,50%乙醇定容,摇匀,用微孔滤膜(0.45 μm)滤过,弃去初滤液,取续滤液作为供试品溶液。按2.1.3中的色谱条件分别进样20 μL,测定木犀草素、金丝桃苷的峰面积。选择试验结果见表2。表2表明,在5种离子液体中,1-丁基-3-甲基咪唑硝酸盐对木犀草素的提取效果最好,而氯化-1-丁基-3-甲基咪唑对金丝桃苷的提取效果最好,但氯化-1-丁基-3-甲基咪唑与1-丁基-3-甲基咪唑硝酸盐对金丝桃苷的提取效果接近。综合考虑认为,可选择1-丁基-3-甲基咪唑硝酸盐为后续试验的离子液体。

表2 离子液体类型的选择试验结果Table 2 Selection of ionic liquids
2.2.1.2 提取溶剂的选择
称取5 g刺玫果粉,精密称定,放入圆底烧瓶中,加入浓度为0.5 mol·L-1的1-丁基-3-甲基咪唑硝酸盐乙醇水溶液,乙醇体积分数分别设定为0%、10%、30%、50%、70%、90%,放入超声机中,其他操作按2.2.1.1中所述方法进行,测定木犀草素、金丝桃苷的峰面积,试验结果如图2所示。由图2可知,当乙醇体积分数在0%~70%范围内时,木犀草素、金丝桃苷的峰面积均随乙醇体积分数的升高而增加,当乙醇体积分数为70%时,金丝桃苷的峰面积达到了最大值,而木犀草素的峰面积也接近最高值;继续提高乙醇体积分数,金丝桃苷的峰面积明显下降,而木犀草素峰面积的变化不明显。究其原因,可能是木犀草素为黄酮苷元,难溶或不溶于水,主要溶于甲醇、乙醇等有机溶剂中;而金丝桃苷为黄酮苷,在水中的溶解度大于木犀草素,所以,当乙醇体积分数较高时,其对黄酮苷元木犀草素的提取效果比较理想,但对黄酮苷金丝桃苷的提取效果很差。综合考虑认为,可选择70%乙醇水溶液为后续试验的提取溶剂。

图2 乙醇体积分数对峰面积的影响Fig. 2 The influence of ethananol volume fraction on the peak of luteolin、Hyperoside
2.2.1.3 离子液体浓度的选择
称取5 g刺玫果粉,精密称定,放入圆底烧瓶中,加入浓度分别为0.05、0.1、0.2、0.3、0.4、0.5、0.6 mol·L-1的1-丁基-3-甲基咪唑硝酸盐70%乙醇水溶液,放入超声机中[28],其他操作按2.2.1.1中所述方法进行,测定木犀草素、金丝桃苷的峰面积,试验结果见图3。由图3可知,当离子液体浓度在0.05~0.40 mol·L-1范围内,随着离子液体浓度的增加,木犀草素、金丝桃苷的峰面积均不断提高,而当离子液体浓度达到0.4 mol·L-1时,二者的峰面积均达到最高值;继续增加离子液体浓度,二者的峰面积均略有下降,但其变化均不明显。分析其原因,可能是随着离子液体浓度的升高,其溶解能力增强,所以,最初二者的峰面积均随离子液体浓度的增加而提高,但离子液体浓度越高,溶液的粘度也就越大,溶剂渗透进药材基质内的能力越小,故当离子液体浓度高于0.4 mol·L-1时,随着离子液体浓度的增加,二者的峰面积不再持续提高,而均呈略有下降的趋势。
2.2.1.4 料液比的选择
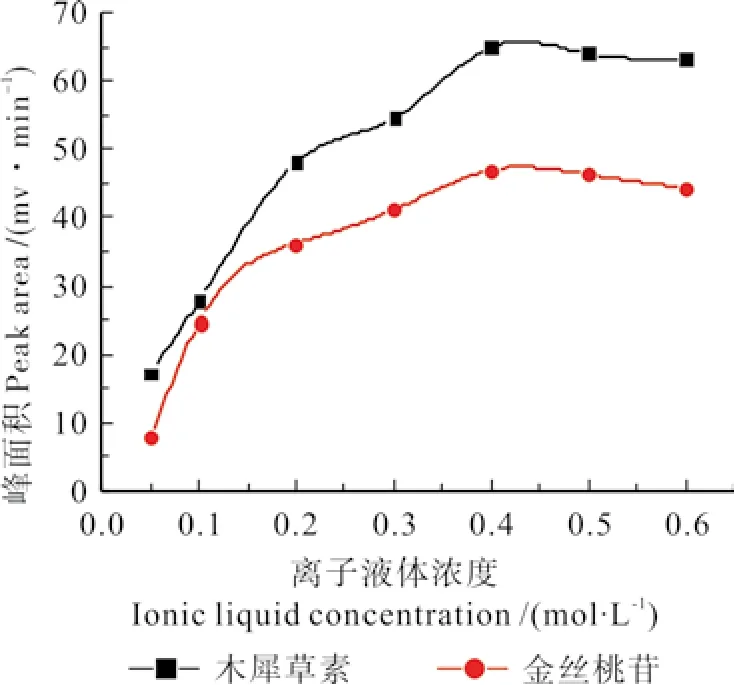
图3 离子液体浓度对峰面积的影响Fig. 3 The influence of ionic liquid concentration on the peak of luteolin、Hyperoside
称取5 g刺玫果粉,精密称定,放入圆底烧瓶中,加入浓度为0.4 mol·L-1的1-丁基-3-甲基咪唑硝酸盐70%乙醇水溶液,放入超声机中,料液比分别设定为1∶7、1∶10、1∶13、1∶16、1∶19、1∶22、1∶25(g∶mL),其他操作按2.2.1.1中所述方法进行,测定木犀草素、金丝桃苷的峰面积,试验结果见图4。由图4可知,随着料液比的增加,木犀草素、金丝桃苷的峰面积均逐渐增加,当料液比达到1∶22时,木犀草素的峰面积达到最高值,而金丝桃苷的峰面积也达到了较高值(66.55 mv·min-1);继续加大料液比,木犀草素的峰面积则略有降低,而金丝桃苷的峰面积却稍有增加,但其变化均较小。究其原因,可能是刺玫果的量固定,在一定范围内增加提取溶剂的用量,会使刺玫果中的木犀草素、金丝桃苷更好地转移到溶剂中,所以,当料液比为1∶22时,刺玫果中的木犀草素、金丝桃苷几乎全部被溶出,如果料液比继续增大,刺玫果中木犀草素、金丝桃苷的溶出变化就不明显了。综合考虑认为,可选择1∶22为后续试验的料液比。
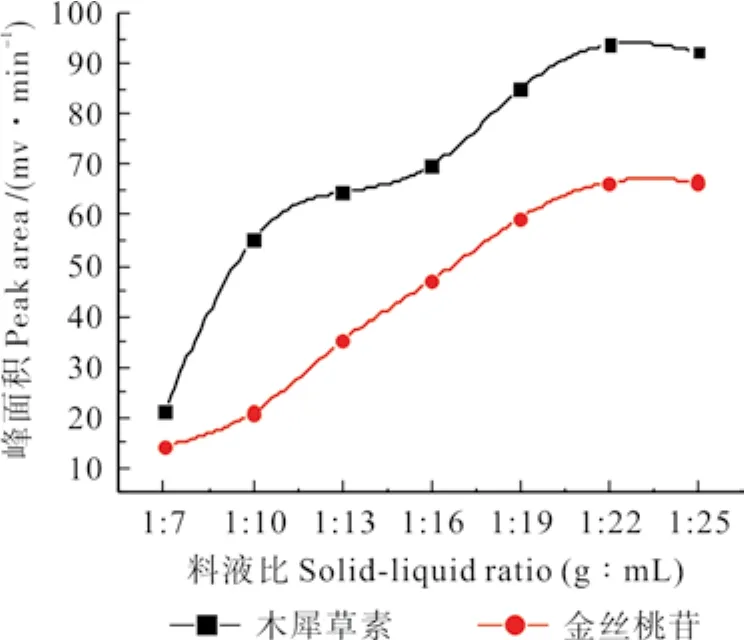
图4 料液比对峰面积的影响Fig. 4 The influence of liquid-solid ratio on the peak of luteolin、Hyperoside
2.2.1.5 提取水浴温度的选择
称取5 g刺玫果粉,精密称定,放入圆底烧瓶中,加入浓度为0.4 mol·L-1的1-丁基-3-甲基咪唑硝酸盐70%乙醇水溶液,放入超声机中,料液比设定为1∶22,提取水浴温度分别设定为30、40、50、60、70、80 ℃,其他操作按2.2.1.1中所述方法进行,测定木犀草素、金丝桃苷的峰面积,试验结果见图5。由图5可知,随着水浴温度的提高,木犀草素、金丝桃苷的峰面积均逐渐增加,当水浴温度达到80 ℃时,二者的峰面积均达到了最高值。分析其原因,可能是随着水浴提取温度的不断升高,提取溶剂的运动速度不断增大,当水浴温度提高到80 ℃时,提取溶剂处于微沸状态,此时溶剂渗透到刺玫果组织细胞中的能力最强。所以,选择水浴提取温度为80 ℃进行后续试验。
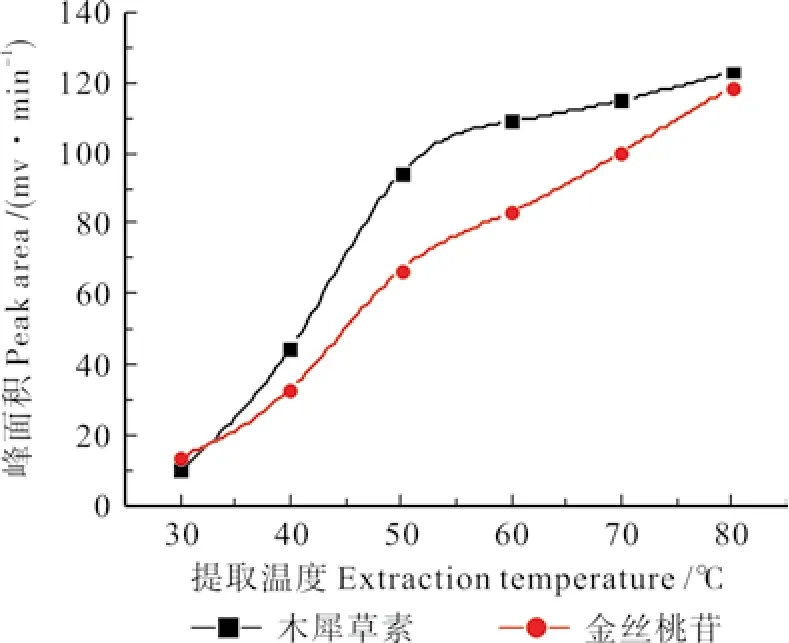
图5 提取温度对峰面积的影响Fig. 5 The influence of extraction tempreature on the peak of luteolin、Hyperoside
2.2.1.6 提取时间的选择
称取5 g刺玫果粉,精密称定,放入圆底烧瓶中,加入浓度为0.4 mol·L-1的1-丁基-3-甲基咪唑硝酸盐70%乙醇水溶液,放入超声机中,料液比设定为1∶22,提取水浴温度为80 ℃,提取时间分别设定为5、10、15、20、30、40、50、60、75、90 min,其他操作按2.2.1.1中所述方法进行,测定木犀草素、金丝桃苷的峰面积,试验结果见图6。由图6可知,随着提取时间的不断延长,木犀草素、金丝桃苷的峰面积均不断增加,当提取时间从5 min 增加到60 min时,二者的峰面积均明显增加,当提取时间继续延长到75 min时,二者的峰面积均略有增加;但若继续延长提取时间,木犀草素的峰面积反而出现下降趋势,而金丝桃苷的峰面积略有增加,但其变化均不明显。分析其原因,可能是提取时间越长,越有利于木犀草素、金丝桃苷的溶出,但如果提取时间过长则会使杂质溶出增加,可能会对二者的测定有一定的影响。综合考虑认为,选择75 min为后续试验的提取时间。
2.2.1.7 超声波功率的选择

图6 提取时间对峰面积的影响Fig. 6 The influence of extraction time on the peak of luteolin、Hyperoside
称取5 g刺玫果粉,精密称定,放入圆底烧瓶中,加入浓度为0.4 mol·L-1的1-丁基-3-甲基咪唑硝酸盐70%乙醇水溶液,放入超声机中,超声波功率分别为100、120、140、160、180 W,料液比为1∶22(g∶mL),提取水浴温度设定为80 ℃,其他操作按2.2.1.1中所述方法进行,测定木犀草素、金丝桃苷的峰面积。试验结果见图7,由图7可知,随着超声波功率的不断增加,木犀草素、金丝桃苷的峰面积不断增加,当超声波功率继续提高到最高值时,二者的峰面积均达到了最大值。分析其原因,可能因为随着超声波功率的提高,超声波对刺玫果细胞的破碎程度不断增大,从而加速了木犀草素、金丝桃苷的溶解。
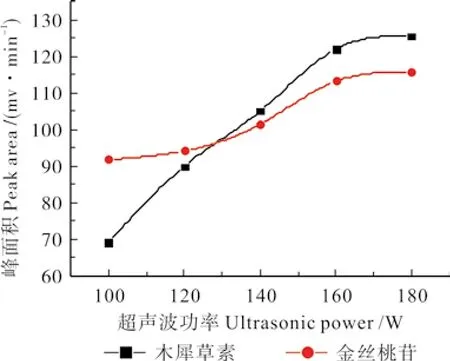
图7 超声波功率对峰面积的影响Fig. 7 The influence of ultrasonic power on the peak of luteolin、Hyperoside
2.2.2 正交试验结果
根据单因素试验结果,将提取水浴温度固定为80 ℃,超声波功率固定为180 W,选择提取溶剂乙醇体积分数、离子液体浓度、料液比、提取时间作为考察因素,按四因素三水平进行试验,正交试验的因素与水平见表3,正交试验结果分别见表4与表5。
正交试验结果表明:离子液体超声辅助提取玫果木犀草素的最优方案为A3B3C3D1,各因素的影响大小为:离子液体浓度>提取时间>料液比>乙醇体积分数。而提取刺玫果金丝桃苷的最优方案为A2B3C3D3,各因素的影响大小为:料液比>提取时间>离子液体浓度>乙醇体积分数。考虑到乙醇体积分数无论对提取木犀草素还是提取金丝桃苷的影响都最小,从生产成本上考虑,可选择70%乙醇水溶液为提取溶剂;而考虑到提取时间对二者峰面积之和的影响情况,选择超声提取时间为90 min。最终确定的离子液体超声辅助同时提取刺玫果木犀草素及金丝桃苷的最优方案为A2B3C3D3,即离子液体为1-丁基-3-甲基咪唑硝酸盐、离子液体浓度为0.45 mol·L-1、料液比为1∶25、提取溶剂为70%乙醇水溶液、提取时间为90 min、提取温度为80 ℃,超声波功率为180 W。

表3 正交试验的因素与水平Table 3 The table of factors and levels

表4 离子液体超声辅助提取刺玫果中木犀草素的正交试验设计及试验结果Table 4 Orthogonal array design arrangement and the experimental data
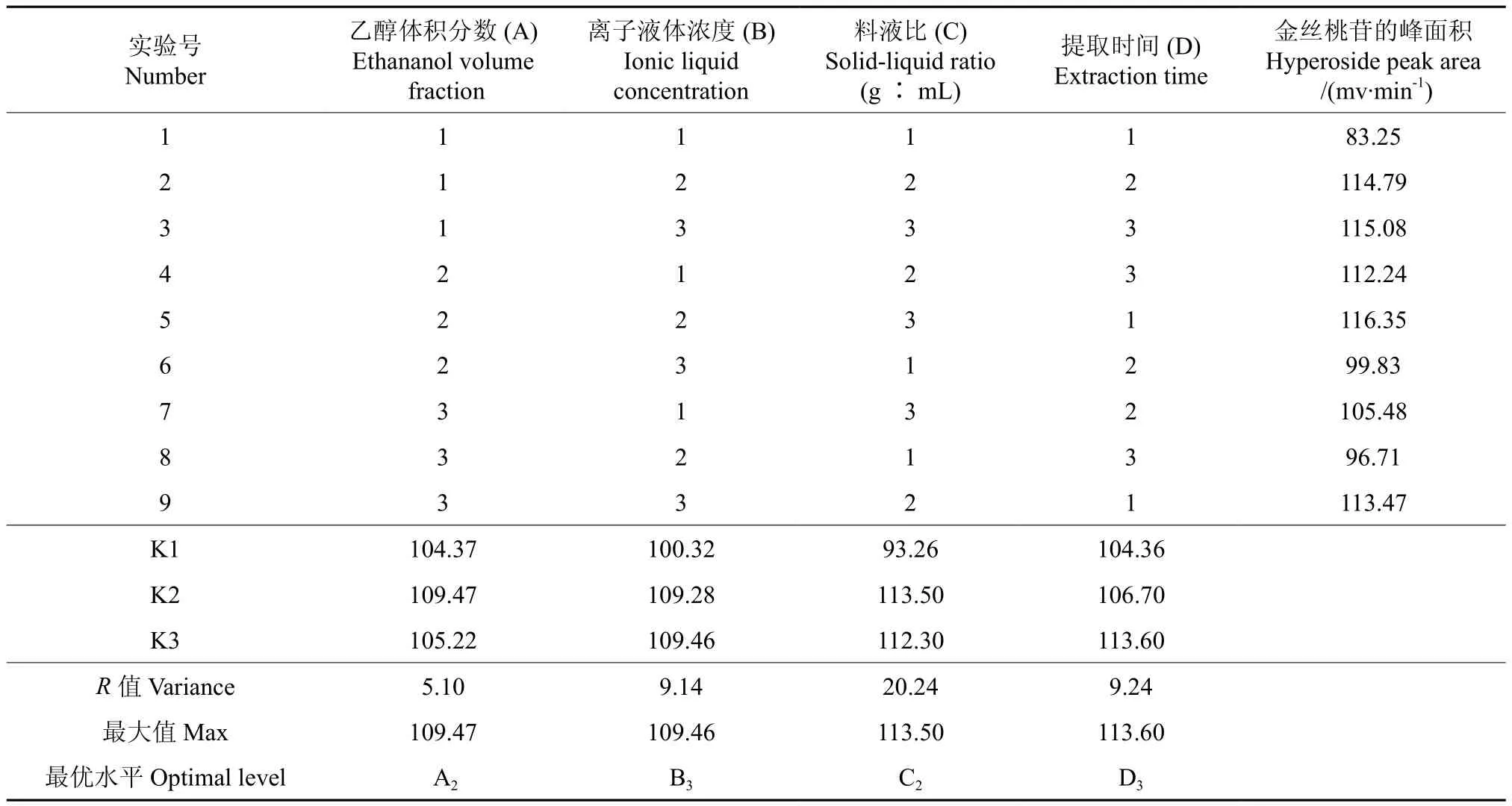
表5 离子液体超声辅助提取刺玫果中金丝桃苷的正交试验设计及试验结果Table 5 Orthogonal array design arrangement and the experimental data
2.2.3 工艺验证性试验
称取刺玫果粉3份,每份5 g,精密称定,放入圆底烧瓶中,加入浓度为0.45 mol·L-1的1-丁基-3-甲基咪唑硝酸盐70%乙醇水溶液,放入超声机中,料液比为1∶25,设定水浴温度为80 ℃,超声波功率180 W,提取时间90 min,过滤,滤液转移到50 mL的容量瓶中,70%乙醇定容,摇匀,用微孔滤膜(0.45 μm)滤过,弃去初滤液,取续滤液作为供试品溶液。按照2.1.3中所述的色谱条件,分别进样20 μL,测定木犀草素、金丝桃苷的峰面积。3次试验结果均表明:木犀草素的峰面积分别为135.58、131.28、136.13 mv·min-1,其平均值为134.33 mv·min-1,RSD 均为1.98%;金丝桃苷的峰面积分别为131.18、126.83、130.28 mv·min-1,其平均值为129.46 mv·min-1,RSD均为1.77%。这一验证性试验结果表明,在优化的提取条件下,木犀草素、金丝桃苷的提取率分别为11.99、25.36 μg·g-1,且优选的离子液体超声辅助提取工艺比较稳定。
2.2.4 离子液体辅助提取刺玫果中木犀草素、金丝桃苷的对比试验
称取刺玫果粉3份,每份5 g,精密称定,放入圆底烧瓶中,加入70%乙醇水溶液,放入超声机中,料液比为1∶25,设定水浴温度为80 ℃,超声波功率180 W,提取时间90 min,过滤,滤液转移到50 mL的容量瓶中,70%乙醇定容,摇匀,用微孔滤膜(0.45 μm)滤过,弃去初滤液,取续滤液作为供试品溶液。按照2.1.3中所述色谱条件,分别进样20 μL,测定木犀草素、金丝桃苷的峰面积。提取体系中不加入离子液体,其他操作条件与2.3.3中所述相同,3次试验结果均表明:木犀草素的峰面积分别为104.80、98.10、101.49 mv·min-1,其平均值为101.43 mv·min-1,其提取率为8.76 μg·g-1;金丝桃苷的峰面积分别为92.28、86.58、88.46 mv·min-1,其平均值为89.11 mv·min-1,其提取率为17.01 μg·g-1。根据2.3.3中所述的试验结果可知,离子液体的加入使木犀草素峰面积提高了32.44%、提取率提高了36.87%;使金丝桃苷峰面积提高了45.28%,提取率提高了49.09%。
3 结论与讨论
(1)本试验对采用HPLC法同时测定刺玫果中木犀草素、金丝桃苷含量的测定方法进行了考察,结果表明,所建立的测定方法操作简便,精密度高,重复性及线性关系均良好,木犀草素、金丝桃苷的平均回收率分别为97.49%、101.07%。
(2)本试验采用超声波辅助离子液体法对刺玫果中的木犀草素、金丝桃苷进行了提取,试验结果表明,最佳提取工艺为:离子液体浓度为0.45 mol·L-1,料液比为1∶25,乙醇体积分数为70%,提取温度为80 ℃,提取时间为90 min,超声波功率180 W。在此优化的提取条件下,木犀草素、金丝桃苷的提取率分别为11.99、25.36 μg·g-1。这比王正军[29]等人对刺玫果中金丝桃苷的提取效果有显著的提高。
(3)提取体系中不加入离子液体,试验结果表明,木犀草素的峰面积平均值为101.43 mv·min-1,其提取率为8.76 μg·g-1;金丝桃苷的峰面积平均值为89.11 mv·min-1,其提取率为17.01 μg·g-1。离子液体的加入使木犀草素峰面积提高了32.44%、提取率提高了36.87%;使金丝桃苷峰面积提高了45.28%,提取率提高了49.09%。
(4)试验结果表明,添加有离子液体的乙醇水溶液所提木犀草素、金丝桃苷的提取率比纯乙醇水溶液的高,这可能因为,离子液体对植物纤维素的溶解能力较高,有利于目标成分的溶出,从而使提取率提高。该方法具有快速、高效、环保等优点,试验结果为刺玫果活性成分的提取提供了一种新方法。
