外源性硫化氢减轻小鼠阻塞性肾损伤*
2018-07-27王红钢程会军吴东栋刘正国吉爱玲李彦章
王红钢, 程会军, 吴东栋, 王 军, 刘正国, 吉爱玲, 李彦章
(河南大学基础医学院, 河南 开封 475004)
慢性肾病是世界上一种普遍的疾病,肾小球滤过率逐渐降低和肾间质纤维化,继而发生肾衰竭是其重要特征,其中肾小管间质纤维化是慢性肾病的主要决定因素,其发生于肾单位和集合管之间的间叶组织,是在损伤、阻塞和感染等因素作用下,成纤维细胞被激活并增殖,细胞外基质过度聚集,肾小管上皮细胞凋亡以及转分化等因素参与的病理过程,现已成为全球范围内的医学难题[1]。
自噬是真核细胞中一种高度保守的生理过程,是细胞利用溶酶体降解和清除胞内受损或衰老的细胞器以及功能异常的蛋白质,并使降解产物循环使用,参与调节细胞内外环境稳态的维持和细胞生长、增殖等正常生理过程[2-5],其具体生理功包括:(1)清除受损的细胞,维持细胞内环境稳定;(2)调节固有免疫和适应性免疫;(3)诱导细胞死亡;(4)参与延长细胞寿命[6]。在生理条件下,自噬常常维持在一个基础水平,在一定的外因诱导下可被增强,比如缺血、缺氧以及营养缺乏等[7-8];在机体病理状态下,显著增强的细胞自噬可清除胞内异常蛋白,有利于细胞生存。但自噬对细胞的作用是“双刃剑”,若自噬持续维持在一个较高水平,则可导致细胞自噬性死亡[9-10]。自噬可依据待降解物传递给溶酶体的途径分为巨自噬、微自噬和分子伴侣介导的自噬(胞浆蛋白直接进入溶酶体降解),其中巨自噬是目前研究最多的自噬[11]。近年来的研究显示,细胞自噬对于维持合成、分解和细胞成分再利用的平衡有重要作用[12],细胞自噬异常参与肝病、肿瘤、衰老、心血管疾病、神经退行性疾病和肾脏疾病等病理过程的发生和发展[13]。
硫化氢(hydrogen sulfide,H2S)是一种无色、有臭鸡蛋气味的气体,是继一氧化碳(carbon monoxide,CO)和一氧化氮(nitric oxide,NO)之后第3类气体信号分子,以前一直被认为是有毒气体,自上世纪90年代被发现其具有多种重要功能,可调控多种生理及病理过程[14-15]。在哺乳动物的细胞中,H2S的主要在肝脏通过酶促反应途径和非酶促反应途径生成,以前者为主。酶促反应途径是以半胱氨酸为底物,在胱硫醚γ-裂解酶(cystathionine γ-lyase,CSE)、胱硫醚β-合成酶(cystathionine β-synthase,CBS)和3-巯基丙酮酸硫基转移酶(3-mercaptopyruvate sulfurtransferase,3-MST)的催化下产生[16]。一般来说,H2S在毫摩尔浓度范围内才显现机体毒性,体内生理水平的H2S(50~160 μmol/L)对人体具有抗氧化、抗炎和保护神经等多种有益作用[17-18],对细胞凋亡、物质代谢、炎性损伤和氧化应激等过程均有调节作用,比如外源性硫化氢可促进非酒精性脂肪肝脂质分解[19-21]。近年来的研究表明,H2S在阻塞性肾疾病中对机体具有的保护作用,可缓解肾组织纤维化的改变,但其作用机制还未完全搞清楚。本实验通过构建阻塞性肾损伤的单侧输尿管结扎(unilateral ureteral obstruction,UUO)模型,探讨外源性硫化氢在小鼠UUO引起的肾纤维化过程中的作用及可能的机制,以期为研发H2S相关的药物提供理论依据。
材 料 和 方 法
1 材料
1.1动物及分组 C57BL/6 小鼠购自南京大学模式动物研究所,在室温(22±2) ℃,湿度50%~70%,标准清洁级环境喂养,并模拟正常的昼夜交替。选取8周龄的健康雄性 C57BL/6 小鼠15只,随机分为3组:假手术(sham)组、手术(operation)组和硫化氢处理(H2S)组。假手术组:腹腔内注射戊巴比妥钠麻醉后,剪开腹腔左肋部皮肤一个小口,肌肉钝性分离,然后分别缝合肌肉和皮肤;手术组:注射戊巴比妥钠麻醉后,剪开腹腔左肋部皮肤一个小口,肌肉钝性分离,找到肾脏和输尿管,在输尿管上结扎两道,在2个结扎点之间把输尿管剪断,然后分别缝合肌肉和皮肤;硫化氢处理组:按照手术组处理后,硫氢化钠称量后按合适的比例溶于生理盐水中,按照剂量50 μmol/kg体重腹腔注射。假手术组和手术组每日腹腔注射同样体积的生理盐水,每天1次,1周后处死小鼠,取出左肾,从肾脏中央切开,一部分放置入4%的中性甲醛中固定做切片,另一部分迅速放入液氮中冷处理后放入-80 ℃冰箱中冷藏,用于提取蛋白和RNA。
1.2主要试剂 TRIzol购自Invitrogen;反转录试剂盒购自TaKaRa;辣根过氧化酶标记的羊抗鼠/兔IgG和抗纤连蛋白(fibronectin,FN)抗体购自北京中杉金桥生物公司;兔抗LC3和beclin-1抗体购自Santa Cruz;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所。
2 方法
2.1RNA的提取 取50 mg的肾脏组织和l mL的TRIzol放在匀浆器中,研磨粉碎肾脏组织,室温下裂解5 min,将液体转移入EP管中,加入200 μL三氯甲烷,充分混匀,室温放置2~3 min,12 000 r/min离心15 min。将上清吸至另1新的的EP管中,加入等体积的异丙醇,混合,室温静置10 min,然后4 ℃、12 000 r/min离心10 min,弃上清,加入1 mL预冷的75%乙醇洗涤,4 ℃、12 000 r/min 离心3 min,弃上清,白色沉淀即是RNA样品,用50 μL的 RNase free水将RNA溶解,依据TaKaRa的反转录试剂盒说明书进行的反转录反应。
2.2RT-PCR 反转录得到的cDNA用于RT-PCR。PCR的反应程序为94 ℃预变性2 min;93 ℃变性30 s, 58 ℃退火45 s, 72 ℃延伸45 s,35个循环。CBS的上游引物为5’-TTATCACACAGTGCTGACCAAA-3’,下游引物为5’-TTCTCCATACTCATCTTCTCCG-3’;CSE的上游引物为5’-TTCCTGCCTAGTTTCCAGCAT-3’,下游引物为5’-GGAAGTCCTGCTTAAATGTGGTG-3’; 3-MST的上游引物为5’-TTCATCAAGACCCACGAGGACA-3’,下游引物为5’-TGGCCAGGTTCGATGCCATCTC-3’; 18S rRNA的上游引物为5’-AGAGTCGGCATCGTTTATGGTC-3’,下游引物为5’-CGAAAGCATTTGCCAAGAAT-3’。
2.3HE染色 将已放入蒸馏水后的切片放入苏木精溶液中染色8 min,自来水冲洗2 min后蒸馏水浸泡1 min,在70%和90%乙醇中脱水各10 min,再放入乙醇伊红染色液染色3 min。染色后的切片经纯乙醇脱水,再经二甲苯处理使切片透明,将已透明的切片滴上树胶,盖上盖玻片封固。显微镜下观察。
2.4Masson染色 石蜡切片经脱蜡处理后双蒸水润湿玻片60 s,R1核染液染色50 s,然后迅速倒掉染色液,冲洗液冲洗40 s左右,R2细胞浆染液染色60 s,吸掉染液,冲洗液冲洗40 s左右,R3分色液分色10 min,吸掉分色液。不要用冲洗液冲洗,直接用R4复染液复染3~5 min,再吸掉复染液,在无水乙醇中洗干净玻片,直至玻片无蓝色为止,迅速吹干玻片,用甘油明胶进行封片、做好玻片记号。光镜下观察以上各种染色的肾组织形态学变化,拍照记录。
2.5血清中胱抑素C的检测 使用肝素钠润洗针管后抽取血液,将血放入EP管后在4 ℃条件下,1 000 r/min离心20 min,所得血浆使用免疫比浊法检测,仪器为罗氏cobas® 8000全自动生化免疫分析仪。
2.6Western blot实验 取30 mg的肾脏组织,PBS清洗细胞3遍,加入RIPA裂解液200 μL,匀浆器研磨后,用超声波裂解,再在冰上裂解。然后在4 ℃、12 000 r/min离心10 min。取出上清液保存。取所得到的部分上清液加到PBS中稀释混匀,按“BCA法测蛋白”步骤进行蛋白定量,上样50 μL,100 V电泳45~60 min,转膜后取出PVDF膜,用TBS清洗10~15 min。 I 抗用含脱脂奶粉的TBST稀释(1∶1 000),室温孵育2 h, TBST缓冲液洗PVDF膜3次,每次10 min,加入 II 抗(1∶1 000稀释,HRP标记)室温孵育2 h, TBST缓冲液洗PVDF膜3次,每次10 min,加入显色液照相保存结果。
3 统计学处理
采用Prism 5统计软件进行统计分析。数据以均数±标准差(mean±SD)表示,采用t检验分析2组均数间的差异,采用单因素方差分析检验3组和3组以上均数间的差异,以P<0.05 表示差异有统计学意义。
结 果
1 UUO对催化内源性H2S产生的酶mRNA表达的影响
RT-PCR结果表明,UUO手术后,催化内源性H2S产生的CBS、CSE和3-MST mRNA表达均显著降低(P<0.05),见图1。
2 外源性H2S减轻UUO模型肾脏结构损伤
假手术组小鼠左侧肾脏组织HE染色结果显示,肾脏结构完整,各个细胞形态正常;手术组小鼠肾小管之间出现有明显的间隙,肾组织中可见到明显的间质水肿,大量上皮细胞坏死,管腔明显扩张,肾小球萎缩;H2S组小鼠左侧肾脏组织间质轻度水肿,部分管腔扩张,与手术组小鼠相比,肾小管间的间隙减小,肾组织病理变化显著改善,见图2。
3 外源性H2S对UUO模型小鼠肾功能损伤有保护作用
手术组小鼠血浆胱抑素C显著高于假手术组,而给予外源性H2S则可显著降低血浆胱抑素C水平(P<0.05),见图3。
4 外源性H2S减轻UUO小鼠肾脏纤维化
假手术组小鼠肾脏Masson染色切片显示肾脏结构完整,间质有少许蓝色胶原纤维;手术组肾脏Masson染色切片显示肾小管之间出现有明显的间隙,存在大量染色成蓝色的胶原纤维,提示肾间质显著纤维化;H2S组肾组织Masson染色切片显示肾小管之间可见染成蓝色的胶原纤维,与手术组相比显著减少,见图4。
5 外源性H2S下调UUO小鼠肾脏中FN的蛋白表达
Western blot 结果显示,与假手术组相比,手术组和H2S组肾组织中FN的蛋白表达显著升高;与手术组相比,H2S组肾组织中FN的蛋白表达显著降低(P<0.05),见图5。
6 外源性H2S上调UUO小鼠肾脏细胞自噬水平
Western blot结果显示,与假手术组相比,手术组和H2S组小鼠肾组织细胞中LC3-II和beclin-1蛋白表达均显著增高,而H2S组小鼠肾组织细胞中LC3-II和beclin-1蛋白表达又显著高于手术组,提示外源性H2S可通过上调细胞自噬水平而减轻UUO小鼠肾脏组织纤维化,见图6。

Figure 1. The effect of UUO on the mRNA expression of the catalytic enzymes of endogenous H2S. Mean±SD.n=3.△P<0.05vssham group.
图1UUO对催化内源性H2S产生酶的mRNA表达的影响
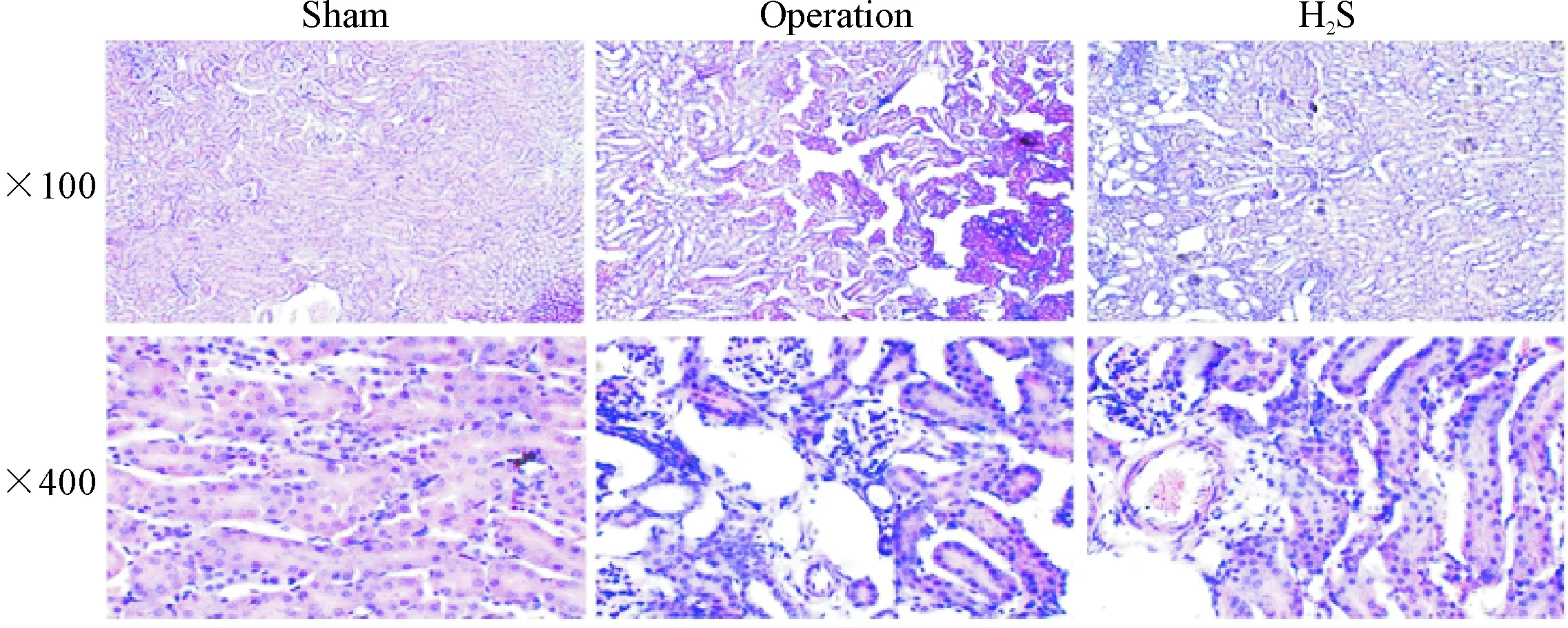
Figure 2. The exogenous H2S mitigated renal injury in UUO mice (HE staining).
图2外源性H2S减轻UUO模型小鼠肾脏结构损伤
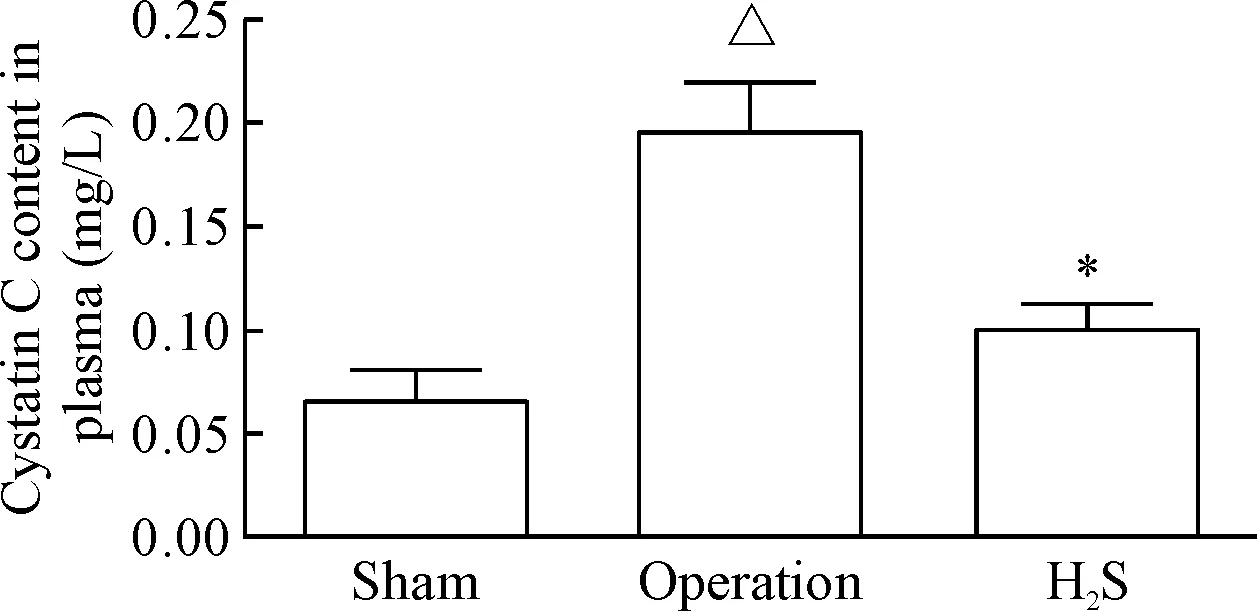
Figure 3. The effect of exogenous H2S on the changes of cystatin C content in the plasma. Mean±SD.n=3.△P<0.05vssham group;*P<0.05vsoperation group.
图3外源性H2S对血浆胱抑素C含量的影响
讨 论
UUO模型是阻塞性肾病肾小管间质纤维化的一个典型的模型,体现了阻塞性肾损伤的典型特征,已被应用于多个研究,可快速地形成阻塞性肾病,但肾脏输尿管完全阻塞在人体鲜见,这是UUO模型的不足之处[22]。本研究中手术组小鼠肾小管之间出现有明显的间隙,肾组织中可见到明显的间质水肿;大量上皮细胞坏死,管腔明显扩张;肾小球萎缩以及肾小球滤过率显著下降,提示UUO构建成功,经H2S处理后,肾组织间质水肿,管腔扩张和间质纤维化等均明显改善,提示H2S对阻塞性肾损伤有保护作用。胱抑素C广泛存在于哺乳动物各组织器官中,因其仅能够经肾小球滤过而排出体外,故胱抑素C可作为反映肾小球滤过率变化的内源性标志,也是临床上用于检测肾小球早期受损以及评价肾功能的内源性分子。本实验UUO建模后小鼠血浆胱抑素C显著升高,给予外源性H2S则可显著降低血浆胱抑素C水平,提示外源性H2S对阻塞性肾损伤有保护作用。
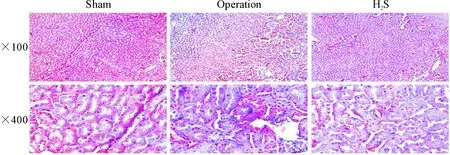
Figure 4. The exogenous H2S attenuated renal fibrosis in UUO mice (Masson staining).
图4外源性H2S减轻UUO模型小鼠肾脏纤维化
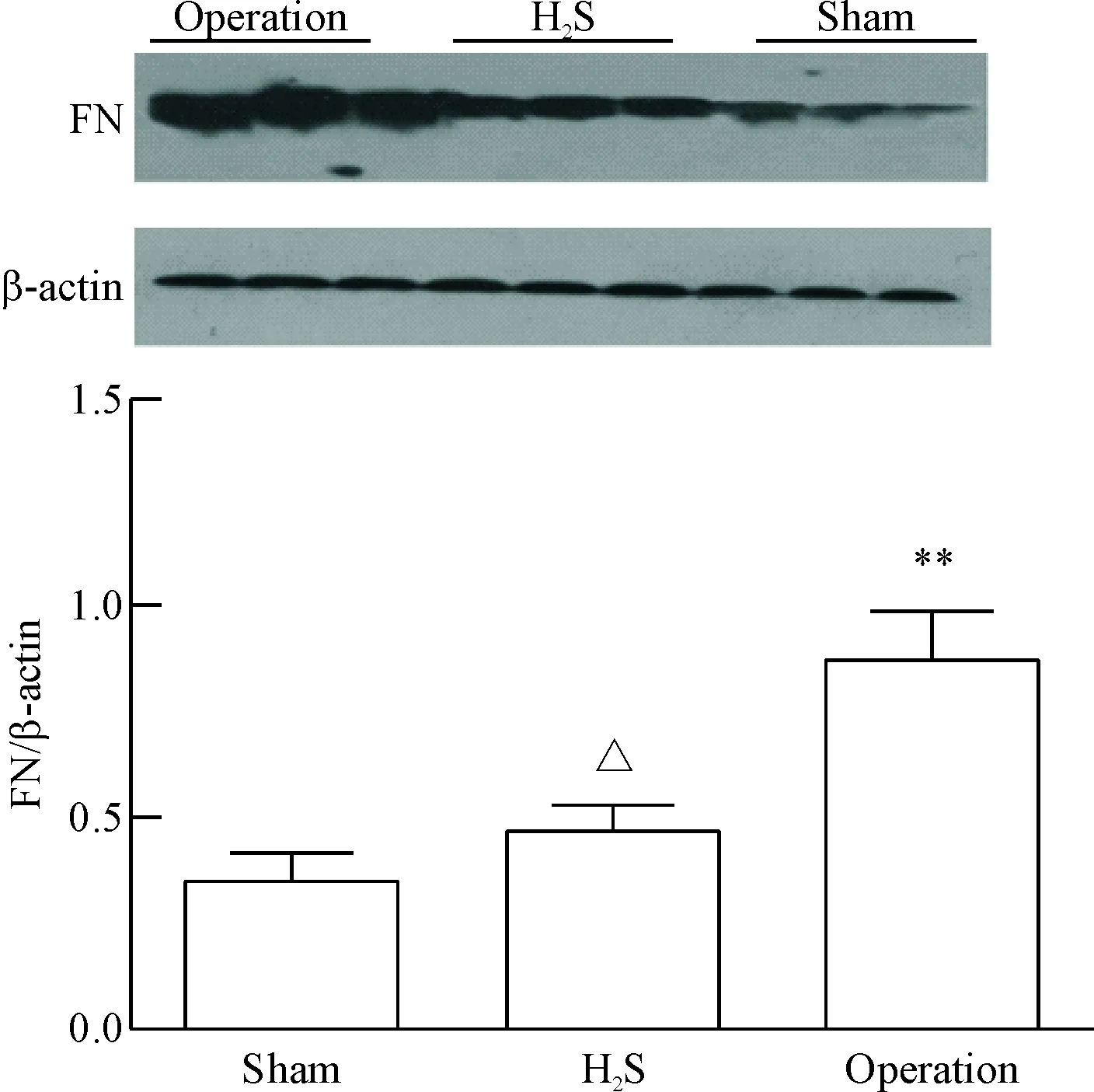
Figure 5. The exogenous H2S down-regulated the protein expression of fibronectin (FN). Mean±SD.n=3.**P<0.01vssham group;△P<0.05vsoperation group.
图5外源性H2S下调纤维连接蛋白的表达
H2S是近年来发现的一种具有重要的机体保护作用的气体信号分子。研究表明,H2S可通过影响细胞自噬发挥抗组织纤维化的作用,在鼠肾小球内皮细胞中,高糖可下调AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)的磷酸化,抑制自噬,导致细胞基质蛋白过度沉积,引起肾小球基质重塑增生,而给予外源性H2S则可通过促进AMPK磷酸化,上调细胞自噬水平,抑制细胞基质蛋白合成并促进其降解和清除,从而改善高糖导致的基质纤维化[23];高糖还可减少鼠内源性H2S的产生,激活细胞自噬,抑制PI3K/Akt1途径,诱导心肌发生纤维化改变,而给予外源性H2S则可逆转上述变化,对糖尿病心肌具有保护作用[24]。在小鼠酒精性心肌纤维化过程中,H2S可通过下调miR-21和miR-211的表达,调节PI3K/Akt1和TGF-β1信号途径,抑制细胞自噬,缓解乙醇所致的心肌纤维化[25]。而H2S在阻塞性肾损伤导致的纤维化过程中的作用及机制还未见报道。FN是1974年发现的一种高分子量糖蛋白,和肾脏纤维化紧密相关,是评估组织纤维化水平的一个指标;LC3-II和beclin-1是细胞自噬水平的蛋白标志物,其蛋白表达量和细胞自噬强弱呈正相关。本实验结果显示,和假手术组相比,手术组肾组织中FN、LC3-II和beclin-1的蛋白表达显著升高,给予外源性H2S后的肾组织中FN蛋白表达显著降低,LC3-II和beclin-1的蛋白表达又显著升高,提示外源性H2S可显著改善阻塞性肾损伤引起的肾间质纤维化,其机制可能是通过上调细胞自噬水平实现的,此推测还需后续实验进一步论证。
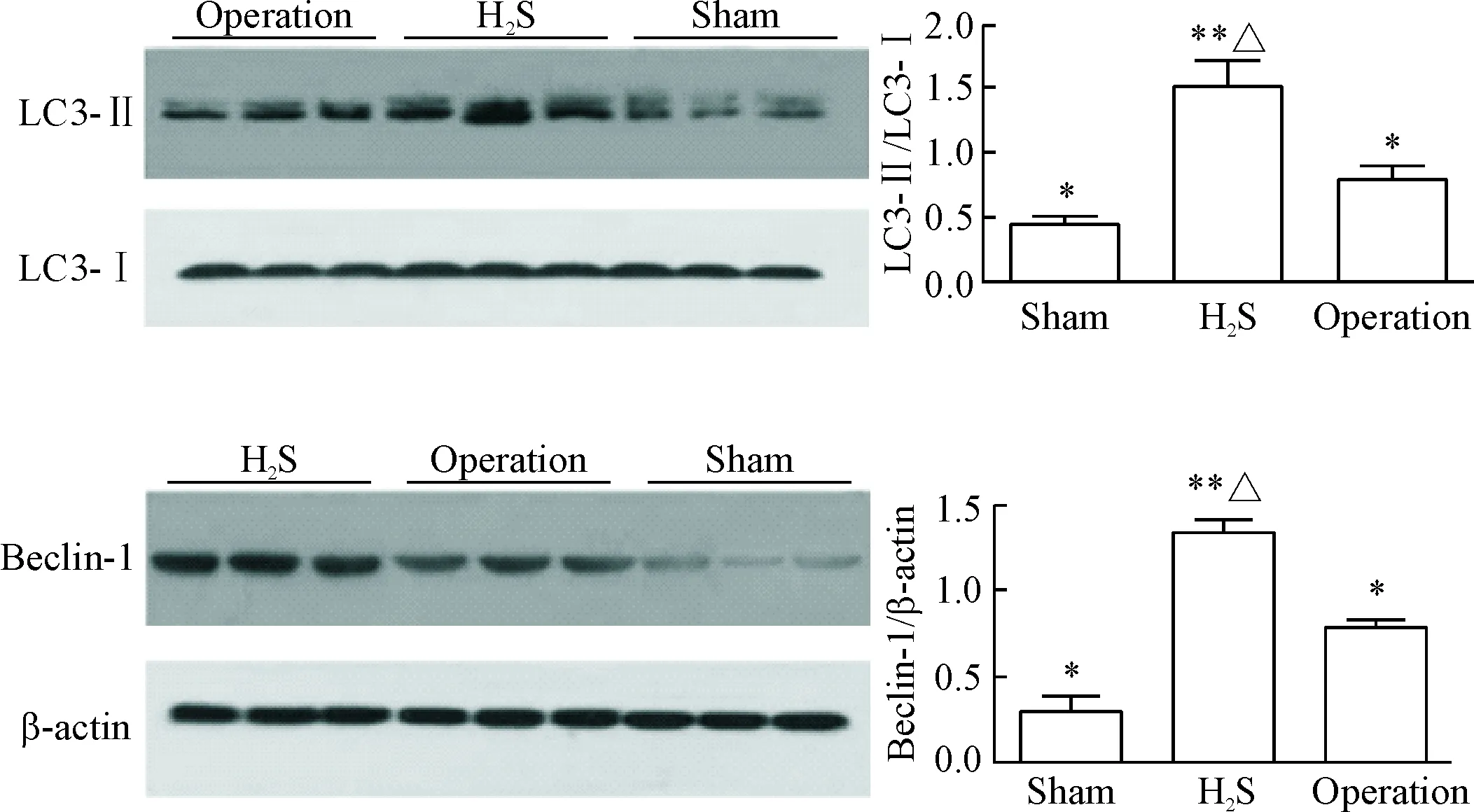
Figure 6. The exogenous H2S up-regulated the autophagy of renal cells in UUO mice. Mean±SD.n=3.*P<0.05,**P<0.01vssham group;△P<0.05vsoperation group.
图6外源性H2S上调UUO模型小鼠肾脏细胞自噬水平
