CXCR4 siRNA通过抑制STAT3信号通路抑制肺癌细胞活力
2018-07-27郭伟峰何约明庄锡彬黄鸿波林艺坚寇美丽
郭伟峰, 何约明, 庄锡彬, 黄 弘, 徐 萌, 黄鸿波, 林艺坚, 寇美丽
(福建医科大学附属泉州第一医院呼吸内科, 福建 泉州 362000)
肺癌是一种恶性肿瘤,其发病率和死亡率都很高,严重威胁人类的生命和健康。据统计,中国2015年约有429.2万例新发病例和281.4万例死亡病例,其中肺癌位于肿瘤死亡原因的第一位[1]。由于环境的恶化和人口的老龄化原因等,导致中国肺癌的发病率和死亡率越来越高,据估计到2025年中国肺癌的患者将达到100万左右[2]。目前肺癌的治疗主要采取放、化疗结合抗肿瘤药物,但效果甚微,肺癌患者的5年生存率从12%仅上升为16%[3]。肺癌是一种多基因异常引起的恶性肿瘤,多种癌基因的异常表达及抑癌基因的失活等,导致正常细胞群的增殖、凋亡等生理过程异常,但其分子机制不完全清楚,成为亟需解决的问题之一。研究表明CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)在包括肺癌在内的多种恶性肿瘤中呈过表达趋势,参与肿瘤细胞的增殖、凋亡、周期和侵袭等多个关键环节[4-5]。本实验通过RNA干扰(RNA interference, RNAi)的方法干扰CXCR4基因表达,观察敲减CXCR4基因表达对肺癌细胞活力和凋亡的影响,为在细胞水平抑制肺癌的发生、发展提供新的方法。
材 料 和 方 法
1 主要试剂与仪器
人肺癌细胞系NCI-H292购自ATCC;RPMI-1640培养基购自HyClone;胎牛血清(fetal bovine serum,FBS)购自Gibco;CXCR4小干扰RNA(small interfe-ring RNA, siRNA;正义链为5’-CGUUCCUAUUGCAUUATT-3’,反义链为5’-UAAUGCAAUAGCAGGACAGTT-3’)由上海吉玛有限公司合成; 蛋白裂解液购自Thermo;Lipofectamine 2000 转染试剂盒购自英杰生命技术有限公司;STAT3抑制剂NSC 74859和抗β-actin抗体购自Sigma;抗信号转导子及转录激活子3(signal transducer and activator of transcription 3,STAT3)、p-STAT3、细胞周期蛋白D1(cyclin D1)、cleaved caspase-3、多聚ADP-核糖聚合酶1[poly (ADP-ribose) polymerase 1, PARP1]抗体和辣根过氧化物酶HRP标记羊抗兔 II 抗均购自Cell Signaling Technology。流式细胞分析仪购自BD;CO2恒温细胞培养箱和离心机均购自Thermo;垂直电泳槽和转膜槽购自Bio-Rad。
2 方法
2.1细胞培养 人肺癌细胞NCI-H292培养于RPMI-1640培养基中,加入10%的FBS和双抗,确保细胞培养过程中的无菌性,置于37 ℃、5% CO2的细胞培养箱中培养,每3 d按1 ∶3的比例进行传代。选择生长状态良好的对数生长期细胞进行实验。
2.2细胞的转染 将NCI-H292细胞经PBS缓冲液清洗后接种于24孔板上,每孔4×105个细胞,在37 ℃、5% CO2的细胞培养箱中培养至细胞的融合度达到80%左右时,根据Lipofectamine 2000转染试剂说明书进行转染从而获得稳定过表达目的基因的细胞。实验分为空白对照(control)组(未转染的细胞)、阴性对照(negative)组(转染无关序列RNA)和siRNA-CXCR4组(转染siRNA-CXCR4),转染48 h后采用Western blot法检测细胞转染效果。
2.3CCK-8法检测转染细胞的活力 细胞经胰酶消化,以每孔2×103个细胞接种于96孔培养板上,加入不含抗生素的培养基,在37 ℃、5% CO2恒温培养箱中培养,每组设5个复孔。待细胞转染48 h后,每孔加入100 μL新鲜培养液和10 μL CCK-8溶液,置于酶标仪上检测450 nm波长处的吸光度(A)值,实验重复3次,计算各组细胞的存活率。
2.4流式细胞术检测细胞的凋亡情况 取生长状态良好的细胞,以2.5×105个细胞接种于培养瓶中,培养48 h后,将细胞收集到离心管中,离心,加入预冷的PBS缓冲液洗涤,逐滴加入75%的乙醇,调整细胞浓度,按照Annexin V-FITC/PI双染色试剂盒说明书进行操作,用流式细胞术检测细胞的凋亡率。
2.5Western blot检测转染细胞中STAT3、p-STAT3、cyclin D1、cleaved caspase-3和PARP1的蛋白水平 取1×106个细胞接种于细胞培养瓶中,更换为无血清培养基,按上述分组处理细胞后,弃去培养基,加入预冷的D-Hanks溶液和200 μg PMSF混合裂解液,混匀,置于冰上裂解30 min,4 ℃离心20 min,取上清,Bradford法测定蛋白浓度。清洗、安装电泳槽的玻璃模具,制备10%的分离胶和5%堆积胶,插入梳子,避免气泡产生。取50 μg蛋白样品加入上样孔,100 ℃加热5 min,加入电泳缓冲液,进行SDS-PAGE电泳,80 V电泳30 min,然后调至120 V电泳120 min。切下分离胶,加入转移缓冲液,转膜3~4 h,5%脱脂牛奶封闭1~2 h,加入1 ∶1 000稀释的 I 抗,4 ℃孵育过夜,TBST洗膜4次,每次15 min,加入 II 抗,37 ℃孵育1~2 h,TBST清洗15 min×4次,将ECL显色液加入滤膜上,暗室中孵育5 min,以β-actin为内参照,凝胶成像系统中测定蛋白的灰度值。
2.6STAT3抑制剂对肺癌细胞的活力和凋亡的影响 根据何志勇等[6]的报道,文本采用50 μmol/L的NSC-74859作用于已转染的肺癌细胞48 h,实验分为空白对照(control)组、siRNA-CXCR4组和抑制剂(inhibitor)组,根据上述方法,Western blot检测细胞中p-STAT3蛋白的表达量,CCK-8实验和流式细胞术分别检测细胞的活力和凋亡率。
3 统计学处理
用SPSS 22.0进行统计学分析,计量资料均以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间差异使用Bonferroni校正的t检验,以P<0.05为差异具有统计学意义。
结 果
1 转染效果的检测
如图1所示,各组间CXCR4蛋白表达量的差异有统计学显著性(P<0.05);与空白对照组相比,阴性对照组细胞中CXCR4蛋白的表达量无明显变化,而siRNA-CXCR4组细胞中CXCR4蛋白的表达量显著降低(P<0.05)。
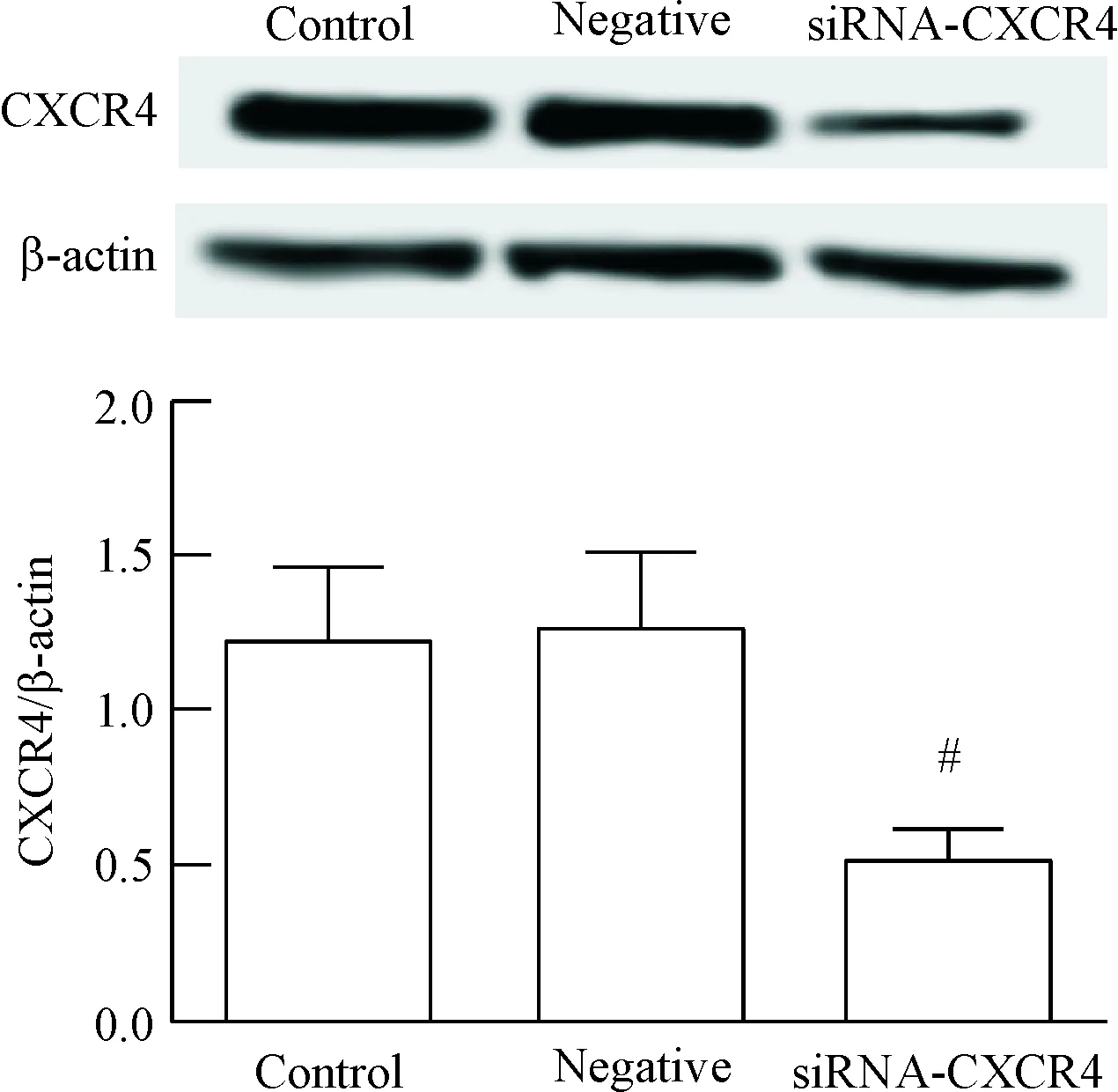
Figure 1. The protein expression of CXCR4 in transfected cells.Mean±SD.n=3.#P<0.05vscontrol group.
图1转染后细胞中CXCR4蛋白的表达量
2 敲减CXCR4基因表达后细胞活力的变化
如图2所示,各组间细胞活力的差异有统计学显著性(P<0.05);与空白对照组相比,阴性对照组细胞的活力无明显变化,siRNA-CXCR4组细胞的存活率显著降低(P<0.05)。
3 敲减CXCR4基因表达对细胞凋亡的影响
如图3所示, 与空白对照组相比,阴性对照组细胞的凋亡率以及cleaved caspase-3和PARP1蛋白水平无明显变化,siRNA-CXCR4组细胞的凋亡率及cleaved caspase-3和PARP1蛋白水平显著增加(P<0.05)。
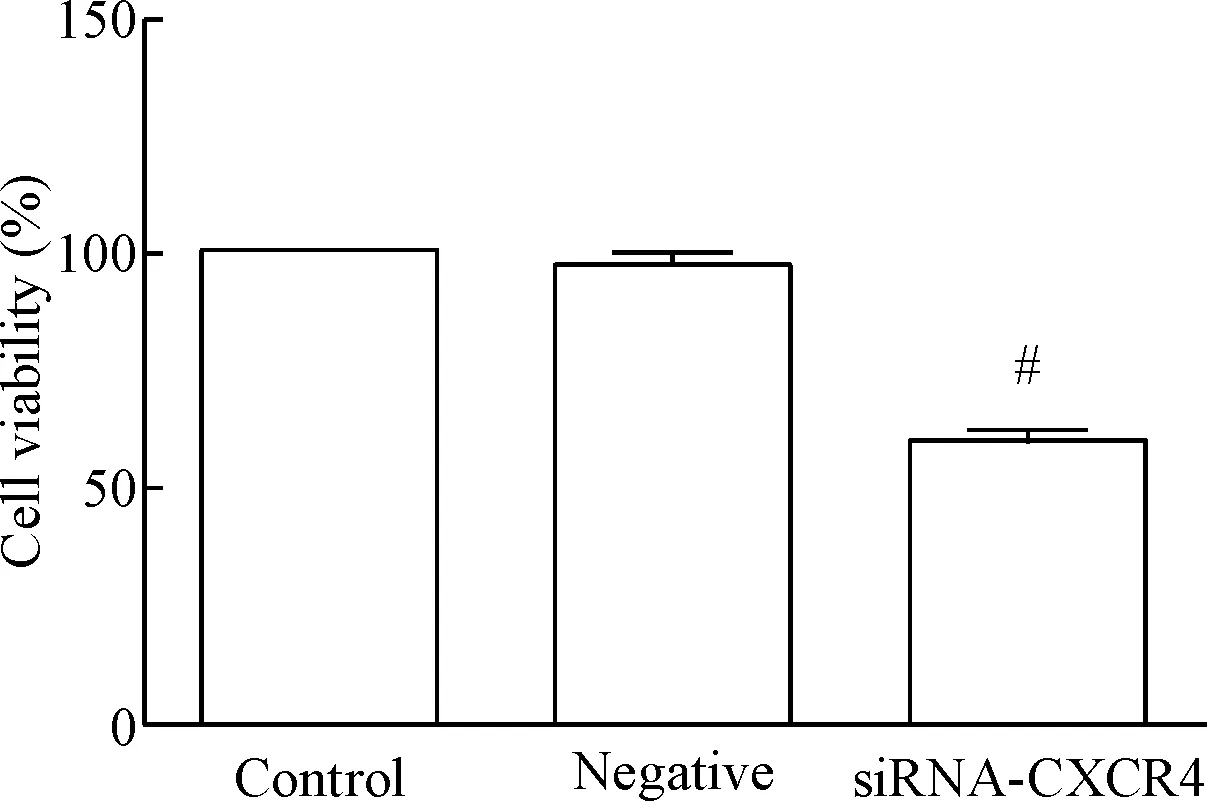
Figure 2. The effect ofCXCR4 gene expression knockdown on the viability of lung cancer cells. Mean±SD.n=3.#P<0.05vscontrol group.
图2敲减CXCR4基因表达对肺癌细胞活力的影响
4 敲减CXCR4基因表达后细胞中STAT3、p-STAT3和cyclin D1蛋白水平的变化
如图4所示,各组间蛋白水平的差异有统计学显著性(P<0.05);与空白对照组相比,阴性对照组细胞中STAT3、p-STAT3和cyclin D1的蛋白水平无明显变化,siRNA-CXCR4组细胞STAT3、p-STAT3和cyclin D1的蛋白水平显著降低(P<0.05)。
5 STAT3抑制剂对肺癌细胞活力和凋亡的影响
使用STAT3抑制剂NSC 74859作用于已转染肺癌细胞48 h,检测细胞的活力、凋亡及磷酸化STAT3水平的变化,结果如图5所示。与空白对照组相比,siRNA-CXCR4组和抑制剂组细胞中的p-STAT3蛋白水平显著降低(P<0.05);与siRNA-CXCR4组细胞相比,细胞经STAT3抑制剂作用后p-STAT3蛋白的水平显著降低(P<0.05)。与空白对照组相比,siRNA-CXCR4组和抑制剂组细胞的活力显著降低(P<0.05),凋亡率显著增加(P<0.05);与siRNA-CXCR4组相比,细胞经STAT3抑制剂作用后,活力明显下降(P<0.05),凋亡率显著增加(P<0.05)。
讨 论
趋化因子含有70~80个氨基酸,是一类与免疫应答、细胞增殖和血管生成等多种生物学行为密切相关的小分子蛋白[7]。CXCR4是最常见的趋化因子受体,在人体正常组织与细胞中低表达或者不表达,但在多种肿瘤组织中高表达[8-10]。越来越多的研究表明,CXCR4与肿瘤细胞的增殖、凋亡和侵袭等多个生物学行为有关[11]。CXCR4对人体中发挥重要的生物学效应,近年来越来越多的学者对CXCR4基因的作用进行深入研究,以期为肺癌可行性靶点治疗提供新的思路。研究表明,CXCR4可通过多条信号通路调控细胞的增殖、凋亡过程,并且诱导肿瘤血管生成,从而促进肿瘤的发生发展[12]。CXCR4可通过自分泌和旁分泌2种方式促进肿瘤细胞的增殖、血管发生和凋亡等[13-14]。临床研究也表明CXCR4通过与一系列的信号通路相互作用抑制非小细胞肺癌侵袭和迁移能力[15]。研究发现CXCR4在肺癌组织中过表达,提示CXCR4表达量增加在肺癌的演进过程中起重要作用[16]。RNAi技术是采用腺病毒、慢病毒、细菌载体、多聚复合物和纳米颗粒等载体携带目的基因以此抑制基因表达,主要用于研究基因调控的一种新手段[17-18]。因此本实验采用siRNA特异性沉默CXCR4基因结果显示肺癌细胞NCI-H292的活力受到抑制,流式细胞术的检测结果表明细胞的凋亡率增加,cleaved caspase-3和PARP1蛋白水平明显增加。但干扰CXCR4基因促进细胞凋亡的机制还不完全清楚。
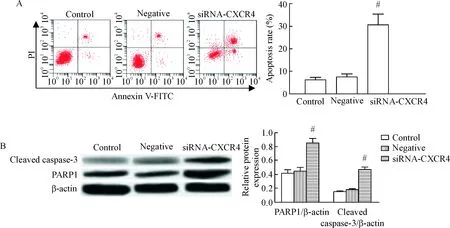
Figure 3. The effects ofCXCR4 gene expression knockdown on lung cancer cell apoptosis (A) and the related protein levels (B). Mean±SD.n=3.#P<0.05vscontrol group.
图3敲减CXCR4基因表达对肺癌细胞凋亡率和凋亡相关蛋白水平的影响
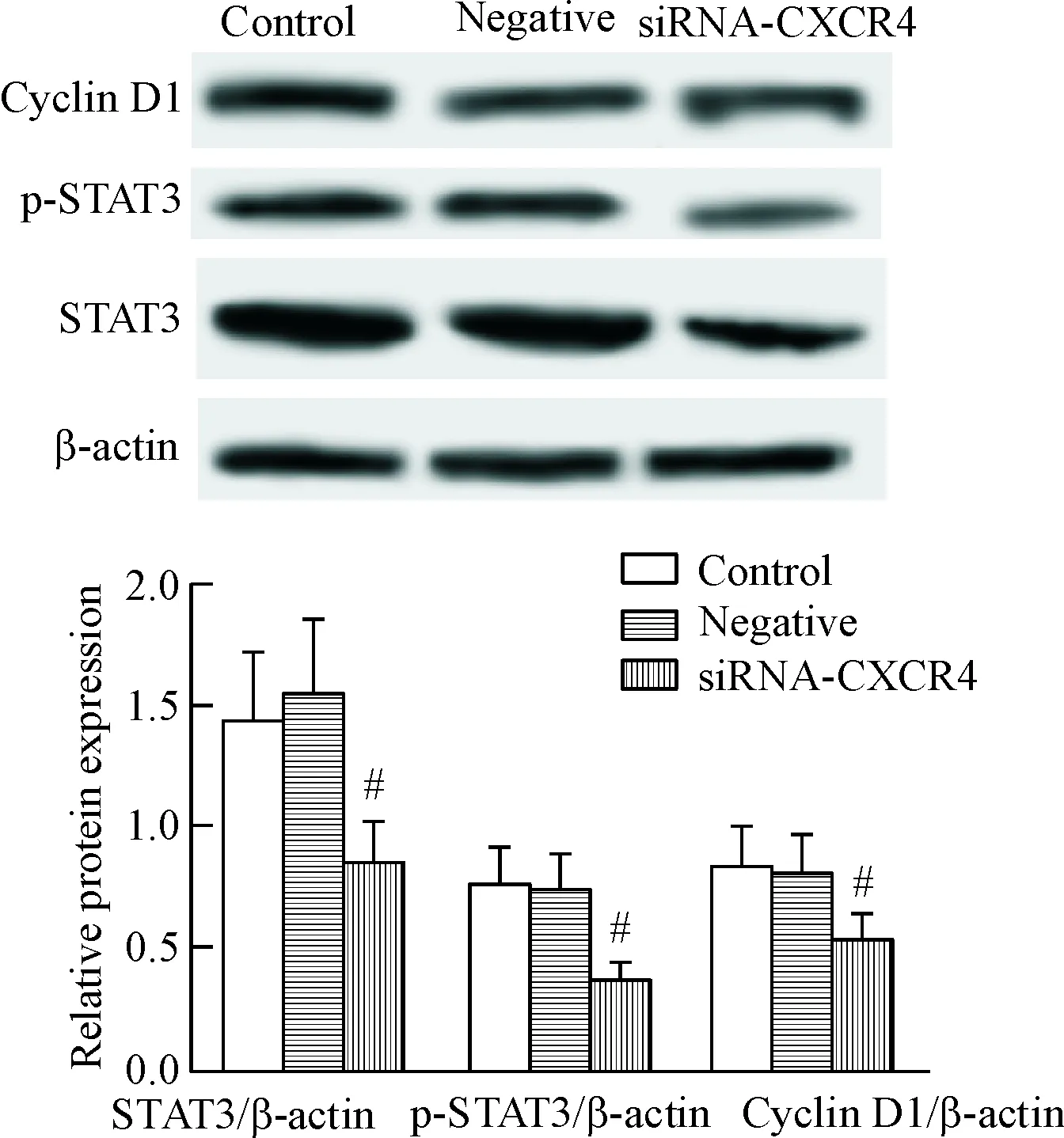
Figure 4. The effects ofCXCR4 gene expression knockdown on the protein levels of STAT3, p-STAT3 and cyclin D1 in lung cancer cells. Mean±SD.n=3.#P<0.05vscontrol group.
图4敲减CXCR4基因表达对肺癌细胞中STAT3、p-STAT3和cyclinD1蛋白水平的影响
STAT3信号通路是信号转导子和转录激活子家族的成员之一,调控多种细胞因子和生长因子的信号转导,参与细胞的生长、分化、增殖和凋亡等生物学过程[19]。近年来的研究表明,持续激活STAT3信号通路促进细胞的恶性增殖和侵袭,导致了肿瘤的发生、发展[20]。当细胞受到异常刺激时,STAT3被磷酸化成p-STAT3而形成二聚体,从细胞质中转移进入细胞核中,与DNA的反应原件结合,从而激活特定靶基因[21]。研究发现,STAT3在白血病[22]、乳腺癌[23]和膀胱癌[24]组织中异常激活,对致癌信号的调节中发挥重要作用,可激活下游靶基因,如cyclin D1、凋亡相关基因Bcl-xL及血管生成诱导基因等的表达。研究发现,STAT3信号通路通过调控下游靶基因cyclin D1及Bcl-xL的表达,有效抑制膀胱癌细胞的增殖,诱导其凋亡[21]。NSC 74859是一种新发现的STAT3通路抑制剂,研究证实NSC 74859可特异性抑制STAT3从而影响肿瘤的生长。本实验中,干扰肺癌细胞中CXCR4基因的表达发现,STAT3、p-STAT3和cyclin D1的蛋白水平显著降低;采用STAT3抑制剂作用于已转染细胞,发现细胞中的p-STAT3的蛋白水平显著降低,细胞活力受到显著抑制,凋亡率显著增加,提示CXCR4在肺癌细胞中可能通过抑制STAT3信号通路的激活从而诱导下游靶基因的表达,进而调控细胞的生长和凋亡过程。
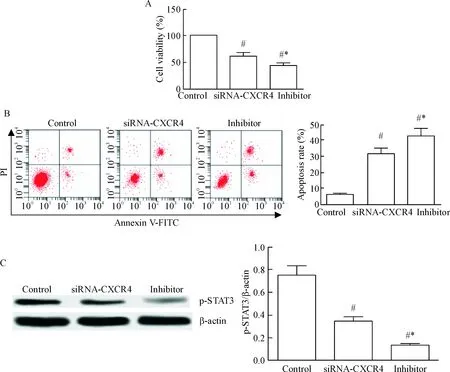
Figure 5. The effects of STAT3 inhibitor on lung cancer cell viability (A), apoptosis (B) and p-STAT3 protein levels (C). Mean±SD.n=3.#P<0.05vscontrol group;*P<0.05vssiRNA-CXCR4 group.
图5STAT3抑制剂对肺癌细胞活力、凋亡及p-STAT3蛋白表达量的影响
综上所述,沉默CXCR4基因在肺癌中的表达可显著抑制细胞的活力,诱导其凋亡,可能是通过抑制STAT3信号通路的活化介导的下游靶基因的表达,因此CXCR4有望成为肺癌基因治疗的新的靶点。
