Adipophilin通过PI3K/Akt通路促进细胞内脂质蓄积*
2018-07-27刘清南戴志兵袁中华刘圆月谭桂煌徐桂娜
刘清南, 戴志兵, 袁中华, 刘圆月, 谭桂煌, 徐桂娜, 贺 旭
(1益阳医学高等专科学校, 2益阳市中心医院超声科, 湖南 益阳 413000; 3南华大学心血管病研究所, 动脉硬化学湖南省重点实验室, 湖南 衡阳 421001)
心脑血管疾病是威胁人类健康非常重要的疾病之一,动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病的主要原因,关于其发生机制的研究目前主要有脂质浸润学说、损伤反应学说和炎症学说等。大部分研究表明,AS发生发展的核心环节是单核巨噬细胞和平滑肌细胞内大量蓄积脂质所致的泡沫细胞形成以及随后动脉粥样硬化斑块的形成。
脂滴包被蛋白PAT(perilipin-adipophilin-TIP47)家族成员之一——脂肪分化相关蛋白(adipose diffe-rentiation-related protein,adipophilin)是脂滴外周含量较高的一种不完全包被蛋白,是Jiang等[1]在1992年利用差别杂交筛选技术在脂肪细胞中首次分离得到的,在之后的研究中发现它与脂肪代谢有关。目前的研究发现,adipophilin可促进细胞内脂质蓄积,加速AS的发生发展。
磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)为异二聚体蛋白,由催化亚基p110和调节亚基p85构成,具有Ser/Thr激酶与磷脂酰肌醇激酶活性。Akt是一种Ser/Thr蛋白激酶,作为PI3K的底物,与蛋白激酶A(protein kinase A, PKA)和蛋白激酶C(protein kinase C,PKC)在结构上很相似,因此Akt又被称为蛋白激酶B(protein kinase B,PKB)。研究发现,细胞内PI3K/Akt信号通路调控细胞生长与存活及细胞间信息传递等众多信号转导。近年来关于PI3K/Akt在代谢及炎症方面的研究不断增多。在脂质代谢方面,敲除PI3K亚基p110可明显减小ApoE-/-和LDLR-/-小鼠粥样斑块面积;抑制PI3K/Akt信号通路可显著降低小鼠血清游离脂肪酸、胆固醇及甘油三酯水平[2];通过肝脏特异性敲除调节亚基p85也可得到上述类似的结果[3]。在调控炎症方面,高表达adipophilin的细胞中炎症因子肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)明显增高[4],抑制PI3K/Akt信号可减少脂多糖诱导的单核/巨噬细胞中TNF-α和IL-6的分泌[5-6],而AS与炎症密切相关。
本实验研究adipophilin是否能通过PI3K/Akt通路促进细胞内的脂质蓄积,并探讨这一过程是否与Akt蛋白的直接相互作用有关,为探讨adipophilin促进细胞内脂质蓄积提供干预的分子靶点。
材 料 和 方 法
1 细胞
RAW264.7细胞与HEK293细胞购自上海细胞生物学研究所细胞库。
2 主要试剂
RPMI-1640和DMEM高糖培养基购于GE Healthcare Life Sciences;氧化型低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)购于北京协生生物科技有限责任公司;胎牛血清、逆转录试剂盒和BCA蛋白定量试剂盒购于Thermo Fisher Scientific;pCMV-Tag2B质粒购于Stratagene;Lipofectamine 2000、Protein G beads和TRIzol购于Invitrogen; adipophilin的引物由生工生物工程(上海)公司合成;EcoRⅠ和XhoⅠ限制性内切酶及T7 DNA连接酶购于New England Biolabs;小剂量质粒提取试剂盒和胶回收试剂盒购于Omega;SYBR Premix Ex Taq PCR反应试剂盒和DNA Ladder购于TaKaRa;蛋白质分子量标准购于SMOBIO;PVDF膜购于Millipore;抗Akt和p-Akt抗体购于Cell Signaling Technology;抗adipophilin抗体购于Abcam;Flag抗体和油红O染料购于Sigma;IgG购于Thermo Fisher Scientific;Amersham ECL Prime化学发光底物购于GE Healthcare Life Sciences;DH5α感受态细胞和抗β-actin抗体购于生工生物工程(上海)公司;LY294002购于MedChem Express;其它试剂均为进口或国产分析纯。
3 主要仪器
qPCR仪(Bio-Rad);凝胶成像仪(上海天能科技有限公司);4 ℃离心机、酶标仪和液氮罐(Thermo Fisher Scientific);离心机(Eppendorf);超净工作台(Heal Force);Milli-Q纯水仪(Millipore);LRH生化培养箱和恒温培养摇床(上海一恒科技有限公司)。
4 主要方法
4.1细胞培养 RAW264.7细胞和HEK293细胞分别置于含10% 胎牛血清的RPMI-1640和DMEM高糖培养基中,在温度为37 ℃、5% CO2的培养箱中培养,细胞贴壁达90%时传代。
4.2实验分组 实验分为:control组(50 mg/L oxLDL处理RAW264.7细胞0 h)、BSA组(10% BSA处理RAW264.7细胞24 h)、12 h组(50 mg/L oxLDL处理RAW264.7细胞12 h)、24 h组(50 mg/L oxLDL处理RAW264.7细胞24 h)、24 h+LY组(终浓度为20 μmol/L的LY294002预处理RAW264.7细胞1 h,再用50 mg/L oxLDL处理24 h)和pCMV-Tag2B-adipophilin组(pCMV-Tag2B-adipophilin转染HEK293细胞48 h)。
4.3载体构建 TRIzol法提取HEK293细胞总的mRNA,逆转为cDNA,用带有酶切位点的引物(adipophilin的上游引物为5’-GCATCCGTTGCAGTT-3’,下游引物为5’-CAGGTTTAATGAGTTT-3’)以cDNA为模板进行PCR扩增,获得adipophilin目的片段,将扩增片段进行琼脂糖凝胶电泳后行胶回收,用EcoRⅠ和XhoⅠ内切酶将胶回收产物和pCMV-tag2B载体于37 ℃酶切4 h,再行琼脂糖凝胶电泳、胶回收,T7 DNA连接酶将载体和目的片段于16 ℃培养箱连接过夜,转化、扩大培养、酶切、测序鉴定。
4.4Western blot实验 裂解液裂解处理后的细胞,提取总蛋白。用BCA试剂盒定量后,干热仪100 ℃加热5 min使蛋白变性,加入SDS Loading Buffer混匀,经SDS-PAGE(120 V电泳约1.5 h),电转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,PBST洗膜后分别用抗Akt、p-Akt、adipophilin和β-actin抗体于4 ℃孵育过夜,PBST洗膜3次,每次15 min,再用辣根过氧化物酶标记的 II 抗室温孵育1 h,ECL试剂曝光。蛋白条带采用ImageJ软件进行灰度定量,采用内参照β-actin对目的蛋白的灰度值进行校正。
4.5qPCR 细胞按分组处理后,提取mRNA进行凝胶电泳,并逆转为cDNA。Adipophilin的上游引物为5’-CTGTCTACCAAGCTCTGCTC-3’,下游引物为5’-CGATGCTTCTCTTCCACTCC-3’;GAPDH的上游引物为5’-TGCACCACCAACTGCTTA-3’,下游引物为5’-GGATGCAGGGATGATGTT-3’。参照SYBR Premix Ex Taq说明书进行操作。反应体系为10 μL:SYBR mixture 5 μL,上、下游引物分别0.5 μL,cDNA 模板1 μL,水3 μL。反应条件为:95 ℃预变性3 min; 95 ℃变性10 s, 58 ℃退火30 s, 35个循环。每个样本重复3次。以GAPDH为内参照,采用2-ΔΔCt方法分析结果。
4.6油红O染色 将RAW264.7细胞计数,吸入置有玻片的6孔培养板中培养,细胞融合度达到90%时进行处理,之后取出玻片,用PBS溶液轻洗3次,50%异丙醇固定1 min,油红O染液染色20 min后再用苏木素染5 min,1%盐酸乙醇分色;封片、观察、拍照保存;细胞内脂质呈红色,细胞核呈蓝色。
4.7免疫共沉淀(co-immunoprecipitation,CoIP) 转染pCMV-Tag2B-adipophilin入HEK293细胞,48 h后收集细胞,用裂解液[150 mmol/L NaCl, 1% NP-40,50 mmol/L Tris (pH 7.5),2 mmol/L EDTA,0.1% SDS,蛋白酶抑制剂]裂解细胞提取蛋白,加入Protein G beads 10 μL预孵育1 h,放置于磁力架上5 min,吸取上清,加入IgG和Flag抗体于4 ℃摇床过夜,再加入20 μL Protein G beads于4 ℃孵育3~4 h,用PBS洗3次后再用细胞裂解液洗2次,加入1×SDS Loa-ding Buffer 20 μL于100 ℃煮5 min,行Western blot检测免疫共沉淀效果。
5 统计学处理
采用SPSS 19.0软件进行统计分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferronit检验。以P<0.05表示差异有统计学意义。
结 果
1 oxLDL处理RAW264.7细胞后,adipophilin和p-Akt的水平增加,脂质蓄积增多
细胞培养36 h后,待细胞约长满达90%以上,加入50 mg/L oxLDL处理细胞0 h、12 h和24 h,提取各组细胞蛋白和mRNA分别进行Western blot和qPCR实验。与对照组相比, oxLDL处理细胞后,adipophilin表达增加,Akt被活化,且随着处理时间的延长,这种变化更明显(P<0.01);油红O染色结果显示,oxLDL处理后细胞内脂质蓄积增多,见图1。
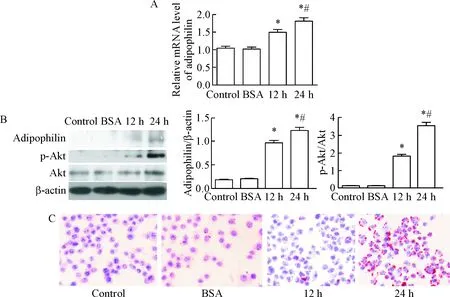
Figure 1. The effects of oxLDL on the expression of adipophilin, the activation of Akt and the accumulation of intracellular lipids in RAW264.7 cells. A: the mRNA expression of adipophilin was detected by qPCR; B: the protein expression of adipophlin and activation of Akt were determined by Western blot; C: Oil red O staining for detecting the intracellular lipid accumulation (×100). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vs12 h group.
图1oxLDL对RAW264.7细胞内adipophilin表达、Akt活化及脂质蓄积的影响
2 LY294002处理可抑制oxLDL诱导的RAW264.7细胞内adipophilin和p-Akt水平的升高和脂质蓄积
如图2所示,与未用LY294002处理组相比,当用LY294002预处理RAW264.7细胞1 h,再用50 mg/L oxLDL处理细胞24 h后,adipophilin蛋白和mRNA表达均下降,细胞内脂质蓄积减少,p-Akt蛋白水平降低,但较对照组要高(P<0.05)。
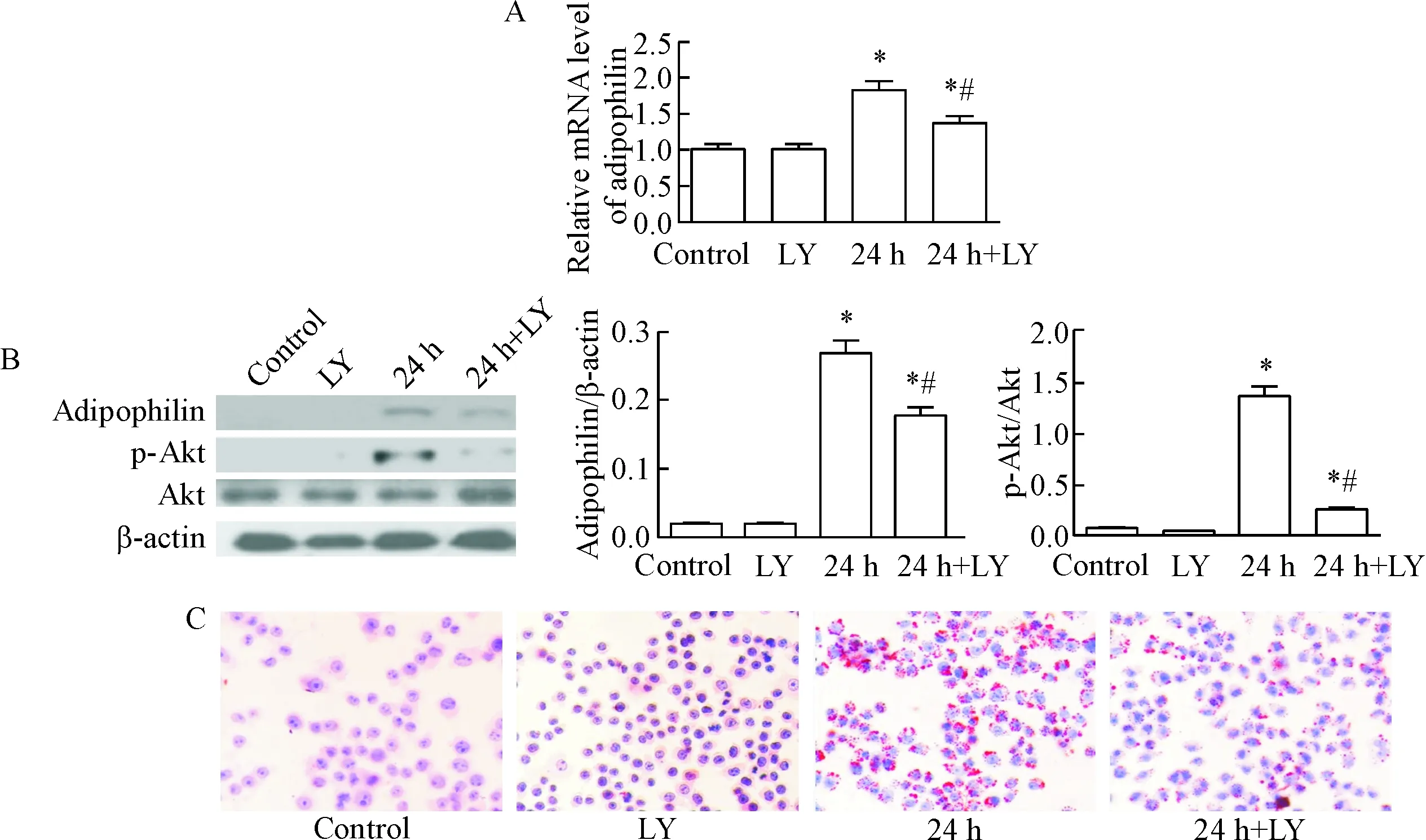
Figure 2. The effects of PI3K/Akt inhibitor LY294002 (LY) on the expression of adipophilin, the activation of Akt and the accumulation of intracellular lipids in RAW264.7 cells. A: the mRNA expression of adipophilin was detected by qPCR; B: the protein expression of adipophlin and activation of Akt were determined by Western blot; C: Oil red O staining for detecting the intracellular lipid accumulation (×100). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vs24 h group.
图2PI3K/Akt抑制剂LY294002对RAW264.7细胞内adipophilin表达、Akt活化及脂质蓄积的影响
3 高表达adipophilin影响Akt的活性
用EcoRⅠ和XhoⅠ内切酶将目的片段和pCMV-Tag2B载体在37 ℃酶切,用T7 DNA连接酶连接,转化入DH5α、扩大培养、酶切、测序鉴定,结果显示,酶切片段大小符合预期,约为1 314 bp,测序后行BLAST显示序列正确,见图3。当HEK293细胞转入pCMV-Tag2B-adipophilin质粒使adipophilin高表达后,p-Akt的蛋白水平升高,见图4。
4 Adipophilin与Akt蛋白的相互作用关系
既然adipophilin高表达可促进细胞内脂质蓄积与Akt密切相关,那么adipophilin与Akt蛋白之间是否存在相互作用呢?本研究将带有Flag标签的adipophilin质粒转染HEK293细胞48 h后,裂解细胞并加入抗Flag抗体进行免疫共沉淀实验,Western blot检测使用抗Akt抗体。结果未能观察到adipophilin与Akt蛋白之间存在相互作用,见图5,其作用的具体分子机制有待进一步探讨。
讨 论
AS是心血管疾病的主要原因,其发生发展是多种细胞与分子参与的复杂过程。单核/巨噬细胞、血管内皮细胞、血管平滑肌细胞和血小板等是AS发生发展的生物学基础。Adipophilin是一种不完全包被蛋白,在正常状态下,它主要位于细胞内的新生脂滴周围。国内外研究证明,adipophilin与泡沫细胞的形成密切相关,在AS发生发展中发挥重要作用,但其作用的具体机制还不是很明确。

Figure 3. The enzyme-digested products of pCMV-Tag2B-adipophilin recombinant vector. The lanes 1~4 were the enzyme-digested products of pCMV-Tag2B-adipophilin recombinant vector. The size of the target fragment was 1 314 bp. The lanes 5~8 were the enzyme-digested products of empty plasmid. M: 1 kb DNA marker.
图3pCMV-Tag2B-adipophilin载体酶切产物电泳图
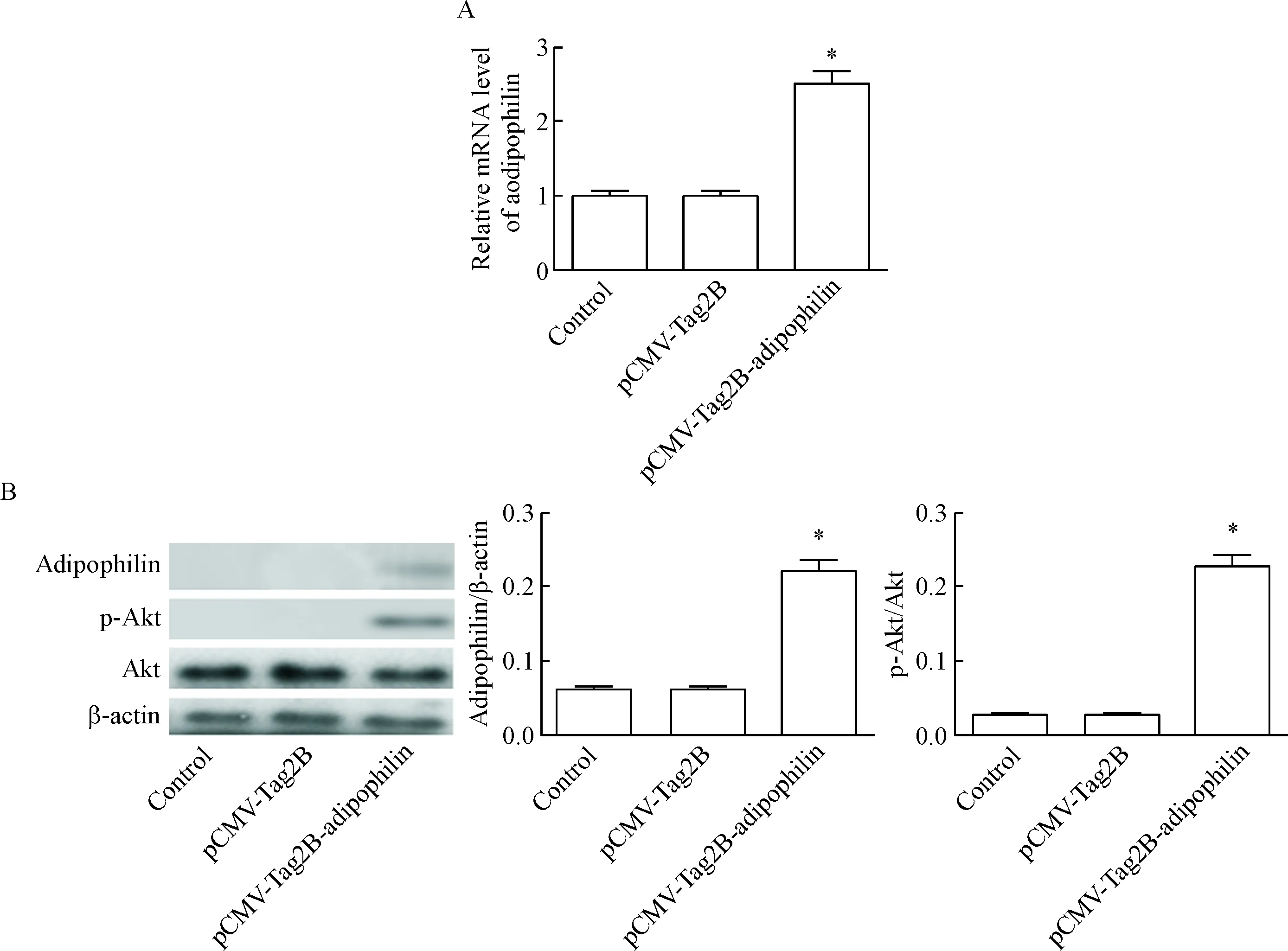
Figure 4. The effect of adipophilin over-expression on the activation of Akt in HEK293 cells. A: the mRNA expression of adipophilin was detected by qPCR; B: the protein expression of adipophilin and activation of Akt were determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图4Adipophilin过表达对HEK293细胞内Akt活性的影响

Figure 5. The protein interaction between adipophilin and Akt was determined by CoIP. HEK293 cells were transfected with pCMV-Tag2B-adipophilin expression vector or empty vector. The cell lysates were immunoprecipitated (IP) and detected by Western blot (WB) with the indicated antibodies.
图5CoIP检测HEK293细胞内adipophilin与Akt蛋白之间的相互作用
近年来,关于PI3K/Akt信号通路对AS调控的研究不断深入。作为重要催化酶,PI3K在调节具备第二信使特征脂类衍生物生成中发挥重要作用,影响AS的进程[7-8]。血管生成素Ⅰ能诱导单核细胞的趋化而促进AS的发展,PI3K是这一过程不可或缺的环节[9];缺乏PI3K的巨噬细胞不能对趋化因子的刺激产生足够的迁移[10]。PI3K/Akt信号通路是单核细胞促AS的分子基础,本研究发现,PI3K/Akt信号转导途径抑制剂LY294002能减少细胞内脂质蓄积,抑制泡沫细胞的形成,这与Yao等[11]和Konstantinidis等[12]的研究结果一致。此外,山柰酚可通过PI3K/Akt/mTOR通路上调自噬来缓解oxLDL诱导的人脐静脉内皮细胞凋亡,且LY294002可增强山柰酚的作用,缓解AS的发生发展[13]。这些研究表明,PI3K/Akt通路在AS中发挥重要作用。
作为PI3K下游的重要功能分子,Akt及下游分子活性改变与心血管疾病有关。在动脉粥样斑块组织中可检测到血管内皮细胞衰老表型[14],Miyauchi等[15]也发现了相似的细胞表型变化,并在动脉粥样斑块中检测到磷酸化的Akt。本研究也发现,当用oxLDL处理细胞后,Akt明显被活化,细胞内脂质蓄积增多;而抑制Akt的活性后,能明显减少细胞内的脂质积聚,提示Akt参与细胞内的脂质蓄积和AS的发生。
袁中华等[4]的研究结果表明,adipophilin在巨噬细胞中能促进炎症因子的表达,抑制Akt的活化可明显抑制血管细胞黏附分子1和细胞间黏附分子1的表达,进而缓解AS的进展[16]。本研究并未发现adipophilin与Akt蛋白之间存在着直接的相互作用,但抑制Akt后,adipophilin表达下调,细胞内脂质蓄积减少;过表达adipophilin可使Akt活性增强。表明adipophilin促进细胞内脂质蓄积伴随着Akt的活化,这可能与adipophilin通过Akt诱导炎症因子的表达有关。
本研究结果提示,adipophilin促进细胞内脂质蓄积与Akt的活化密切相关。目前,在哺乳动物和人体中有3种形式的Akt,即Akt1、Akt2和Akt3,尽管3个亚型具有相似性,但其发挥作用依据其亚型不同而异。将ApoE-/-/Akt1-/-双敲除小鼠的骨髓干细胞注射入ApoE-/-小鼠体内,给予高胆固醇饮食后发现,Akt1敲除可引起ApoE-/-小鼠严重的As,Akt1缺失可明显上调炎症介质,使单核/巨噬细胞更易在血管壁粥样斑块中聚集[17]。Akt2缺失可减少LDLR-/-小鼠主动脉内动脉粥样病变进展[18-19]。而将ApoE/Akt3双敲除小鼠的骨髓干细胞注射入ApoE-/-小鼠体内,给予高胆固醇饮食后发现,Akt3缺失可通过提高酰基辅酶A:胆固醇酰基转移酶1的表达,增加泡沫细胞形成,进而促进小鼠动脉粥样硬化[20]。从这些研究不难看出,Akt的每个亚型在动脉粥样硬化中发挥着不同的作用,我们可以通过对Akt不同亚型的研究,进一步明确adipophilin在AS中发挥作用的具体机制。
总之,adipophilin可通过Akt的活化促进细胞内脂质蓄积,但要证明蛋白之间不存在相互作用仍需进一步验证。本实验结果为明确adipophilin在AS的进程中发挥作用的机制提供了实验依据。
