电针改善慢性脑低灌注大鼠空间学习记忆能力和海马IL-6/JAK2/STAT3的信号调节*
2018-07-27蒋持怡胡鑫豪毕晓晨邵芳斐
蒋持怡, 艾 琪, 刘 喆△, 胡鑫豪, 毕晓晨, 邵芳斐, 杨 洋
(浙江中医药大学 1第二临床医学院, 2第三临床医学院, 3基础医学院, 浙江 杭州 310053)
慢性脑低灌注(chronic cerebral hypoperfusion,CCH)是指由高血压、动脉硬化、颈动脉狭窄/闭阻和脑小血管病变等多种因素所引起长期的脑组织血流降低、供血不足的一种病理状态,是认知功能障碍、血管性痴呆(vascular dementia,VD)和阿尔茨海默症(Alzheimer disease,AD)等疾病的共同病理基础[1-2]。目前对其导致认知障碍甚或痴呆的确切病理机制尚未完全阐明,研究普遍认为中枢神经炎症反应、氧化应激和细胞凋亡是CCH典型的病理事件[3]。中枢神经系统炎症反应可通过众多因素如细胞因子和生长因子的释放,导致不同类型脑细胞之间产生复杂的相互作用,部分炎性因子在炎性损伤中起协同作用,从而加重脑缺血损伤,使认知功能逐渐恶化,其中关于白细胞介素1(interleukin-1, IL-1)和IL-6的研究最为广泛[4]。新近研究证实Janus激酶/信号转导与激活因子(Janus kinase/signal transducer and activator of transcription, JAK/STAT)信号通路在包括脑缺血性损害在内的多种脑组织损伤与保护作用中发挥着重要作用,该通路是机体一条完整且广泛存在的细胞因子信号转导途径,与中枢细胞生长、增殖和存活及免疫反应密切相关[5-7]。海马神经元最易遭受脑低灌注的影响,产生炎症反应进而导致神经元的损伤,从而诱发认知障碍[8]。既往对于JAK/STAT信号通路的研究多集中在急性脑缺血损伤,而其在慢性脑低灌注病理过程中的作用及电针(electroacupuncture,EA)的干预影响报道甚少,本研究旨在观察CCH大鼠海马组织中JAK2/STAT3信号通路与海马炎性损伤的关系以及电针干预对其影响,探索电针治疗脑低灌注损伤所致认知障碍的作用机制。
材 料 和 方 法
1 实验动物及分组
健康雄性Sprague-Dawley (SD)大鼠,体重(280±20) g,年龄3~6个月,由浙江中医药大学动物实验研究中心提供(合格证编号:2008001659093;2008001660222)。手术、治疗程序和动物福利的执行严格按照国家卫生机构的动物实验保健守则和浙江中医药大学动物实验中心使用指南进行。大鼠生存环境为12 h光照和12 h黑暗周期,相对湿度45%~50%,温度(22±2) ℃,适应5 d。大鼠首先进行Morris水迷宫试验,排除智力低下和无游泳能力者,确保实验前大鼠的认知功能无明显不同。筛选30只合格SD大鼠随机分别行假手术(sham)组(10只)和造模手术组(20只),造模后模型大鼠随机分为模型(model)组和电针(EA)组。
2 仪器与试剂
华佗牌0.25 mm×25 mm针灸针(苏州医疗用品有限公司);LH-200E韩氏电针仪(南京济生医疗科技有限公司);PeriFlux 5000激光多普勒血流仪(Perimed);Morris水迷宫系统(上海吉量软件科技有限公司);VIP小动物专业吸入麻醉机(Matrx);34-0313动物手术台(Harvard Apparatus);PCR扩增仪(Thermo);Mini Protean 3 Cell小型垂直电泳槽和Tran-Blot SD半干转印槽(Bio-Rad);ImageQuant LAS 4000超灵敏多功能成像仪(GE)。IL-6 与IL-1β ELISA试剂盒(R&D);TriBlue RNA提取试剂盒(上海申能博彩生物有限公司);兔抗p-JAK2抗体(Abcam);抗p-STAT3和GAPDH抗体(CST);辣根过氧化物酶标记的山羊抗兔IgG(H+L)抗体(Jackson)。
3 方法
3.1动物模型的制备 手术组大鼠按Cechetti等[9]方法实行改良的双侧颈总动脉分部结扎术(bilateral common carotid artery occlusion,2VO),制备CCH模型。术前禁食12 h,禁水4 h。用异氟烷呼吸麻醉(5%诱导,2%维持),分离双侧大鼠颈总动脉,避免损伤颈交感神经和迷走神经,对右侧颈总动脉用5/0丝线双重结扎,1周后进行另一侧操作。术中保持大鼠自主呼吸,维持肛温于(37.0±0.5) ℃。缝合切口前施以适量青霉素钠溶液预防感染。假手术组大鼠与手术组做相同切口,并分离双侧大鼠颈总动脉,不进行永久性结扎。术后所有动物送至原环境饲养。
3.2电针治疗 电针组大鼠自术后第2天起接受电针治疗,用固定器固定大鼠,遮蔽其眼睛,以保持相对舒适和安静。参照《实验针灸学》[10]进行大鼠的穴位定位,取百会穴(顶骨的正中处)及大椎穴(第7颈椎至第1胸椎之间位置,背部正中凹陷稍下处),使用华佗牌0.25 mm×25 mm针灸针针刺。进针后采用LH-200E韩氏电针仪连接2穴,2/15 Hz疏密波,刺激强度(2±1) mA,时间30 min,每天1次(上午),持续4周。假手术组和模型组仅进行抓取固定等平衡处理。
3.3大鼠认知功能评价 采用Morris水迷宫实验进行认知行为学检测[11]。(1)定位航行试验:待电针组电针治疗后,对3组大鼠进行导航实验,入池位置为除平台所在的象限,随机选取其它3个象限1/2弧度处,将其头朝上、面对池壁入水,每天2次,间隔15 min,连续5 d,记录大鼠从入池到找到平台的时间,取平均值;(2)空间探索实验:航行实验结束后的第1天进行探索实验,除去池中的平台,大鼠被允许自由游泳,入池位置为原平台的对侧象限。通过记录大鼠在原平台所在象限停留的时间对记忆功能进行评估,实验进行2次,间隔15 min。采用图像自动监控及处理系统对实验数据和图像进行分析。
3.4采用多普勒脑血流仪对大鼠造模前、后30 min及处死前分别进行局部脑血流量(regional cerebral blood flow,rCBF)检测 选取大鼠头颅右侧颞部为检测点[12],备皮、常规消毒,作一5 mm纵向切口并钝性分离肌肉组织,暴露骨平面,双氧水清理骨平面血渍,将探头基座固定于骨平面。检测时将多普勒脑血流仪探头插入基座,待显示屏上数值稳定后进行监测,记录时间1 min。
3.5动物取材与处理 末次rCBF测量后,腹腔注射10%水合氯醛(4 mL/kg)麻醉,每组大鼠随机取5只快速断头取脑,于冰上切取海马组织,称重,置于-20 ℃冰箱保存备用。各组其余动物在麻醉状态下用4%多聚甲醛溶液经心灌注,断头取脑4%多聚甲醛固定液中固定24 h,以备制作石蜡切片进行形态学观察。
3.6ELISA法检测各组大鼠海巴组织中IL-6和IL-1β的含量 按照试剂盒说明书,采用常规酶联免疫吸附法测定海马匀浆中IL-6和IL-1β含量。
3.7RT-PCR实验 取冻存的海马组织,逆转录步骤根据说明书指导,用TriBlue RNA提取试剂盒从海马中抽提总RNA 2 μg。-40 ℃保存,备用于扩增反应。引物采用Primer 5.0引物设计软件设计,JAK2的上游引物为5’-GTTCTTACCGAAGTGCGTGCGA-3’,下游引物为5’-GGTAATGGTGTGCATCCGCAGTT-3’;STAT3的上游引物为5’-TGGAAGAGGCGGCAGCAGATAGC-3’,下游引物为5’-CACGGCCCC-CATTCCCACAT-3’;内参照β-actin的上游引物为5’-TCAGGTCATCACTATCGGCAAT-3’,下游引物为5’-AAAGAGGGTGTAAAACGCA-3’。
取出上述反应液2 μL作为逆转录的模板,总反应体系包括上、下游引物各0.5 μL,加Taq酶、dNTP、Mg2+-free Buffer及双蒸水等补充至50 μL,混匀离心,放入PCR仪中进行扩增。预变性95 ℃ 5 min; JAK2: 95 ℃ 20 s、56 ℃ 40 s、72 ℃ 45 s,共30个循环; STAT3: 95 ℃ 20 s、60 ℃ 40 s、60 ℃30 s,共30个循环; β-actin: 94 ℃ 30 s、72 ℃ 40 s、72 ℃ 30 s,共30个循环。扩增产物经1.5%琼脂糖凝胶电泳检测,GIS凝胶图像处理系统分析拍照,比较目的基因与内参基因条带的平均密度,以两者比值表示mRNA相对表达量。
3.8Western blot检测蛋白水平 取150~200 mg冻存大鼠海马组织,加入由RIPA裂解液,超声破碎仪冰上匀浆,离心提取上清液,-80 ℃保存备用检测,BCA法测定蛋白浓度。配置10%分离胶和5%浓缩胶,加入样本进行SDS-PAGE和电转膜; 5% BSA常温封闭1 h,加入抗p-JAK2(1 ∶800)、p-STAT3(1 ∶1 000)和GAPDH(1 ∶1 000)抗体,4 ℃孵育过夜;次日取出用TBST摇床漂洗3次,每次10 min,后加入辣根抗氧化物酶标记的 II 抗,常温摇床孵育2 h,TBST摇床漂洗3次,每次10 min,ECL化学发光显影,采用ImageQuant TL软件对条带灰度值进行半定量分析。
3.9海马HE染色 常规石蜡切片(5 μm),切片脱蜡梯度至水,染色过程略如:苏木素染色、氨水分化、伊红复染;乙醇脱水、二甲苯透明,中性树胶封片。显微镜下观察海马组织的病理变化。
4 统计学处理
运用SPSS 15进行统计分析。数据用均数±标准差(mean±SD)表示。导航实验采用重复测量数据的多因素方差分析。脑血流测定的组内干预前后对比采用配对t检验,其余各指标组间对比采用单因素方差分析(one-way ANOVA)。此外,方差齐性的数据采用t检验,而方差不齐的数据采用秩和检验分析。以P<0.05为差异有统计学意义。
结 果
1 认知功能评估
1.1定位航行实验结果 随训练天数的增加,各组大鼠平均逃避潜伏期除第 1天各组间差异无统计学显著性外,其余4 d均呈下降趋势。模型组的潜伏期与同时点(第2、3、4和5天)假手术组比较减少缓慢,潜伏期显著高于假手术组(P<0.01);电针组平均逃避潜伏期减少较快,与同时点假手术比较差异无统计学显著性,而较模型组潜伏期显著降低,差异有统计学意义(P<0.05),表明电针干预能有效改善CCH大鼠学习能力,见图1。
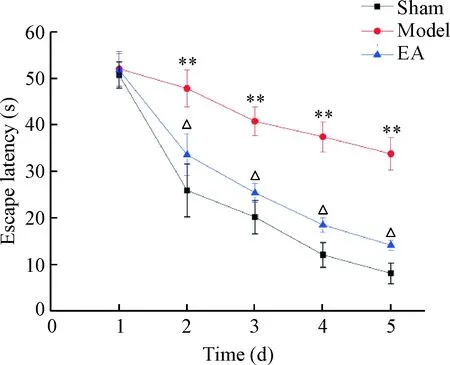
Figure 1. The escape latency in each group. Mean±SD.n=10.**P<0.01vssham group;△P<0.05vsmodel group.
图1各组逃避潜伏期的比较
1.2空间探索实验结果 经过4周电针治疗后,模型组在平台所在象限停留时间比假手术组明显缩短(P<0.05),而电针组较模型组显著延长,差异有统计学意义(P<0.05),其与假手术组比较差异无统计学显著性,表明电针能改善CCH大鼠的记忆能力,见图2。

Figure 2. Comparison of residence time of each group in the original platform quadrant. Mean±SD.n=10.△P<0.05vssham group;▽P<0.05vsmodel group.
图2各组在原平台象限停留时间的比较
2 rCBF的改变
2.12VO术前与术后rCBF的比较 术前假手术组与手术组大鼠rCBF的差异无统计学显著性,表明实验大鼠无个体差异;术后30 min手术组大鼠的rCBF较假手术组有明显下降(P<0.01),表明手术造模成功,见表1。
2.2电针干预对模型大鼠rCBF的影响 经4周干预后模型组和电针组大鼠的rCBF均有显著恢复,但2组大鼠rCBF与假手术组相比仍显著降低(P<0.01或P<0.05),而电针组大鼠的rCBF与模型组相比显著增加(P<0.05),表明电针能改善CCH大鼠局部脑血流循环,见表1。
表1造模前后局部脑血流量的变化情况
Table 1. The changes of regional cerebral blood flow before and after modeling (PU. Mean±SD)

GroupPreoperativePostoperativeAfter4weeks Sham122.41±9.66(n=10)120.21±8.46(n=10)122.13±8.82(n=10) Model124.53±13.99(n=20)38.44±5.44△△(n=20)84.01±5.71△(n=10) EA--107.14±9.57△#(n=10)
△P<0.05,△△P<0.01vssham group;#P<0.05vsmodel group.
3 电针干预对大鼠海马IL-6和IL-1β含量的影响
ELISA检测显示,模型组大鼠海马IL-1β和IL-6较假手术组增多(P<0.05);电针组的IL-1β浓度较模型组显著降低(P<0.05),而IL-6浓度较模型组有所升高但差异无统计学显著性,表明电针干预可维持IL-6表达、抑制IL-1β表达,见图3。

Figure 3. The changes of IL-6 and IL-1β concentrations in the hippocampus. Mean±SD.n=5.△P<0.05vssham group;▽P<0.05vsmodel group.
图3海马IL-6和IL-1β浓度的变化
4 电针干预对模型大鼠海马组织JAK2和STAT3 mRNA表达的影响
与假手术组相比,模型组JAK2和 STAT3的mRNA表达均有降低(P<0.05);而电针组比模型组JAK2和 STAT3的mRNA表达明显升高(P<0.05),见图4、表2。

Figure 4. The results of RT-PCR for detecting the mRNA expression of JAK2 and STAT3.
图4RT-PCR检测JAK2和STAT3的mRNA表达
表2海马JAK2/STAT3的mRNA表达和磷酸化蛋白水平的变化
Table 2. The changes of mRNA expression of JAK2 and STAT3 and the protein levels of p-JAK2 and p-STAT3 in the hippocampus (Mean±SD.n=5)

GroupmRNAProteinJAK2STAT3p⁃JAK2p⁃STAT3 Sham1.22±0.071.25±0.090.32±0.040.26±0.04 Model0.97±0.07△0.73±0.11△0.20±0.03△0.15±0.03△ EA1.11±0.05▽0.98±0.07▽0.29±0.05▽0.24±0.03▽
△P<0.05vssham group;▽P<0.05vsmodel group.
5 电针干预对模型大鼠海马p-JAK2和p-STAT3 蛋白表达的影响
模型组与假手术组相比,p-JAK2和 p-STAT3蛋白表达含量均显著降低(P<0.05);而电针组比模型组的p-JAK2和 p-STAT3蛋白表达显著升高(P<0.05),见图5、表2。
6 海马HE染色结果
假手术组大鼠海马CA1区大多数神经元胞体淡染,细胞形态完整;模型组CA1区有较多不规则形状的深染细胞,表明受CCH的影响而出现神经元死亡;而电针组CA1区深染细胞明显较少,见图6。

Figure 5. The protein levels of p-JAK2 and p-STAT3 detected by Western blot.
图5Westernblot检测p-JAK2和p-STAT3的蛋白水平
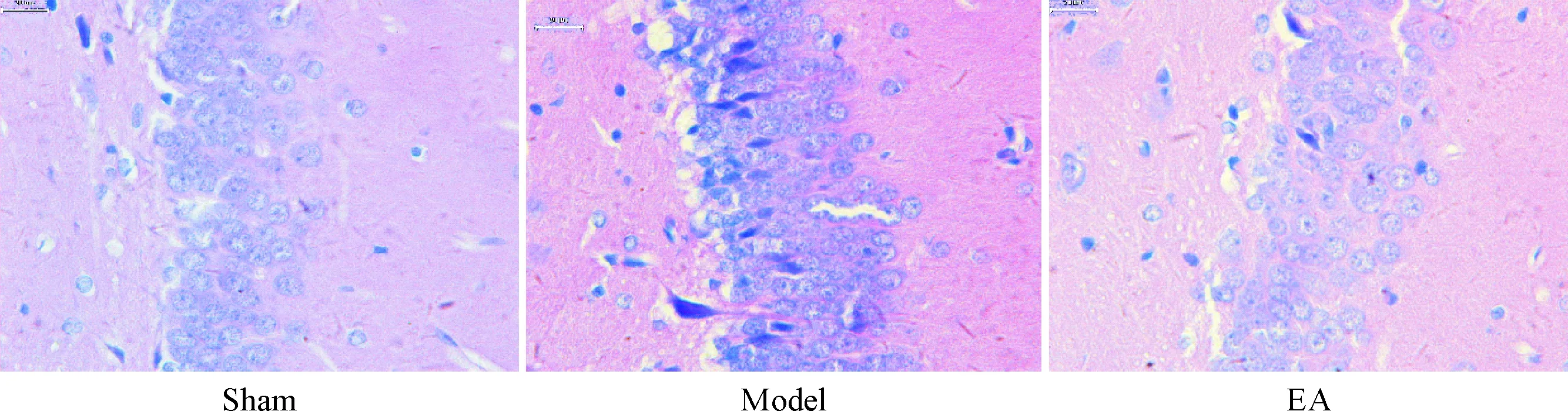
Figure 6. The observation of the pathological changes in hippocampal tissues with HE staining (×40).
图6海马HE染色结果
讨 论
本研究组既往证实电针“百会”、 “大椎”可改善局灶性脑缺血大鼠神经功能、病理损伤,提高慢性脑低灌注模型rCBF、抑制海马炎症反应及神经损伤进而改善学习记忆功能[13-15]。督脉为“阳脉之海”,其循行“并于脊里,上至风府,入脑”,百会、大椎二穴均属于督脉,而百会为足太阳、手足少阳、足厥阴与督脉之会,可疏通脑络、益智安神;大椎为“诸阳之会”,有疏通多经、强脏腑之功。故针刺二穴可疏通气血、醒脑开窍、益智安神。因此本实验者根据以往实验经验沿用百会、大椎穴。选用2/15 Hz的疏密波进行电针干预。该波频率在2次/秒与15次/秒之间不断变频,其刺激作用较强,可调节血管舒缩功能,改善血液循环,促进神经功能修复,并能有效调节血压,故为本实验选用。
海马在外显记忆神经通路的组成中起着重要的作用,可定位环境中的物体、连接断续的信息及维持空间学习能力,同时直接参与信息的储存和记忆[16]。因其具有独特的血管构筑[8, 17],加之小胶质细胞密集[18],使海马成为脑内缺血性损伤的最敏感和炎症反应易发区域。慢性脑低灌注是指脑血流速度降低、引起脑组织灌注不足,多种原因可引起大脑CCH,引发脑缺血、缺氧状态,继而出现持久性或进展性认知功能障碍[1-2],因此CBF是反映脑功能的有效替代指标[19]。大鼠2VO模型被广泛用于CCH所致的认知功能损害相关研究,2VO模型可导致皮质总体CBF以及海马CBF分别下降为对照水平的35%~45%和60%,而空间学习和记忆也随之受到明显损害[1-3]。激光多普勒组织血流测量仪可持续、实时监测局部脑血流量,本实验采用激光多普勒组织血流仪对各组动物造模前、后及干预后的大脑rCBF分别进行了监测,结果显示电针干预可显著提高模型动物rCBF,改善模型动物的空间学习和记忆能力。
CCH状态下的缺血缺氧可诱发氧化应激和炎症反应,从而导致神经细胞变性、凋亡及海马结构受损,并进一步造成认知障碍[1-3]。在炎症免疫因子中,IL-1β和IL-6与中枢神经系统缺血性损伤密切相关,可导致白质脱髓鞘、少突胶质细胞凋亡、血栓形成、白细胞浸润、血脑屏障破坏等[1-3]。其中IL-1是引发免疫和炎症反应的重要炎症因子,可加重缺血性脑损伤,尤其是IL-1β与脑缺血发病机制密切相关[20]。IL-1β的异常升高可以诱发神经元凋亡、功能紊乱,影响乙酰胆碱等神经递质的释放,导致学习记忆功能和情感障碍等[21]。本实验同样观察到CCH可导致海马IL-1β水平增高、海马CA1区神经细胞呈现坏死或凋亡样形态改变,而电针干预可降低IL-1β含量,减少神经细胞的损伤改变。IL-6是中枢重要的多功能细胞因子之一,在生理状态下的IL-6参与突触可塑性的调节并与学习记忆功能密切相关;而其在疾病进程中的作用相互矛盾,这主要取决于不同的病理状态[22-23]。有研究证实在药物诱导疾病模型中,IL-6通过活化JAK2/STAT3而发挥神经保护、改善认知功能的作用[24]。本研究观察到电针干预可降低模型大鼠海马IL-1β含量,而维持IL-6在较高的水平,推测其可能与影响JAK2/STAT3信号通路有关。
为深入探究IL-6对中枢神经系统的保护作用,本研究采用RT-PCR法观测了与其密切相关的下游信号JAK-STAT通路的表达情况。IL-6可通过与细胞表面相应受体结合刺激胞内JAKs表达活化,活化的JAKs促使STATs蛋白磷酸化形成二聚体而发生核位移,进而调节目的基因的表达以影响细胞活动[7]。在缺血性脑损伤的研究中显示,IL-6可提高和活化STAT3,进而调节目的基因SOD2表达增加,参与抗氧化和抗炎反应,而敲除或阻断IL-6信号则可加重脑缺血损伤[25-26]。本实验观察到电针干预可使海马IL-6处于较高水平,而与之相应的是JAK2/STAT3 mRNA表达以及磷酸化的JAK2/STAT3蛋白含量均有显著增高,表明电针干预调节CCH后期IL-6水平,进而刺激海马JAK2/STAT3的表达,推测这可能与电针提高CCH大鼠rCBF、降低IL-1β含量、进而改善模型大鼠的学习记忆功能有关。
综上分析,我们认为研究可以获得初步结论,电针刺激百会和大椎穴提高慢性脑低灌注后rCBF、改善学习记忆能力,可能与调节IL-6/JAK2/STAT3信号转导,从而抑制海马炎性损伤有关。
