Jagged1调控STAT3信号通路影响多发性骨髓瘤细胞的生长和凋亡*
2018-07-27张熙辉徐明奎曾德斌
张熙辉, 龚 健, 黄 胜, 周 理, 徐明奎, 曾德斌
(1海南省中医院骨二科, 海南 海口 570203; 2唐山市第二医院老年骨科, 河北 唐山 063000;3海南医学院附属医院骨科, 海南 海口 570102; 4海南省人民医院显微手外科, 海南 海口 570311)
多发性骨髓瘤属于恶性肿瘤,起源于骨髓中的浆细胞,骨骼变形、病理性骨折、贫血、出血和肾功能损害等是其主要的临床症状,发病率约为2~3/10万,40岁以上特别是60岁以上的老人是该病的高发人群,其发病率在血液肿瘤中位居第2位[1-2]。Jagged1是NOTCH的配体,也是在哺乳动物中发现的第一个NOTCH的配体,在肾脏、胰腺和胎盘等多种组织中广泛存在,在造血前体细胞、血管内皮细胞和成骨细胞等生长中均具有调控作用[3-4]。研究显示,Jagged1作为NOTCH信号通路的配体,可以调控NOTCH的激活影响肿瘤细胞的生长,与肿瘤转移、生长、浸润和血管生成等均有密切关系,其在脑胶质瘤、肝癌和乳腺癌等肿瘤中表达异常升高,信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路作为肿瘤发生的重要信号转导途径是否与Jagged1有潜在联系,尚不十分清楚[5-9]。本研究主要探讨Jagged1对多发性骨髓瘤细胞生长和凋亡的影响,以及其是否可以通过调控STAT3信号通路影响细胞凋亡,为研究Jagged1在肿瘤发生中的机制奠定基础。
材 料 和 方 法
1 材料
多发性骨髓瘤细胞U266购自Saierbio;Jagged1小干扰RNA(small interfering RNA, siRNA)和siRNA阴性对照(siRNA negative control,siRNA-NC)购自Santa Cruz;青、链霉素购自Solarbio;cDNA合成试剂盒购自TIANGEN;STAT3信号通路抑制剂AG490购自Tocris;β-肌动蛋白(β-actin)和Jagged1引物由上海生工生物合成;SYBR荧光定量PCR试剂盒购自Roche;Lipofectamine 2000购自Invitrogen;RNA提取试剂盒购自Sigma;抗STAT3、p-STAT3和Bax抗体均购自Santa Cruz;膜联蛋白 V(Annexin V)-FITC/碘化丙啶(propidium iodide,PI)双染细胞凋亡检测试剂盒购自上海生工;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自TIANGEN。
2 方法
2.1细胞分组及转染 U266细胞种植到6孔细胞培养板中,观察细胞融合度达到60%以后,把培养液吸除以后,用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)洗涤2次,用不含血清的培养液继续孵育1 h。将Jagged1 siRNA和siRNA-NC用Lipofectamine 2000转染至U266细胞中,依次命名为Jagged1 si-RNA组和siRNA-NC组,同时设置空白对照 (control)组,细胞不做处理。培养48 h以后,用RT-qPCR和Western blot检测细胞中的Jagged1水平。同时分别在0 h、24 h、48 h和72 h用台盼蓝染色,绘制各组细胞生长曲线。U266细胞用含有10%胎牛血清和1%青、链霉素的DMEM培养液培养。
2.2RT-qPCR检测Jagged1的mRNA水平 Control组、siRNA-NC组和Jagged1 siRNA组细胞按照2.1中方法处理后培养48 h,加入1 mL的TRIzol溶液(1×106个细胞中加1 mL),吹打混合5 min,在室温条件下静置5 min。在裂解液中加入200 μL的氯仿,剧烈混合30 s,在室温条件下静置5 min,在4 ℃、14 000×g离心15 min,此时溶液分为3层,将上层水相层溶液吸取到EP管中,加入500 μL的异丙醇,上下颠倒混合后,4 ℃、14 000×g离心15 min,将上清液吸除后,用与TRIzol裂解液同等体积的乙醇洗涤2次,4 ℃、10 000×g离心15 min,用移液器把上清吸除以后,放在室温中干燥后,用DEPC水20 μL溶解RNA。以分光光度计法检测RNA的浓度和纯度。反转录合成cDNA,SYBR荧光定量PCR检测Jagged1水平,内参照为β-actin。β-actin的上游引物序列为 5’-GGAAATCGTGCGTGACAT-3’,下游引物序列为5’-AAGGAAGGCTGGAAGAGTG-3’;Jagged1的上游引物序列为5’-AAGTGTGCCTCAAGGAGTATC’-3, 下游引物序列为 5’-ACTGTCAGGTTGAACGGTGTC-3’。实验重复3次,取均值。
2.3Western blot检测Jagged1的蛋白水平 Control组、siRNA-NC组和Jagged1 siRNA组细胞按照2.1中方法处理后,培养48 h,用细胞刮刀收集细胞,加入细胞裂解液,放在冰上裂解20 min,4 ℃、14 000×g离心20 min,吸取蛋白上清,保存在-80 ℃。BCA法检测蛋白浓度,用12%的分离胶和5%的浓缩胶进行电泳。蛋白样品变性(100 ℃煮沸5 min)处理后,每孔加入40 μg进行电泳,先用80 V恒压电泳,待溴酚蓝进入分离胶的边缘时,改成90 V,直到溴酚蓝完全跑出凝胶。200 mA,转膜2 h。5%牛血清白蛋白室温封闭1.5 h。将膜放在1 ∶800稀释的抗Jagged1抗体中,4 ℃结合过夜。TBST洗膜3次。把膜放在1∶2 000稀释的II 抗中,室温孵育1.5 h。ECL发光后,扫描图像,分析蛋白水平。实验重复3次,取均值。
2.4细胞活力的检测 各组细胞按照2.1中方法处理后,将细胞接种到96孔细胞培养板中,每个组设置8个平行孔,放在37 ℃、5% CO2培养箱中培养72 h后,在每个孔中加入5 μL的MTT溶液,孵育4 h以后,把MTT溶液弃掉,每孔中加入200 μL的二甲基亚砜溶液,孵育10 min后,全自动酶标仪检测490 nm波长的吸光度。实验重复3次,取均值。
2.5细胞凋亡的检测 各组细胞按照2.1中方法处理后,培养72 h,收集各组细胞,用5 μL的PI和10 μL的Annexin V-FITC,室温孵育15 min,再加入300 μL的结合缓冲液,混合后,立即用流式细胞仪检测凋亡情况。同时用Western blot法检测细胞中STAT3、p-STAT3和Bax水平,步骤同2.3。实验重复3次,取均值。
2.6抑制STAT3信号通路对细胞凋亡影响 Control组细胞培养液中加入40 μmol/L的AG490,记为AG490组,Western blot检测control组和AG490组细胞培养72 h后,细胞中STAT3和p-STAT3水平,步骤同2.3。 用40 μmol/L的AG490处理Jagged1 siRNA组细胞,记为AG490+Jagged1 siRNA组,培养72 h,MTT检测AG490组、AG490+Jagged1 siRNA组和Jagged1 siRNA组细胞活力,流式细胞术检测AG490、AG490+Jagged1 siRNA和Jagged1 siRNA各组细胞的凋亡情况,步骤同2.4和2.5。实验重复3次,取均值。
3 统计学处理
所有实验数据采用SPSS 21.0软件进行分析。计量资料用均数±标准差(mean±SD)表示,两组间比较用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),各组间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 转染后细胞中Jagged1水平下调
Control组、siRNA-NC组和Jagged1 siRNA组细胞中Jagged1 mRNA水平和蛋白水平比较差异均有统计学意义(P<0.05),Jagged1 siRNA组细胞Jagged1的mRNA和蛋白水平均明显低于control组(P<0.05),而siRNA-NC组细胞Jagged1的mRNA和蛋白水平与control组相比没有明显变化,说明Jagged1 siRNA抑制多发性骨髓瘤细胞中Jagged1的表达,见图1。
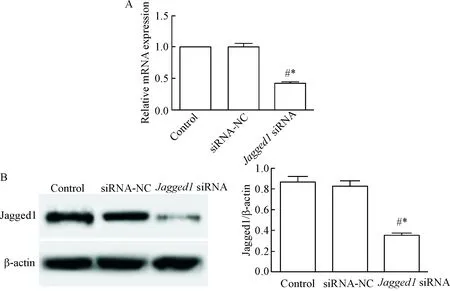
Figure 1. The expression of Jagged1 at mRNA (A) and protein (B) levels in the cells after transfection.Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC group.
图1转染后各组细胞中Jagged1mRNA和蛋白水平
2 敲减Jagged1表达抑制细胞生长
如图2所示,siRNA-NC组在24 h、48 h和72 h的细胞数目与control组相比没有明显变化;Jagged1 siRNA组在24 h、48 h和72 h的细胞数目与control组相比明显降低,差异具有统计学意义(P<0.05),说明敲减Jagged1表达抑制多发性骨髓瘤细胞的生长。
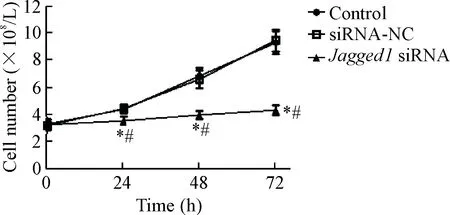
Figure 2. The cell growth curves determined by the method of Trypan blue exclusion. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC group.
图2台盼蓝染色绘制细胞生长曲线
3 敲减Jagged1表达抑制细胞活力,诱导细胞凋亡
如图3所示,Jagged1 siRNA组细胞的凋亡率明显高于control组,而细胞活力明显低于control组,差异具有统计学意义(P<0.05);而siRNA-NC组细胞的凋亡率和活力与control组相比没有明显变化, 说明敲减Jagged1表达抑制多发性骨髓瘤细胞的活力,促进细胞凋亡。
4 敲减Jagged1表达对STAT3、p-STAT3和Bax蛋白水平的影响
如图4所示,control、siRNA-NC和Jagged1 si-RNA 3组细胞p-STAT3/STAT3水平和Bax/β-actin水平的比较差异均有统计学意义(P<0.05),Jagged1 siRNA组细胞的p-STAT3/STAT3蛋白水平明显低于control组,而Bax/β-actin水平明显高于control组,差异具有统计学意义(P<0.05),siRNA-NC组细胞的p-STAT3/STAT3和Bax/β-actin水平与control组相比没有明显变化,说明敲减Jagged1表达抑制多发性骨髓瘤细胞中STAT3信号通路激活,促进Bax表达。
5 AG490降低细胞中p-STAT3的水平
如图5所示,AG490组的p-STAT3/STAT3水平明显低于control组,差异具有统计学意义(P<0.05),说明AG490抑制多发性骨髓瘤细胞中STAT3信号通路激活,降低STAT3的磷酸化水平。
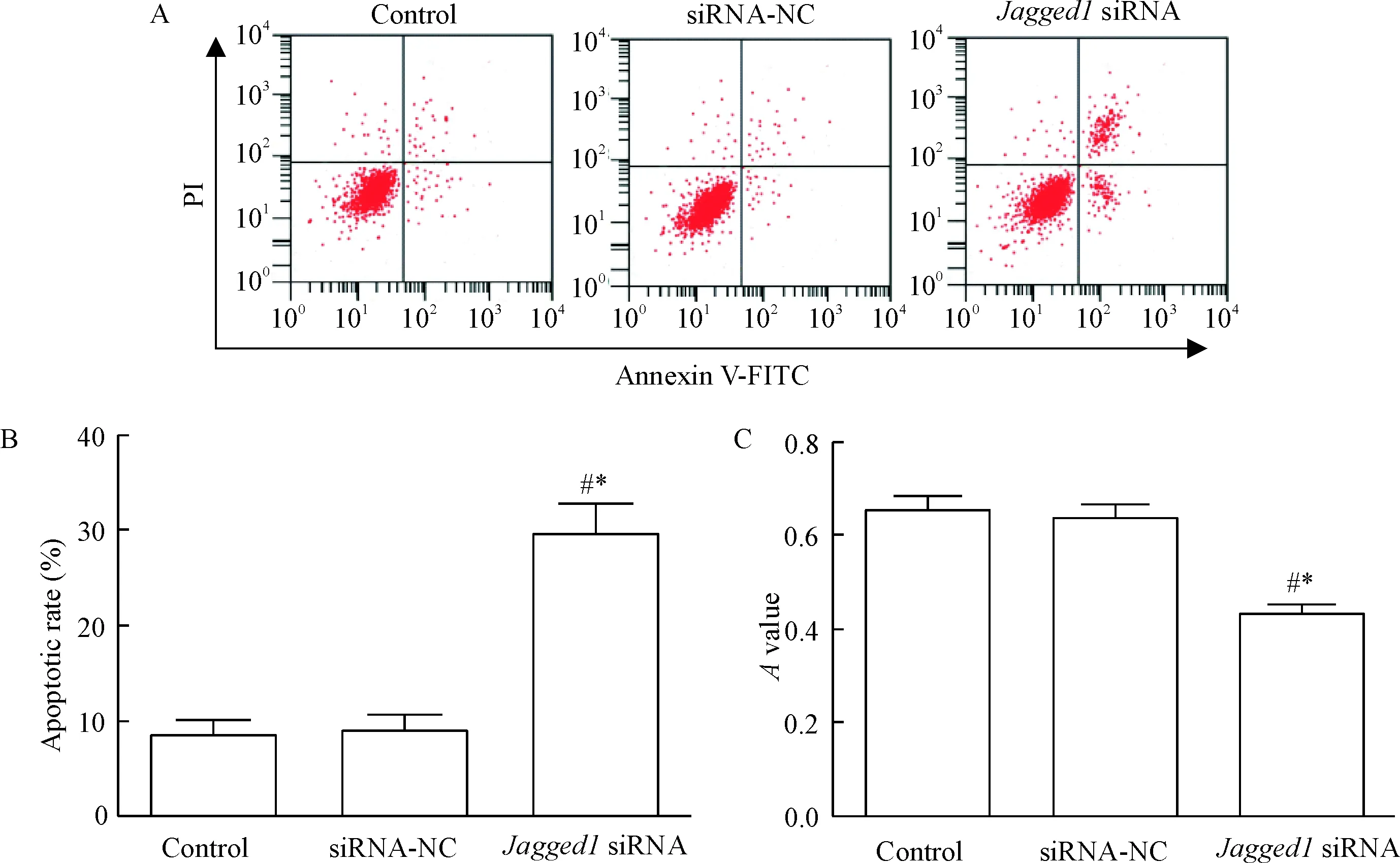
Figure 3. Knockdown ofJagged1 expression promoted apoptosis and inhibited cell viability. A: the images of flow cytometry with Annexin V-FITC/PI double staining for analysis of apoptosis; B: the quantitative analysis of cell apoptotic rate; C: theAvalue of MTT assay. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC group.
图3敲减Jagged1表达促进细胞凋亡,抑制细胞活力

Figure 4. Knockdown ofJagged1 expression inhibited the activation of STAT3 signaling pathway in multiple myeloma cells and promoted the expression of Bax. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vssiRNA-NC group.
图4敲降Jagged1表达抑制多发性骨髓瘤细胞中STAT3信号通路激活,促进Bax表达

Figure 5. AG490 inhibited the activation of the STAT3 signaling in the cells.Mean±SD.n=3.*P<0.05vscontrol group.
图5AG490抑制细胞中STAT3信号通路的激活
6 AG490对细胞活力和凋亡的影响
如图6所示,AG490、Jagged1 siRNA和AG490+Jagged1 siRNA 3组细胞的凋亡率和细胞活力比较差异有统计学意义(P<0.05); AG490+Jagged1 si-RNA组的凋亡率明显高于Jagged1 siRNA组和AG490组,而细胞活力明显低于Jagged1 siRNA组和AG490组,差异具有统计学意义(P<0.05),说明STAT3信号通路抑制剂可提高细胞凋亡率,降低细胞活力, STAT3信号通路抑制剂与下调Jagged1具有协同作用。
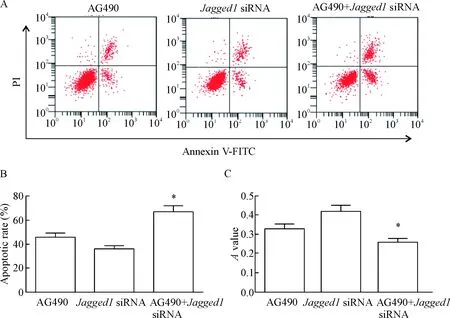
Figure 6. The inhibitory effects of STAT3 signaling inhibitor AG490 on the cell viability and apoptosis. A: the images of flow cytometry with Annexin V-FITC/PI double staining for analysis of cell apoptosis; B: the quantitative analysis of the apoptotic rate; C: theAvalue of MTT assay. Mean±SD.n=3.*P<0.05vsJagged1 siRNA group and AG490 group.
图6抑制STAT3信号通路对细胞活力和细胞凋亡的影响
讨 论
人类的Jagged1基因定位在20p12染色体上,全长5 940 bp,其开放阅读框编码3 657个氨基酸,其编码的蛋白质可以通过与NOTCH相互作用,进入细胞核,影响下游靶基因的激活[10-11]。Jagged1参与调控肿瘤的发生和发展,在间变性大细胞淋巴瘤和霍奇金淋巴瘤等肿瘤过度激活,后续报道显示,在急性髓性白血病、脑胶质瘤、乳腺癌和前列腺癌等肿瘤同样发现Jagged1表达上调[12-15]。研究显示,Jagged1表达下调后的前列腺癌细胞周期紊乱,细胞生长受阻,并且其在前列腺癌中的表达水平与前列腺癌的复发和转移等正相关[16-17]。本研究结果显示,Jagged1表达下调后的多发性骨髓瘤细胞的生长速度降低,细胞活力下降,说明Jagged1下调后能够抑制多发性骨髓瘤细胞生长,在肿瘤中发挥癌基因的作用。
肿瘤细胞的生长是一个复杂过程,是一系列癌基因以及抑癌基因共同作用的结果。正常细胞的增殖和凋亡是一种动态平衡过程,在受到病理因素的刺激后,细胞生长速度加快,凋亡减少,细胞发生癌变,导致肿瘤的产生[18]。细胞凋亡的机制较为复杂,其中Bcl-2蛋白家族与细胞凋亡有关,根据在细胞凋亡中的作用不同其蛋白成员可以分为促凋亡蛋白和抑凋亡蛋白,Bax是Bcl-2蛋白家族成员之一,是一种重要的促凋亡蛋白[19-22]。姜黄素和三七皂苷等抗肿瘤药物及肿瘤坏死因子受体相关因子6 (TNF receptor-associated factor 6, TRAF6)等癌基因都可以通过促进Bax的表达调控多发性骨髓瘤细胞凋亡[23-25]。本实验结果显示,敲减Jagged1表达后的多发性骨髓瘤细胞中Bax水平升高,细胞凋亡率也升高,说明下调Jagged1促进Bax表达,诱导多发性骨髓瘤细胞凋亡。
STAT3参与细胞的生长、分化和凋亡等过程,不仅在组织器官正常功能维持等方面具有重要作用,在动脉粥样硬化、糖尿病并发症和缺血再灌注等疾病发生中也具有调控作用[26]。近年来的研究显示,STAT3在骨髓瘤、胶质瘤和胰腺癌等组织中过度激活,STAT3磷酸化水平异常升高,而通过抑制STAT3信号通路后,白血病细胞和乳腺癌细胞等肿瘤细胞凋亡增加,细胞生长受阻[27-29]。Chen等[30]在研究血管细胞分化中发现,microRNA-199b可以通过影响Jagged1的表达,调控血管内皮生长因子的水平,而血管内皮生长因子水平与STAT3的激活有关。本实验表明,敲减Jagged1表达后的多发性骨髓瘤细胞中STAT3磷酸化水平降低,STAT3信号通路受阻,而用STAT3信号通路抑制剂处理后,敲减Jagged1表达的多发性骨髓瘤细胞凋亡率进一步升高,细胞活力进一步下降,下调Jagged1表达可以抑制STAT3信号通路诱导多发性骨髓瘤细胞凋亡。
综上所述,下调Jagged1表达通过抑制STAT3信号通路诱导多发性骨髓瘤细胞凋亡,抑制细胞生长。Jagged1是治多发性骨髓瘤的潜在靶点,在后续实验中会在多株多发性骨髓瘤细胞中进行验证;而其对肿瘤细胞转移、浸润等的作用尚不清楚,在以后实验中会继续探讨。
