黄芪多糖通过激活AMPK减轻同型半胱氨酸对人血管内皮细胞的损伤*
2018-07-27孙燕玲郑永江林东军方志刚
张 玲, 宋 杰, 孙燕玲, 郑永江, 林东军, 方志刚
(中山大学附属第三医院血液科, 广东 广州 510630)
研究发现,黄芪多糖(Astragaluspolysaccharides,APS)对于2型糖尿病动物模型具有增加胰岛素敏感性、改善糖耐量、降低血糖和血脂、减少肝脏脂肪沉积以及减轻体重等作用[1-3];APS还具有降低脂毒性和改善骨骼肌游离脂肪酸代谢的作用[4-5]。另有研究表明,APS具有改善慢性心力衰竭(chronic heart failure,CHF)的功效[6]。近期我们发现APS改善CHF的机制可能是,APS活化CHF时心肌被抑制的腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)活性,从而促进心肌对游离脂肪酸摄取利用,改善心肌代谢底物结构,进而减轻CHF[7]。有研究证实高同型半胱氨酸(homocysteine,Hcy)是引起心血管疾病的独立危险因素,高Hcy主要通过损伤血管内皮而引起心血管疾病[8]。我们近期研究表明,APS可以改善游离脂肪酸诱导的损伤,其机制与AMPK-内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)信号通路有关[9],而APS对高Hcy引起的内皮细胞损伤的影响尚未见报道。本实验拟采用人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)复制高Hcy的血管内皮细胞损伤模型,观察APS对高Hcy引起的内皮细胞损伤的影响,探讨其可能的保护机制及其相应的信号通路。
材 料 和 方 法
1 主要试剂和仪器
HUVECs购自ATCC。优化水煎工艺从膜荚黄芪(上海药材公司)中提取APS(80 kD~120 kD,湖北中医学院药用植物鉴定教研室鉴定)[10]。Hcy购自Sigma;总RNA提取试剂Trizol Reagent购自Invitrogen;逆转录试剂盒购自Fermentas;PCR荧光定量检测试剂盒购自Genecopoeia;引物由Invitrogen合成;抗p-AMPKα单克隆抗体和抗AMPKα单克隆抗体均购自Cell Sigaling Technology;鼠抗β-actin单克隆抗体购自Santa Cruz;乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒和超氧化酶歧化酶(superoxidase dismutase,SOD)测定试剂盒均购自南京凯基生物科技发展有限公司。Prism 7500 real-time PCR仪购自ABI;ImageQuant LAS 4000化学发光仪购自GE;垂直板蛋白电泳装置购自Bio-Rad。
2 方法
2.1细胞培养与分组 HUVECs采用含10%胎牛血清的DMEM培养基于37 ℃、5%的CO2孵育箱中培养。细胞在培养24 h后,换无血清DMEM培养基。实验分4组:正常对照(control,Ctrl)组、APS组[APS(200 mg/L)[4-5]处理24 h[11]]、Hcy组[Hcy(1 mmol/L)[12]处理24 h]和Hcy+APS组[Hcy(1 mmol/L)和APS(200 mg/L)共同处理24 h]。
2.2MTT实验 取生长良好的细胞,以浓度2.0×107/L的细胞悬液接种96孔培养板中,每个实验组种8孔,每孔接种100 μL,培养12 h细胞贴壁后,吸弃培养液,按实验分组加入相应培养液100 μL继续培养。在24 h时相点的前4 h各取培养板一块,每孔加入浓度为 5 g/L MTT 50 μL,继续培养4 h后,吸弃上清液后向每孔加入20% DMSO 100 μL,振荡后在酶标仪上以490 nm波长测吸光度A值。
2.3LDH和SOD活性及MDA含量的检测 HUVECs进行同步化后,分为对照组、Hcy组、APS组和Hcy+APS组。干预24 h后,分别提取各组细胞培养液,使用LDH、SOD和MDA测定试剂盒进行检测。
2.4RT-qPCR检测SOD1和过氧化氢酶(catalase,CAT)及NADPH氧化酶2(NADPH oxidase 2, NOX2)的mRNA表达 取生长良好的HUVECs。按照Trizol Reagent说明书进行裂解,提取细胞总RNA,分光光度法测定并计算提取的总RNA含量与浓度。按照逆转录试剂盒说明书将内皮细胞总RNA逆转录反应合成cDNA,SOD1、CAT及NOX2 mRNA及内参照β-actin引物序列见表1[10],退火温度均为60 ℃,PCR反应循环次数为40次。按定量PCR试剂盒进行操作:以20 μL反应体系进行PCR,取2 μL逆转录反应产物与CAT、SOD1、NOX2的mRNA及内参照β-actin引物进行。PCR反应条件:预变性95 ℃ 10 min;95 ℃ 15 s、60 ℃ 20 s、72 ℃ 32 s,40个循环。在ABI Prism 7500 real-time PCR System上操作反应,数据采用2-ΔΔCt法表示。
2.5Western blot检测血管内皮细胞中AMPKα和p-AMPKα蛋白的表达水平 将处理后的各组细胞用PBS冲洗,冰上充分裂解后,置4 ℃超速离心机,离心,取上清液,用BCA蛋白定量试剂盒定量。煮沸5 min, SDS-PAGE分离蛋白后,转印到PVDF膜上,封闭、漂洗后加入Ⅰ抗于4 ℃孵育过夜,漂洗后再加入辣根过氧化物酶标记的鼠抗兔Ⅱ抗(1∶800稀释)室温孵育1 h,漂洗后ECL显色,用高清晰度彩色病理细胞测量程序的图形分析软件系统测出相对吸光度值。

表1 RT-qPCR引物序列
3 统计学处理
采用SPSS 15.0统计软件进行数据处理和统计分析。所有数据均采用均数±标准差(mean±SD)表示,组间差异用单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1 黄芪多糖对Hcy刺激后HUVECs活力的影响
HUVECs在不同浓度Hcy(0.25、0.5、1及2 mmol/L)作用24 h后,细胞活力降低,且随着Hcy浓度的增加,细胞活力逐渐下降(P<0.05);HUVECs在不同浓度黄芪多糖(50、100、200和400 mg/L)作用24 h后,细胞活力的差异无统计学显著性;细胞按照对照组、Hcy组(1 mmol/L Hcy)、APS组(200 mg/L黄芪多糖)和Hcy+APS组(1 mmol/L Hcy+200 mg/L APS)处理24 h后,与Hcy组相比,Hcy+APS组的细胞活力显著增加(P<0.05),但仍未恢复到对照组水平(P<0.05),说明APS能够减轻Hcy引起的血管内皮细胞活力的下降,见图1。此外与对照组相比,APS组的细胞活力及LDH水平均无明显变化,表明APS对HUVECs细胞活力无影响;而Hcy组的LDH活性较对照组相比明显增加(P<0.05),而Hcy+APS组LDH活性较Hcy组显著降低(P<0.05),表明APS能减轻Hcy导致的细胞损伤,见图2。
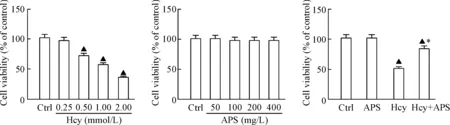
Figure 1. The effects of APS and Hcy on the Cell viability of HUVECs. Mean±SD.n=6.▲P<0.05vsCtrl group;*P<0.05vsHcy group.
图1APS及Hcy对人血管内皮细胞活力的影响

Figure 2. The effects of APS and Hcy on LDH activity in HUVECs. Mean±SD.n=6.▲P<0.05vsCtrl group;*P<0.05vsHcy group.
图2APS和Hcy对人血管内皮细胞LDH活性的影响
2 黄芪多糖对HUVECs中MDA含量和SOD活性的影响
为进一步明确APS及Hcy对HUVECs的作用是否与氧化应激有关,我们检测了氧化应激的相关指标。结果显示,APS组的MDA含量与对照组相比差异无统计学显著性,Hcy组的MDA含量与对照组相比明显增加(P<0.05),而Hcy+APS组的MDA含量与Hcy组相比显著降低(P<0.05); APS组的SOD活性与对照组相比差异无统计学显著性,而Hcy组的SOD活性与对照组相比明显下降(P<0.05),Hcy+APS组的SOD活性与Hcy组相比明显增加(P<0.05),见图3。这说明APS与Hcy对HUVECs的影响与氧化应激有关。
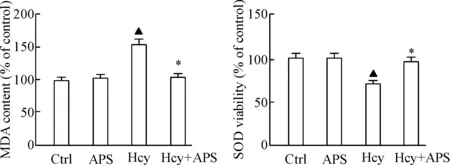
Figure 3. The effects of APS and Hcy on MDA content and SOD activity in HUVECs. Mean±SD.n=6.▲P<0.05vsCtrl group;*P<0.05vsHcy group.
图3APS及Hcy对人血管内皮细胞MDA含量及SOD活性的影响
3 黄芪多糖对HUVECs中SOD1、CAT和NOX2 mRNA表达的影响
我们采用RT-qPCR检测了氧化应激物质相关酶在HUVECs的mRNA表达。结果显示,与对照组相比,APS组SOD1、CAT和NOX2的mRNA表达水平的差异无统计学显著性,而Hcy组SOD1和CAT的mRNA表达水平显著降低,NOX2的mRNA的表达水平则显著增加(P<0.05);Hcy+APS组SOD1和CAT的mRNA表达水平较Hcy组明显升高,而NOX2的mRNA表达水平则显著下降(P<0.05),见图4。这说明APS对正常细胞氧化及抗氧化应激物质的生成无明显影响,但可以减少Hcy损伤细胞氧化应激物质的产生及增加抗氧化物质的生成。
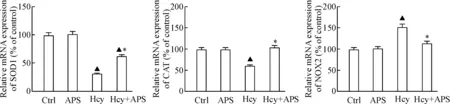
Figure 4. The effects of APS and Hcy on the mRNA expression of SOD1, CAT and NOX2 in HUVECs. Mean±SD.n=6.▲P<0.05vsCtrl group;*P<0.05vsHcy group.
图4APS及Hcy对人血管内皮细胞SOD1、CAT和NOX2mRNA表达的影响
4 黄芪多糖对HUVECs中p-AMPKα蛋白水平的影响
APS组和Hcy组的p-AMPKα蛋白水平分别与对照组相比差异无统计学显著性; Hcy+APS组p-AMPKα的蛋白水平与Hcy组相比明显增加(P<0.05),见图5。这表明APS可以活化Hcy损伤细胞的AMPK,而对正常细胞AMPK的活化无明显影响。
5 Compound C逆转黄芪多糖对HUVECs的保护作用
为进一步确认APS抗Hcy损伤是否通过活化AMPK通路及明确AMPK活化相关通路是否是唯一通路,我们加入AMPK抑制剂Compound C,将实验分为正常对照(Ctrl)组、APS组[APS(200 mg/L)处理24 h]、Hcy组[Hcy(1 mmol/L)处理24 h]、Hcy+APS组[Hcy(1 mmol/L)和APS(200 mg/L)共同处理24 h]、Hcy+APS+Com组[Hcy(1 mmol/L)、APS(200 mg/L)及Compound C (10 μmol/L)处理24 h]和Com组[Compound C (10 μmol/L)处理24 h]。结果发现单纯Compound C刺激对细胞活力无明显影响,而Hcy+APS+Com组细胞活力较Hcy+APS组明显下降(P<0.05),说明AMPK的激活参与APS对Hcy引起的内皮细胞损伤的拮抗作用,见图6。APS对Hcy导致的血管内皮细胞损伤的拮抗作用未被AMPK阻断剂Compound C完全阻断,这说明AMPK通路只是APS发挥保护作用的机制之一。

Figure 5. The effect of APS and Hcy on the protein levels of p-AMPKα and AMPKα in HUVECs. Mean±SD.n=6.▲P<0.05vsCtrl group;*P<0.05vsHcy group.
图5APS及Hcy对人血管内皮细胞p-AMPKα和AMPKα蛋白表达的影响

Figure 6. Compound C (Com), an AMPK inhibitor, weakened the protective effect of APS on HUVECs. Mean±SD.n=6.▲P<0.05vsctrl group;*P<0.05vsHcy group;△P<0.05vsHcy+APS group.
图6AMPK阻断剂CompoundC可减弱APS对人血管内皮细胞的保护作用
讨 论
Hcy是动脉粥样硬化的独立危险因子之一,而Hcy是导致血管内皮细胞损伤从而引起动脉粥样硬化的重要原因之一。Hcy导致内皮细胞发生损伤的机制包括死亡受体通路、氧化应激通路、内质网通路及线粒体通路[8]。正常细胞内的活性氧簇(reactive oxygen species,ROS)主要包括羟自由基、氧自由基、超氧阴离子、过氧化氢和脂质过氧化物等。ROS是生理状态下细胞内重要的信号因子,它与细胞生长、黏附和转录因子的活化等都密切相关。通常情况下,由于细胞内存在众多酶参与的抗氧化体系,ROS对细胞不构成伤害;病理状态下,ROS产生过多或者是抗氧化酶出现异常时,过多的ROS将导致细胞严重损伤,甚至凋亡或坏死。在本研究中,Hcy 呈剂量依赖性抑制内皮细胞活力,Hcy 组 SOD 活性下降,而LDH 活性和 MDA 含量升高,这说明氧化应激参与了Hcy 对内皮细胞的损伤,这与付勇南等[12]的研究一致。
先前研究发现,无论是对链脲菌素诱导的2型糖尿病动物模型,还是遗传性2型糖尿病模型(KKAy小鼠)或胰岛素抵抗模型,APS都具有增加胰岛素敏感性,改善糖耐量,降低血糖和血脂、减少肝脏脂肪沉积以及减轻体重等作用[1-3]。近期我们发现APS可以改善慢性心衰,可能机制是APS可活化慢性心衰时心肌被抑制的AMPK活性,从而促进心肌对游离脂肪酸的摄取利用,改善心肌代谢底物结构,进而改善心衰[7]。目前的研究表明,APS可以改善游离脂肪酸诱导的损伤,其机制与AMPK-eNOS信号通路有关[9],然而,APS对高Hcy引起的内皮细胞损伤的影响尚未见报道。本研究发现,APS不仅对血管内皮细胞活力无损伤,而且可以改善Hcy引起的血管内皮细胞活力下降,鉴于APS的保护作用可能是通过激活 AMPK 通路实现[13],本研究还通过 Western blot 检测各组 p-AMPKα的蛋白水平,发现Hcy+APS组p-AMPKα 的蛋白水平明显高于Hcy 组,Hcy组与对照组的差异无统计学显著性,说明Hcy和APS共同干预时,黄芪多糖能够活化AMPK。加入AMPK抑制剂Compound C 则可以显著降低APS减轻Hcy对内皮细胞损伤的效应,说明AMPK在APS抑制Hcy引起的内皮细胞损伤中起到重要作用。有研究表明AMPK激活后具有抑制细胞内氧化应激的作用[14],本研究还发现与Hcy组比较,Hcy+APS组相应氧化应激指标(LDH及SOD活性和MDA 含量)的变化,以及对应的mRNA 表达水平的改变,说明APS可能是通过抑制血管内皮细胞的氧化应激,使细胞内的ROS水平下降,产生血管内皮细胞保护作用。因此推测 AMPK-eNOS通路在APS抑制 Hcy引起的细胞损伤中起到重要作用。
本研究是在细胞水平上观察Hcy对HUVECs的细胞活力及氧化应激的作用,结果发现APS对Hcy损伤的内皮细胞有保护作用,其机制可能与APS激活AMPK有关。我们先前研究证实APS可通过调节AMP/ATP比值而激活AMPK[5],然而AMPK活化后是通过什么机制抑制细胞内氧化应激目前尚不清楚,有待我们进一步探索。
