白藜芦醇对新生大鼠神经元缺血缺氧时SDF-1/CXCR4通路抗凋亡作用的调控机制
2018-07-27齐薛浩
阎 雯, 齐薛浩
(西安市儿童医院 1新生儿一科, 2NICU科, 陕西 西安 710034)
新生儿缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)是指各种围生期窒息导致的部分或完全缺氧、脑血流量减少或暂停所致的新生儿脑损伤,是造成新生儿永久性神经功能障碍和死亡的一个重要原因。虽然近些年来新生儿重症监护有了很大的进步,但是HIE的幸存者仍然面临着终身的后遗症,如发育迟缓、认知和运动障碍、脑麻痹、癫痫和自闭症等[1]。HIE的发病机制目前尚未确定,但有研究发现神经元凋亡在其发病过程中发挥着重要作用[2]。白藜芦醇(resveratrol,RSV)是一种从葡萄和虎杖等多种水果和植物中提取出来的多酚类化合物。研究显示,RSV具有包括抗癌、抗炎、抗心血管疾病、抗神经退行性疾病和抗衰老等多种生物学作用[3-4]。最近有研究报道RSV能够保护缺血缺氧诱导的新生儿脑损伤[5],但其作用机制有待进一步研究。
最近的研究发现基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1)能够改善脑损伤的新生大鼠的认知功能,减少细胞凋亡和颅内炎症并诱导脑髓鞘再生,这可能是通过与其受体——CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)结合发挥作用的[6-7]。Hong等[8]的研究发现,RSV通过上调心肌中SDF-1的表达和分泌,缓解小鼠急性心肌梗死症状,但是在新生儿HIE中RSV和SDF-1的关系还未见相关报道。本研究通过对新生大鼠皮质神经元进行氧糖剥夺(oxygen-glucose deprivation,OGD)处理模拟新生儿HIE模型,探究RSV是否是通过调控SDF-1/CXCR4通路抑制缺血缺氧诱导的神经元凋亡。
材 料 和 方 法
1 材料
1.2主要试剂 胰酶和胎牛血清购自Gibco;DMEM/F12和DMEM培养基购自Thermo Fisher Scientific;RSV和CXCR4拮抗剂AMD3100购自Sigma;RNAiso Plus购自大连宝生物工程有限公司;cDNA合成试剂盒、Real-time PCR试剂盒、抗β-actin抗体和辣根过氧化物酶标记的 II 抗均购自北京康为世纪生物科技有限公司;RIPA裂解液购自上海碧云天生物技术有限公司;BCA蛋白定量试剂盒购自上海捷瑞生物工程有限公司;抗SDF-1抗体购自Santa Cruz;抗微管相关蛋白2(microtubule-associated protein-2,MAP-2)、CXCR4、cleaved caspase-3、细胞色素C(cytochrome C,Cyt C)、Bax和Bcl-2 抗体均购自Abcam;ECL发光液购自Millipore;Annexin V-FITC/PI细胞凋亡试剂盒购自BD。
2 方法
2.1新生大鼠皮质神经元的分离和鉴定 取出生24 h内的新生SD大鼠,戊巴比妥钠麻醉后,将其断头处死,用消毒过的眼科手术剪剪开头皮和颅骨,将大脑两侧组织暴露出来。然后取出全脑,分离出皮层组织并剪成小组织块,将组织块使用0.25%胰酶于37 °C消化15 min,1 000 r/min离心5 min后弃胰酶,加入含有15%胎牛血清的DMEM/F12培养基终止消化,并用一次性细口吸管轻轻反复吹打细胞,并经200目筛网过滤细胞悬液,收集滤液,1 000 r/min离心10 min,弃上清液,在细胞沉淀中加入含有15%胎牛血清的DMEM/F12培养基,按照1×109/L的密度将细胞接种到多聚赖氨酸包被的细胞培养皿中,放入37 °C、5% CO2细胞培养箱中培养,培养至第3天时,更换成含有5 μmol/L的阿糖胞苷(杀死非神经元细胞)。培养至第6天时,采用MAP-2免疫荧光染色,鉴定神经元纯度大约为97%。
2.2MTT检测不同浓度的RSV对神经元活力的影响 将培养的原代神经元过夜培养后,按照每孔1×103的密度接种到96孔板中,37 °C、5%CO2条件下过夜培养。参考文献[9],在过夜培养的细胞中加入含有不同浓度(0, 1, 10, 50,和100 μmol/L)的RSV的细胞培养基继续常规培养24 h,按照MTT试剂盒检测各孔在570 nm处的吸光度(A)值。
2.3实验分组及HIE模型制备 首先将培养的神经元随机分成4组:对照(control)组、缺血缺氧模型(HIE)组、缺血缺氧+RSV低剂量(HIE+RSV-low)组和缺血缺氧+RSV高剂量(HIE+RSV-high)组。HIE模型制备:弃去神经元的原培养液,换成无糖无胎牛血清的DMEM培养基,在5% CO2、1% O2、94% N2的缺氧装置中处理2 h,然后更换成含有糖和10% FBS的培养液,在常氧条件下继续培养24 h。对照组始终置于含有糖和10% 胎牛血清的培养液中并进行常氧处理;HIE+RSV低剂量组在缺氧处理结束后立即加入10 μmol/L RSV,处理24 h;HIE+RSV高剂量组以同样的方式加入50 μmol/L RSV。
为了验证RSV是否是通过SDF-1/CXCR4通路发挥作用的,将培养的原代神经元随机分成3组:缺血缺氧模型(HIE)组、缺血缺氧+RSV(HIE+RSV)组和缺血缺氧+RSV+AMD3100(HIE+RSV+AMD3100)组。这3组均按照上述方式给予缺血缺氧处理;RSV的使用剂量为50 μmol/L,按照上述方法加入;缺血缺氧结束后25 μmol/L AMD3100与50 μmol/L RSV同时加入,处理细胞24 h。
2.4Real-time PCR检测mRNA表达 按照RNAiso Plus试剂盒说明书操作提取各组细胞的总RNA,使用琼脂糖凝胶电泳鉴定所提取RNA的完整性,核酸测定仪鉴定RNA的浓度及纯度后,取2 μg总RNA进行逆转录,然后按照real-time PCR试剂盒说明书操作加入各组分进行检测。引物序列见表1。以GAPDH为内参照,按照2-ΔΔCt计算靶基因mRNA的相对表达量。
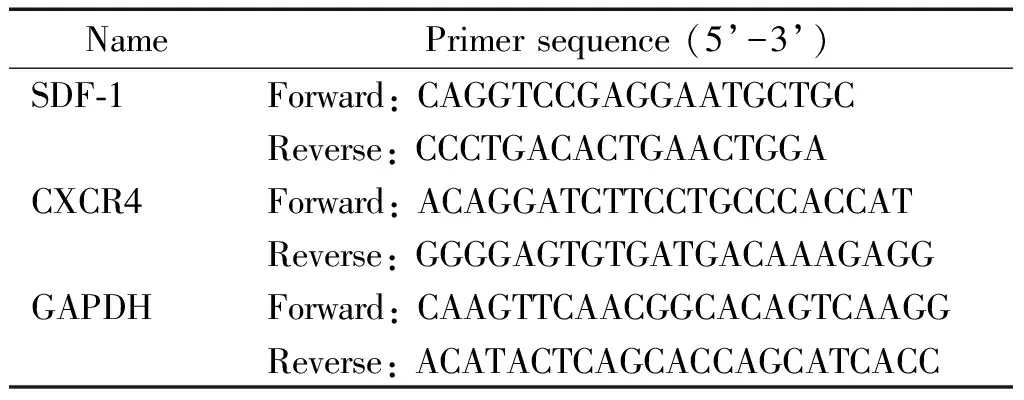
表1 Real-time PCR引物序列
2.5Western blot检测蛋白水平 将细胞先用冰冷的PBS冲洗1遍,加入RIPA裂解液裂解细胞30 min,离心后收集上清液即为提取的蛋白质。测定过浓度后,对蛋白质进行SDS-PAGE,每孔蛋白质上样量为30 μg。电泳完成后,将分离的蛋白质转移到PVDF膜上,5%脱脂奶粉封闭2 h后,加入提前准备好的 I 抗稀释液,4 °C过夜孵育。TBST缓冲液清洗后,加入 II 抗稀释液室温孵育1 h,再加入ECL发光液,拍照并分析蛋白质的含量。
2.6流式细胞术检测细胞凋亡 使用Annexin V-FITC/PI双染通过流式细胞术检测RSV对缺血缺氧损伤的神经元凋亡的影响。使用不含EDTA的胰酶消化RSV处理24 h的细胞,收集细胞,用预冷的无菌PBS清洗2次后,按照凋亡试剂盒说明书操作检测细胞凋亡早期和凋亡晚期的改变。
“北冥有鱼,其名为鲲,鲲之大,不知其几千里也。化而为鸟,其名为鹏。鹏之背,不知其几千里也。怒而飞,其翼若垂天之云。”这边孙老神仙领众人低诵《逍遥游》,已发动了七绝阵法。北斗为帝车之象,是为辕轩,车,转也,游也,变而为鲲鹏,天枢为首,天璇承之,天玑变换,天权取舍,玉衡犹疑,开阳振作,摇光波动,一时五人掌力齐吐,颜真卿挥笔,苏雨鸾奏琴阴阳变化,十二条内力深浅方向各有不同,惊涛深流,形成漩涡,将三个少年席卷而入。
3 统计学处理
采用SPSS 13.0软件对数据进行统计分析。所有实验最少重复3次,数据用均数±标准差(mean±SD)表示,组间差异的比较使用单因素方差分析并进行Bonferroni校正的t检验。以P<0.05为差异具有统计学意义。
结 果
1 白藜芦醇能够抑制缺血缺氧诱导的神经元凋亡
首先检测不同浓度的RSV对细胞活力的影响,结果显示,与对照组相比,1、10和50 μmol/L RSV对正常培养的神经元的活力影响不大,但是100 μmol/L RSV能够抑制神经元的活力(P<0.01),见图1A。
流式细胞术检测细胞凋亡的结果显示,与对照组相比,HIE组中细胞的凋亡率增加,差异有统计学意义(P<0.05);与HIE组相比,HIE+RSV组中细胞的凋亡率降低,差异有统计学意义(P<0.05),且高剂量的RSV组中凋亡率更低,见图1B。

Figure 1. Resveratrol (RSV) inhibited the apoptosis of neurons induced by hypoxic-ischemic injury. A: the effects of different concentrations (0, 1, 10, 50 and 100 μmol/L) of RSV on the viability of neurons were determined by MTT assay; B: flow cytometry analysis for the apoptosis of neurons with different treatments. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsHIE group.
图1白藜芦醇能够抑制缺血缺氧诱导的神经元凋亡
2 白藜芦醇对凋亡相关蛋白表达的影响
Western blot检测各组中凋亡相关蛋白水平,结果示,与对照组相比,HIE组中活化的caspase-3和Cyt C的蛋白水平增加,Bcl-2/Bax值降低(P<0.05);与HIE组相比,HIE+RSV组中活化的caspase-3和Cyt C的蛋白水平降低,Bcl-2/Bax值升高(P<0.05),且高剂量的RSV组中变化更加明显,见图2。
3 白藜芦醇能够上调SDF-1和CXCR4的表达
用real-time PCR检测SDF-1和CXCR4的mRNA表达,结果显示,与对照组相比,HIE组中SDF-1和CXCR4的mRNA表达增加(P<0.05);与HIE组相比,HIE+RSV组中SDF-1和CXCR4的mRNA表达增加(P<0.05),且高剂量的RSV组中表达更高,见图3A、B。
用Western blot检测了SDF-1和CXCR4蛋白水平的表达,结果显示,与对照组相比,HIE组中SDF-1和CXCR4的蛋白表达增加(P<0.05);与HIE组相比,HIE+RSV组中SDF-1和CXCR4的蛋白表达增加(P<0.05),且高剂量的RSV组中表达更高,见图3C。

Figure 2. The effects of resveratrol (RSV) on the levels of apoptosis-related proteins. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsHIE group.
图2白藜芦醇对凋亡相关蛋白水平的影响

Figure 3. The effects of resveratrol (RSV) on the expression of SDF-1 and CXCR4 at mRNA and protein levels determined by real-time PCR (A and B) and Western blot (C). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05,##P<0.01vsHIE group.
图3白藜芦醇对SDF-1和CXCR4mRNA和蛋白表达的影响
4 CXCR4拮抗剂能够减弱白藜芦醇对神经元凋亡的影响
使用CXCR4的拮抗剂AMD3100与RSV共同处理缺血缺氧的细胞,结果如图4所示。与HIE+RSV组相比,HIE+RSV+AMD3100组中细胞的凋亡率增加,活化的caspase-3和Cyt C的表达增加,Bcl-2/Bax值降低(P<0.01),见图4。
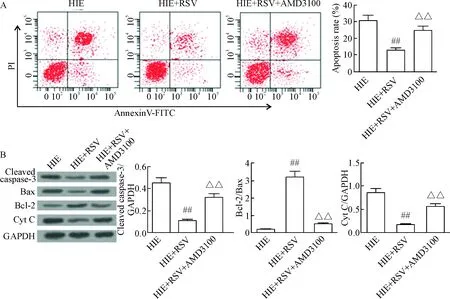
Figure 4. CXCR4 antagonist AMD3100 attenuated the effect of resveratrol (RSV) on the apoptosis of neurons. A: flow cytometry for analyzing the apoptosis of neurons; B: Western blot for determining the protein levels of cleaved caspase-3, Bax, Bcl-2 and Cyt C in the primary neurons treated with RSV combined with or without AMD3100 after HIE injury. Mean±SD.n=3.##P<0.01vsHIE group;△△P<0.01vsHIE+RSV group.
图4CXCR4拮抗剂AMD3100能够减弱白藜芦醇对神经元凋亡的影响
讨 论
新生儿HIE是一种与神经元凋亡相关的神经功能障碍性疾病。其发病机制包括凋亡、兴奋性神经毒性、炎症和氧化应激等[10]。最新的研究显示RSV处理可以减少缺血缺氧诱导的新生大鼠脑损伤[5],但其详细的作用机制尚不清楚。目前在体外用OGD处理神经元模拟体内神经元的缺血缺氧损伤,已被广泛应用于HIE的研究[11-12]。因此,本研究通过OGD处理模拟神经元缺血缺氧损伤探究RSV对新生儿HIE的作用机制。
Bcl-2蛋白家族包含促凋亡蛋白(如Bax)和抗凋亡蛋白(如Bcl-2),该家族蛋白在调控线粒体凋亡通路中发挥着重要作用。促凋亡蛋白与抗凋亡蛋白的比例是凋亡的一个重要调节因子,研究显示Bcl-2与Bax的比例能够调节神经元凋亡[12]。Bcl-2家族蛋白的平衡能够调节Cyt C的释放,而Cyt C参与凋亡复合体的形成并调节胱天蛋白酶如caspase-3的活化,最终诱导细胞凋亡[12]。本研究结果显示,OGD处理后神经元的凋亡明显增加;同时,活化的caspase-3和Cyt C的释放增加,Bcl-2/Bax值降低。这表明本研究中OGD处理成功模拟了缺血缺氧损伤,造成了神经元凋亡。
本研究首先使用不同浓度的RSV处理正常培养的神经元,检测其对细胞活力的影响,发现1、 10和50 μmol/L的RSV对细胞活力无影响,但是浓度达到100 μmol/L时能够抑制细胞活力。先前的文献显示,RSV对损伤神经元的作用具有剂量依赖性[9],因此我们选择10和50 μmol/L的RSV进行后续实验。本研究中OGD损伤后使用10和50 μmol/L的RSV处理发现,RSV能够减弱OGD诱导的细胞凋亡,降低活化的caspase-3和Cyt C的释放,上调Bcl-2/Bax值,高浓度的RSV对这些变化的影响更加明显。这些结果表明RSV能够缓解缺血缺氧诱导的神经元凋亡。
SDF-1在内皮细胞、树突状细胞和基质细胞等细胞中组成型表达,通过与其受体CXCR4结合,在调节细胞运动性方面发挥重要作用[6,13]。缺氧能够上调SDF-1和CXCR4的表达[14],本研究也发现OGD处理能够上调SDF-1和CXCR4 mRNA和蛋白表达。有研究表明SDF-1/CXCR4信号通路能够介导祖细胞向缺血性心肌组织的归巢现象[14]。SDF-1表达增加也参与干细胞向肾脏损伤部位的募集进而减弱肾脏缺血再灌注损伤过程[15]。Mori等[6]的研究表明SDF-1在新生儿大脑损伤的神经保护方面具有重要作用。本研究结果显示,与HIE组相比,RSV处理后能够上调SDF-1和CXCR4 mRNA和蛋白水平的表达,且高剂量RSV对两者表达的上调作用更加明显。这表明RSV减弱缺血缺氧诱导的神经元凋亡可能与SDF-1和CXCR4表达上调有关。
先前的研究显示,AMD3100是CXCR4的拮抗剂,可以阻断SDF-1/CXCR4通路[16]。为了进一步验证RSV是否是通过SDF-1/CXCR4通路发挥作用,我们使用了AMD3100,结果发现,与RSV单独处理相比,AMD3100和RSV共同处理的细胞凋亡率增加,活化的caspase-3和Cyt C的释放增加,Bcl-2/Bax值降低,这进一步确证了RSV是通过SDF-1/CXCR4通路发挥作用的。总之,本研究结果表明RSV通过上调SDF-1/CXCR4通路抑制缺血缺氧诱导的新生大鼠神经元的凋亡。
