EMS诱导的盛农1号小麦突变体筛选与鉴定
2018-07-27孙玉龙朱欣欣何瑞士李俊畅安俊航焦志鑫姜玉梅李巧云牛吉山
孙玉龙,朱欣欣,何瑞士,李俊畅,安俊航,焦志鑫,姜玉梅,李巧云,牛吉山
(河南农业大学/国家小麦工程技术研究中心,河南郑州 450046)
化学诱变剂可诱导植物产生可遗传的变异体,其中甲基磺酸乙酯(ethyl methane sulfonate,EMS)应用最为广泛,是目前在作物诱变育种中效果较好的化学诱变剂[1-3]。EMS诱变产生的点突变频率高,多为G-C到A-T的转换,染色体畸变相对较少,多数变异是易于筛查的显性点突变[2,4-5]。诱导植物产生变异,构建突变体库,可以为植物基因功能研究提供丰富的基础材料[6]。目前,采用EMS诱变技术已经在果蝇(Drosophilamelanogaster)[7]、拟南芥(Arabidopsisthaliana)[8-9]、水稻(Oryzasativa)[10]、大麦(HordeumvulgareL)[11]和玉米(ZeamaysL)[12]中建立了突变体库。普通小麦(TriticumaestivumL.)中也构建了多个突变体库,如小麦偃展4110[13]、河农822[14]、烟农15[15]、豫农201[16]、宁麦9号[17]和国麦301[18]等突变体库。偃展4110突变体库中包含了与小麦幼苗、叶、茎、穗及成熟期等重要农艺性状有关的突变体,可用于小麦遗传发育基础研究和育种[13]。
普通小麦是异源六倍体(AABBDD)植物,与模式植物拟南芥、水稻相比,其基因组庞大,基因拷贝数多,含有大量的重复非编码DNA,一些基因突变无法在表型上直观地反映[19]。普通小麦可以承受较高的突变密度,因此,EMS处理普通小麦的突变频率远高于其他植物,从而获得更多的等位变异[20],突变频率可达到每12~47 kb出现一个突变[21-24]。
突变体在小麦遗传研究和育种中发挥了重要作用。前人在研究中获得了一批典型突变体,如基部小穗不孕[25]、高秆大粒[26]、抗旱[27]、单蘖突变体 tin3[28]、雄性不育[29]、高直链淀粉[30]、高分子量谷蛋白(HMW-GS)亚基缺失[16-17]等突变体种质。一些突变基因已经被定位和克隆,如分蘖基因 tin3定位在染色体3A的长臂[28],克隆获得抗叶锈基因 Lr10[31],定位了淀粉合成酶突变基因 SSIIa-A[1]。一些突变体材料已经在育种中应用,如Dong等[32]培育出一个糯性小麦种质材料,可用于改良小麦品质。
虽然已有一些小麦突变体研究报告,但与庞大的小麦基因组相比,数量极其有限。本研究旨在利用抗白粉病的盛农1号构建小麦突变体库,为遗传和育种研究提供新突变体种质。
1 材料与方法
1.1 植物材料
盛农1号是河南农业大学国家小麦工程技术研究中心选育并繁育保存的高产、抗白粉病小麦新品系。
1.2 研究方法
1.2.1 EMS诱变处理
化学诱变剂为EMS。挑选籽粒均匀一致的盛农1号干种子1 kg,在0 ℃的冷水中浸泡4 h,然后用0.4%的EMS溶液在0 ℃浸泡种子2 h,在20 ℃浸泡14 h,将EMS溶液倒入实验室专用的有毒废液桶,用流水冲洗种子4 h,将种子放在绵纸上吸水晾干,播种。种植M1、M2、M3等世代时均以盛农1号为对照。
1.2.2 诱变种子的种植
种子诱变处理后,于2014年10月将其单粒播种在荥阳市豫龙镇国家小麦工程技术研究中心育种实验田(N34°85′;E113°45′),2015年对M1做好田间管理,成熟后按单穗收获种子,即M2种子;M2代种子于2015年10月种成穗行,M2植株按单株收获,根据各时期确定的突变体性状类型标定单株,按照穗、叶、株型3个大类突变类型进行筛选,并根据表型剔除一部分突变性状重复的个体,即M3种子;收取M2穗系中的突变体单株,其中每个突变体穗行中的正常植株也随机收获3~5株作为株系对照;M3代种子于2016年10月种成株行,2017年2-6月对突变体进行生物学和农艺性状调查分析。诱变材料各世代均按行距0.23 m,株距0.08 m播种,田间管理采用常规育种方式[16]。
1.2.3 农艺性状调查分析
在灌浆期,对多数小麦性状稳定的M3代株高、分蘖、穗长、小穗数、不孕小穗数、叶长、叶宽、穗下第1茎节长和地上第2茎节直径等9个性状进行调查[33-34],设5个重复;并对其中表型变异显著的4个纯合穗型突变体进行比较分析。采用最小显著性差异法(Least Significant Difference,LSD)分析8个突变体与对照盛农1号间是否存在显著性差异[35]。
2 结果与分析
2.1 突变体类型和突变频率
从4 500个M2代穗系中共筛选出174个穗系,突变率为3.87%。其中,穗部突变体32个,突变率为0.71%;叶部突变体47个,突变率为0.89%;茎部突变体22个,突变率为0.49%;育性和生育期突变体12个,突变率为0.27%;其他类型突变体11个,突变率为0.24%。茎秆、分蘖等综合农艺性状优于对照盛农1号的突变体57个,突变率为1.27%(表1)。
2.1.1 穗部突变体
在M2代诱变群体中共观察到32个穗系为小麦穗部和籽粒性状突变。
(1)穗形突变 有4种变异类型,一是密穗突变体(图1A),穗子短小,但小穗数多,平均24~26个,而且多数小穗分布不同,有的呈梯形分布,且多伴有叶子形状的变异(图1B),其中2个株系出现曲秆密穗突变(图1C);二是紧颖壳短穗突变体,穗子呈塔型,颖壳硬且包裹紧,株高比对照盛农1号略低;三是半截穗突变体(图1D),穗子中上部小穗不发育,整体小穗数平均仅8~9个,穗子呈现‘半截’状态,主要性状为幼苗期长势弱,抽穗晚,成熟晚,籽粒小;四是穗异常突变,穗子颖壳松散,不能产生正常的雌雄蕊,开花期颖壳张开(图1E)。
(2)穗色突变 有2种变异类型,一是浅黄穗突变,该突变体与对照盛农1号比较,穗色为淡黄色;二是白穗突变,穗子呈浅白色。
(3)籽粒突变 一种是籽粒变短变圆,多伴生于密小穗突变;一种是籽粒变得比对照更大。
2.1.2 育性突变体
突变类型为雄性不育,雄蕊发育不正常,不能产生正常成熟的花粉粒,但雌蕊发育良好,接受外来花粉可以形成正常籽粒。共发现2种类型,一是穗呈现淡黄色(图1F),植株发育正常,授粉后可得到较多籽粒,其中编号MS10的株系被命名为NWMS1(National Engineering Research Center for Wheat Male Sterility 1)。NWMS1的花药较小,不开裂,形态完整、成熟的花粉粒少,花粉活力低下,导致雄性不育,但其他农艺性状优良;二是穗呈现正常绿色(图1G),植株发育较弱,授粉后得到籽粒较少。
2.1.3 生育期突变体
突变类型有早熟和晚熟2种。早熟突变类型:叶片在灌浆后期迅速失绿,籽粒脱水,产量受影响明显,另一部分在乳熟后期籽粒迅速脱水,叶片失绿,这一部分突变体比对照早成熟3~5 d,对产量影响较小;晚熟突变类型:在乳熟期开始时,叶片仍呈现正常的绿色,且成熟期拉得较长,种子成熟较慢,籽粒饱满。
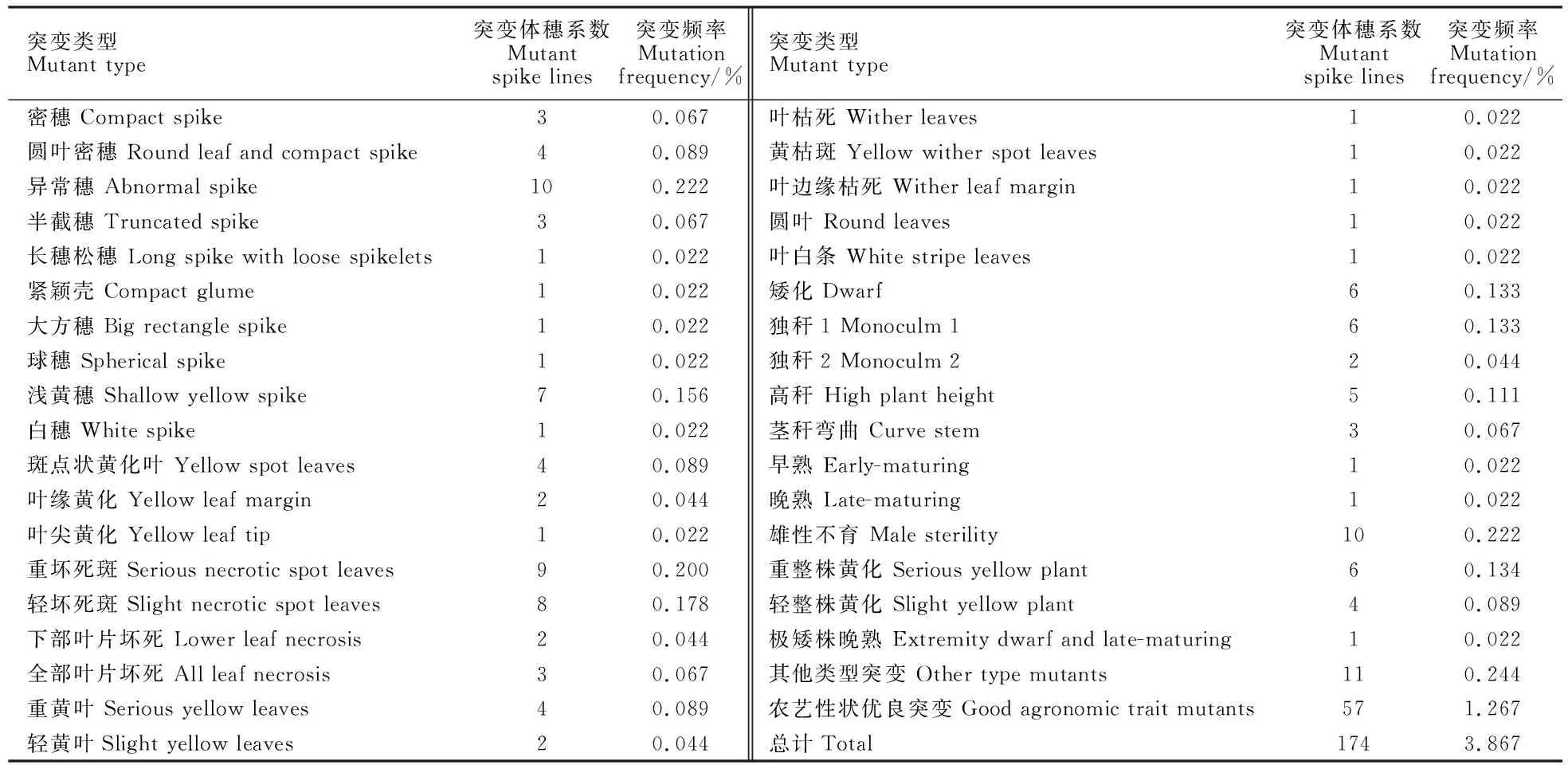
表1 EMS诱导小麦品系盛农1 号M2代的突变类型和突变频率Table 1 Mutant types and mutation frequency of EMS induced wheat line Shengnong 1 at M2 generation
在M2代穗系,对突变体进行观察筛选,同一M2穗系收获的正常单株和突变体单株播种在一起形成M3株系,在M3代进行详细的生物学特征和农艺性状观察记录。M3代突变体稳定表型代表M2代的突变体类型。
Mutants at the M2generation were observed and screened out. The normal individuals and the mutant individuals harvested from the same spike lines at M2were sown together to obtain the M3lines. The detailed biological characteristics and agronomic traits of the mutants were carefully observed and recorded at M3. The stable phenotypes of the mutants at M3represented the mutant type at M2.
2.1.4 茎秆突变体
在诱变群体中共观察到22个穗系为茎秆性状突变体。
(1)株高突变 可分为2种:一是比对照高10 cm以上的高株突变;二是比对照低10 cm以上的矮株突变。
(2)分蘖突变 变异类型有3种:一是独秆,仅有1个主茎分蘖正常发育,其他分蘖发育停滞,其中2个株系中独秆出现的频率为50%(图1H),而在另外6个株系中,独秆出现的频率为5%;二是矮化多分蘖无穗,灌浆期调查时,该株系分蘖多达36个,植株高仅为26 cm,但未进行穗分化,没有穗;三是极矮化少蘖(图1I),该株系株高19 cm,仅有分蘖3个,且有效分蘖率为50%。矮化,成穗少或无穗突变体,可能与春化、光周期调控基因变异有关。
(3)茎秆弯曲突变 变异类型为茎秆弯曲,茎秆的节间形成1个约75°的锐角,表现为株型散,植株之间相互影响较大(图1J)。

CK:盛农1号;A:密穗;B:圆叶密穗;C:曲秆密穗;D:半截穗;E:异常穗;F、G:雄性不育;H:独秆;I:极矮株晚熟;J:茎秆弯曲。
CK:Shengnong 1;A:Compact spike;B:Round leaf and compact spike;C:Curve stem and compact spike;D:Truncated spike;E:Abnormal spike;F、G:Male sterility;H:Monoculm 1;I:Extremity dwarf and late-maturing mutant;J:Curve stem.
图1穗、育性和茎秆突变表型
Fig.1Phenotypesofspike,fecundityandstemmutants
2.1.5 叶部突变体
在M2代诱变群体中观察到47个穗系为叶片突变。
(1)叶色突变 共6种类型:一是黄叶突变,这类突变体叶片变黄,整个叶片呈鹅黄色或淡黄色(图2A),严重时呈暗黄色(图2B),无法进行正常的光合作用,植株弱小;二是坏死斑突变(图2C),这类突变体从返青期开始,叶片出现微小的斑点,类似过敏性坏死斑,由于叶片的早衰导致灌浆提前终止,迫使小麦比对照早熟5~7 d;三是下部叶片坏死突变(图2D),在抽穗期开始,下部叶片整体呈现褐色坏死状,与之相对应的是全部叶片坏死,整株叶片呈现黑褐色坏死状,无法进行正常的光合作用,无法产生正常的籽粒;四是黄枯斑突变(图2E),整株叶子上分布有缺水干枯状的黄褐色斑,分蘖少,但穗子长势正常;五是叶缘黄化突变(图2F),旗叶边缘黄化,叶中脉部分呈现绿色,也有一部分叶片呈现缺水干枯状,长势弱,籽粒较小。六是叶白条突变(图2G),在拔节期即开始出现,叶片上有约15 mm × 1 mm的白色条状失绿斑。
(2)叶形突变 主要是圆叶突变,这类突变体从拔节期开始,叶片呈包裹状,无法伸展开,叶尖呈圆弧形而非正常的尖长形,这类突变体多与密穗伴生为复合突变(1B和1C);二是锯齿叶,叶片呈缺刻状,叶片极短(3 ~5 cm)(图2H)。
2.1.6 其他类型的突变体
难以界定的突变类型有2种,一是整株非正常黄化,与叶片突变类型中的黄化突变不同的是,这类突变体整株,包括穗子、茎秆,呈失绿状;二是少数叶片出现白斑,与叶片突变类型中的叶枯斑不同的是,这类突变体中只有下部极少数叶片出现1 mm×1 mm的白斑,但在M3代种植后并未出现类似性状。
2.1.7 农艺性状优良突变体
这类突变体大部分或整体农艺性状明显优于对照盛农1号,分蘖力、茎秆、籽粒大小和有效穗数等产量性状优于对照盛农1号。重要代表就是大穗突变AC7、AC9和AC13(图2I),比较大穗籽粒与对照盛农 1 号籽粒,发现AC9和AC13的籽粒显著大于对照,AC7的籽粒明显小于对照(图2J)。

CK:盛农1号;A:黄叶;B:严重黄叶;C:坏死斑;D:下部叶片坏死 ;E:黄枯斑;F:叶缘黄化;G:叶白条;H:缺刻叶;I:大穗(左边第1个穗为对照,后面依次为大穗突变体AC7、AC9和AC13的穗);J:大穗籽粒 (上面第1列为对照,下面3列为3个不同大穗突变体株系AC7、AC9和AC13的籽粒)。
CK:Shengnong 1;A:Yellow leaf;B:Serious yellow leaf;C:Necrotic spot leaves;D:Lower leaf necrosis;E:Yellow wither spot leaf;F:Yellow leaf margin;G:White stripe leaf;H:Incision leaf;I:Large spike(the left spike is control, and the other three spikes are from mutants AC7, AC9 and AC13);J:Grains from large spike mutants(the top line is control, and the other three lines are grains from the three different large spike mutants AC7, AC9 and AC13).
图2叶片及大穗突变类型
Fig.2Typesofleafandlargespikemutants
2.2 纯合突变体的农艺性状分析
对M3代突变体株系进行鉴定,获得纯合、稳定遗传的株系18个,其中,穗部突变体6个,茎秆突变体1个,叶部突变体6个,早熟突变体3个,晚熟突变体2个。对其中4个M2代穗部突变体株系SS4、SS5、SS6和SS16衍生的14个M3代纯合突变体株系的成熟期主要农艺性状进行调查。结果(表2)表明,与对照盛农1号相比,4个突变体株系的株高、叶长、叶宽、穗下第2茎节长和芒长均显著降低;所有株系的小穗数和分蘖数与对照的差异都不显著;多数株系的地上第2茎节粗与对照差异不显著。SS4、SS5和SS6的穗密度比对照增加30%以上,其中,株系SS4-1和SS6-4的穗密度增加65%以上。这4个穗型突变体株系的籽粒形状与对照也有明显的区别,具体见图3。

表2 M3代纯合穗型突变体株系的农艺性状表现Table 2 Agronomic traits of some homozygous spike mutant lines at M3
*和**分别表示与对照差异显著(P<0.05)和极显著(P<0.01)。
* and ** indicate significant difference to control at 0.05 and 0.01 levels,respectively.

A、E、I:圆叶密穗突变(左侧的穗子和小穗为对照盛农1号,籽粒的上边1排为盛农1号,以下皆同) ;B、F、J:紧颖壳短穗突变 ;C、G、K:密穗突变;D、H、L: 紧颖壳黄穗突变。
A,E,I:Round leaf and compact spike(spikes and spikelets on the left side are the control Shengnong 1, the grains on the top line are the control, they are the same in other sets of images);B,F,J:Compact glume and short spike;C,G,K:Compact spike mutant;D,H,L:Compact glume and yellow spike.
图3M3代4个纯合穗型突变体株系与对照盛农1号在灌浆期的穗、小穗、籽粒比较
Fig.3Comparisonofthespikes,spikeletsandgrainsofthefourhomozygousspikemutantlineswithShengong1atgrainfillingstage

A:少分蘖突变体;B:黄叶突变体YL12,右边为对照;C:黄叶突变体YL12叶片,下面3片为对照;D:早熟突变体DC5(左边),晚熟突变体DC7(右边)。
A:Few tiller mutant;B:Yellow leaf mutant YL12,right is control;C:The leaves of the yellow leaf mutant YL12, the three leaves below are control;D:Early-maturing mutant DC5(left), late-maturing mutant DC7(right).
图4少分蘖、叶片黄化和成熟期突变体在田间的表现
Fig.4Phenotypesofthefewtiller,yellowleafandmaturationmutantsinfield
3 讨 论
本研究通过EMS诱变构建了盛农1号的EMS突变体库。M2代中共有174个表型变异明显的突变体,对M3代进行鉴定筛选,获得了36个具有明显遗传研究和育种价值的突变体株系。EMS诱导的小麦突变有很大一部分是无表型突变,只有很少部分的突变会产生表型上的变化[19]。前人研究显示,小麦突变率较高,如陈 锋等[20]构建豫农201突变体库的突变率为9.17%,赵天祥等[13]构建偃展4110突变体库的突变率是6.6%,而本研究的突变率仅为3.87%,这可能是由品种特性、EMS处理过程和调查标准不同造成的。
对M2代和M3代的突变体株系表型鉴定表明,该突变体库中有丰富的变异类型,一些突变体未见报道,如短圆形籽粒突变、密穗穗中部不孕突变体等。有关近圆形籽粒小麦突变体报道也较少。本研究已获得纯合圆形籽粒小麦突变体,并在M3代中获得稳定纯合圆形籽粒小麦突变体株系,这些是研究小麦籽粒形态建成的新材料。本研究还获得了黄化突变体、晚熟突变体和穗细长颖壳紧,密穗等突变体的纯合株系。从1个早熟突变体品系中分离出1个纯合的晚熟突变体株系,形成了1对理想的熟期显著不同的近等基因系,为小麦熟期遗传研究创造了理想种质。突变体库中的其他突变体,如矮密穗、长尖穗、紧颖壳穗、独杆等也为后续的小麦相关分子遗传机理研究提供了优良的新种质[36-37]。
诱变剂诱致的植物变异是无方向性的。EMS诱导会使多数突变体材料产量降低,但也会使少数材料出现产量增加、品质提高、抗病性增强等有益变异,这一部分农艺性状优异的突变体可作为品种改良的新种质[38]。薛 芳等[39]利用EMS诱变构建的新春11小麦突变体库,综合各突变体农艺性状、产量性状和品质的表现,筛选出7个抗性淀粉含量高且综合性状优良的M2突变家系。
本研究对EMS诱导产生的突变体株系进行综合农艺性状鉴定,获得了一批包括矮秆、抗病、早熟、大穗、大粒等性状优良的突变体,已作为优异的种质资源用于小麦育种。雄性不育系NWMS1,编号MS10,花粉败育彻底,农艺性状优良,已将其应用于小麦遗传研究的近等基因系构建和小麦群体改良。
