HMGB1⁃TLR4轴及其下游信号因子在帕金森病患者中的变化及其意义
2018-07-26王国辉王丽华秦丽红宁树君吴佳欢
王国辉 王丽华 秦丽红 宁树君 吴佳欢
佳木斯大学附属第一医院神经内科(黑龙江佳木斯154002)
帕金森病是中老年常见的神经系统病变疾病,基本病理特征是黑质-纹状体内多巴胺能神经元变性及功能缺失,临床表现为静止性震颤、运动迟缓、肌强直和姿势步态的异常[1],近年来发现神经炎症在帕金森病的发生发展中有着重要的作用[2-4]。高迁移率族蛋白B1(HMGB1)作为胞外一种高迁移率族蛋白,不仅在胞外可以启动/放大炎症性免疫反应,而且其引发的炎症反应在脑组织中发挥着重要的作用[5]。尤其是在神经炎症反应中,HMGB1高表达可以促进星形胶质细胞激活RAGE⁃MAPK信号,从而促进趋化因子、环氧化酶2和基质金属蛋白酶9等诸多生物活性分子的表达[6]。研究还发现HMGB1可以引起脑组织IL⁃6等炎症因子表达[7]。这一系列神经炎症性因子的表达可以促进神经细胞的凋亡,促进中枢退行性疾病的发生和进展。本研究主要探讨帕金森病患者中HMGB1及其受体Toll样受体4(TLR4)的表达与帕金森病发生发展的关系,并做一探讨,为临床中帕金森病的研究提供参考和支持。
1 资料与方法
1.1 一般资料 选择我院2015年6月至2017年6月就诊并确诊为帕金森的患者120例(PD组),纳入标准为:(1)运动缓慢:随意运动的启动缓慢、病情进展后,重复性动作的速度及幅度进行性降低;(2)符合以下症状之一:肌强直,静止性震颤(4~6 Hz),姿势平衡的障碍(非由于原发性的视觉、前庭、小脑及本体感觉功能障碍造成的)。排除标准为:(1)反复脑卒中发作伴随帕金森病症的阶梯性进展;(2)脑损伤史;(3)在应用精神药物中出现的症状;(4)起病3年后仍表现为单侧症状的患者;(5)小脑病变体征;(6)Babinski等病理征(+);(7)CT或者磁共振检查显示脑部肿瘤等器质性病变;(8)大剂量左旋多巴治疗后无效的患者。入组的帕金森病患者还符合以下辅助诊断的3项及以上:(1)单侧起病;(2)静止性震颤;(3)逐渐进展;(4)症状不对称,起病侧较重;(5)左旋多巴有明显疗效(70% ~100%有效);(6)左旋多巴导致严重的异动症;(7)左旋多巴疗效持续5年及以上;(8)病程10年及以上。120例患者根据Hoehn⁃Yahr分级标准,其中Ⅰ级40例,Ⅱ级35例,Ⅲ级35例,Ⅳ级10例,Ⅴ级0例。选择同期于我院体检中心的健康人100例作为对照组。入组时排除感染性疾病、免疫抑制剂、激素使用等。该研究所有患者信息、血液样本等均获得患者或家属知情并同意及伦理委员会批准。
1.2 标本收集及检测 所有入住帕金森病患者及健康人均禁食12 h后采集外周静脉血2 mL,室温下静置0.5 h后离心20 min,取上层血清,-80℃条件下保存。应用双抗体夹心酶联免疫吸附实验(ELISA)测定血清中HMGB1⁃TLR4轴及髓样分化因子(MyD88)、核因子κB(NF⁃κB)、肿瘤坏死因子α(TNF⁃α)的表达水平。用酶标仪在450 nm处测定吸光度A,以标准品的浓度为横坐标,A为纵坐标绘制标准曲线,根据A带入标准曲线拟合方程式,计算血清样本中HMGB1和TLR4、MyD88、NF⁃κB、TNF⁃α的水平,结果以ng/L表示。
1.3 统计学分析 数据处理采用SPSS 21.0软件分析,方法采用方差分析(F分析),PD组和对照组的比较采用LSD法,相关性分析采用Pearson相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组研究对象基本资料的对比 帕金森患者120例(PD组)和对照组100例,在年龄组成、性别组成、基础疾病、吸烟史、体质量等基础资料比较差异均无统计学意义(P>0.05)。见表1。
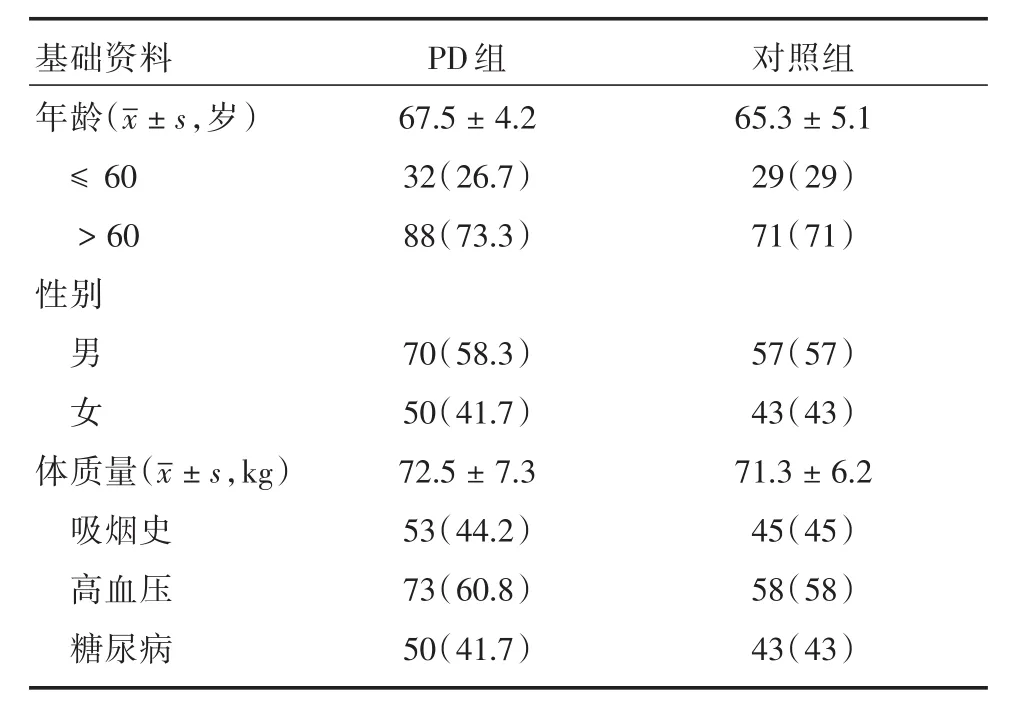
表1 患者基础资料对比Tab.1 Comparison of patients′basic data 例(%)
2.2 两组研究对象血清中HMGB1和TLR4的表达水平比较 帕金森病患者外周血中HMGB1为(5.96±2.10)ng/L显著高于对照组(1.30±0.18)ng/L(F=18.32,P<0.001),帕金森病患者外周血中TLR4为(2.56±0.78)ng/L显著高于对照组(0.87±0.12)ng/L(F=26.31,P< 0.001)。帕金森病患者外周血HMGB1和TLR4表达有一定相关性(r=0.757 8,图1)。
2.3 帕金森病患者血清HMGB1和TLR4的表达与分期的关系 Ⅰ期帕金森病患者HMGB1表达为(3.53±1.01)ng/L,Ⅱ期表达为(6.41±0.87)ng/L,Ⅲ期表达为(7.16±0.68)ng/L,Ⅳ期表达为(8.44±1.12)ng/L,各分期均显著高于对照组(t=3.25、5.47、8.36、12.11,均P<0.001),而Ⅰ期中TLR4为(1.67±0.40)ng/L,Ⅱ期为(2.57±0.51)ng/L,Ⅲ期为(3.11±0.42)ng/L,Ⅳ期为(3.89±0.61)ng/L,各分期均显著高于对照组(t=3.24、6.54、8.21、10.32,均P<0.001)。HMGB1和TLR4随着帕金森病分期的增高,表达显著增高。见图2。
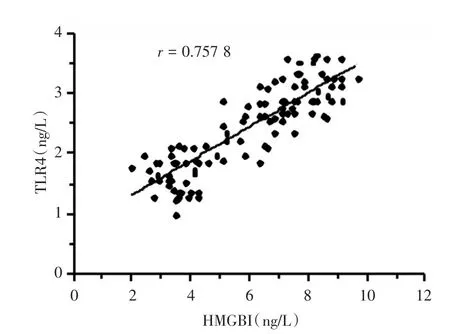
图1 帕金森病患者外周血中HMGB1和TLR4的表达的相关性(n=120)Fig.1 Correlation of expression of HMGB1 and TLR4 in peripheral blood of patients with Parkinson′s disease(n=120)
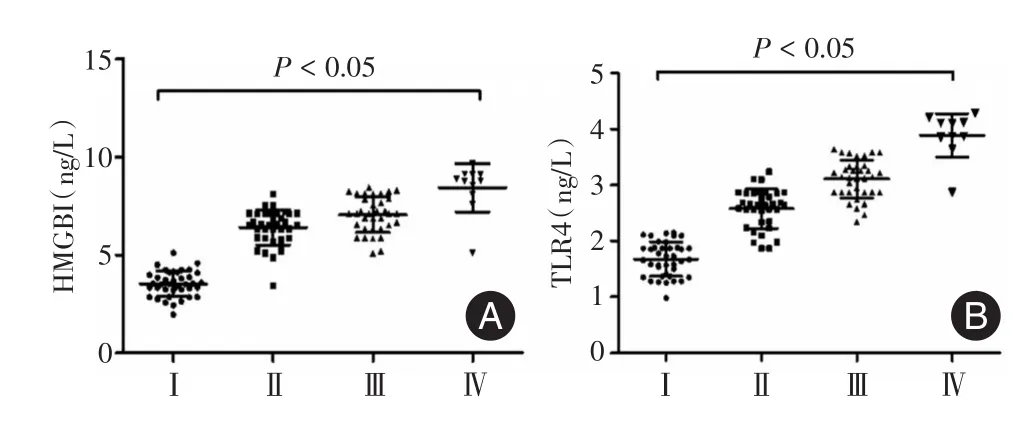
图2 帕金森病分期与患者血清中HMGB1和TLR4的表达的关系(n=120)Fig.2 The relationship among the stage of Parkinson′s disease and the expression of HMGB1 and TLR4 in the serum of the patients(n=120)
2.4 帕金森患者者血清HMGB1和TLR4的表达与临床分型的关系 将120例患者按照临床表现分为混合型、震颤型和强直型。混合型的帕金森患者临床表现主要为同时有肢体震颤和肌肉强直的表现;震颤型帕金森患者的临床表现主要为肢体震颤,肌肉强直不明显;强直型帕金森患者的临床表现主要为肌肉的僵硬。组间比较HMGB1和TLR4差异均无统计学意义(P>0.05)。见表2。
2.5 帕金森病患者血清HMGB1和TLR4的表达与药物治疗的关系 120例帕金森病患者均接受多巴胺类药物及其酶抑制剂的联合治疗,其中83例控制良好,37例药物控制不佳出现了病情的进展。在对其血清HMGB1和TLR4的表达分析后,药物控制良好的患者(有效组)HMGB1的表达为(4.25±0.65)ng/L、TLR4的表达为(2.31±0.87)ng/L,而药物控制不佳的患者(难治组)HMGB1的表达为(6.43±1.14)ng/L、TLR4的表达为(3.10±0.93)ng/L,两组之间比较差异有统计学意义(F=13.21、15.22;均P< 0.001)。

表2 帕金森患者血清HMGB1和TLR4的表达与临床分型的关系Tab.2 The relationship among the expression of HMGB1 and TLR4 in the serum of Parkinson patients and the clinical typing
2.6 帕金森病患者血清HMGB1和TLR4的表达与病程的关系 120例帕金森患者按照病程分类,其中<4年为52例,4~8年为46例,>8年以上为22例。其中病程<4年的帕金森病患者血清中HMGB1的表达为(3.87±0.85)ng/L,TLR4的表达为(1.85±0.49)ng/L,病程4~8年的患者HMGB1的表达为(5.41±0.76)ng/L,TLR4的表达为(2.52± 0.63)ng/L,病程>8年的的患者HMGB1的表达为(6.13±1.12)ng/L,TLR4的表达为(3.13±0.86)ng/L,而组间比较HMGB1和TLR4的表达差异有统计学意义(P=0.003、0.001)。
2.7 帕金森病患者血清中HMGB1⁃TLR4轴下游因子MyD88、NF⁃κB以及TNF⁃α的表达 正常健康人中MyD88(518.2 ± 63.4)ng/L、NF⁃κB(985.3 ±114.6)ng/L以及TNF⁃α(207.3± 27.4)ng/L的表达显著高于帕金森病患者MyD88(879.2±85.3)ng/L、NF⁃κB(1 453.4 ± 184.6)ng/L 以及 TNF⁃α(415.3 ±46.7)ng/L(F=15.32、22.31、18.32,P=0.000、0.000、0.000)。见图3。

图3 帕金森病患者血清中HMGB1⁃TLR4轴下游因子MyD88、NF⁃κB以及TNF⁃α的表达(n=120)Fig.3 Expression of the HMGB1⁃TLR4 axis downstream factors MyD88,NF⁃κB,and TNF⁃α in the serum of patients with Parkinson′s disease(n=120)
3 讨论
随着对HMGB1的深入研究后发现,HMGB1和TLR4介导的炎症反应与多种疾病有关,有败血症、脑胶质瘤等[7-8]。HMBGI⁃TLR4轴是炎症反应的中心环节,受损坏的细胞、激活的巨噬细胞等均可以主动/被动释放HMGB1,释放后可以通过信号通路诱导TNF⁃α和IL⁃6等炎症因子的分泌,而早期致炎因子及HMGB1本身又可以促进HMGB1的释放,形成环路后可以放大炎症反应[9-11]。Toll样受体TLR4作为细胞表面识别受体,可以识别内源性的HMGB1,TLR4激活后可以募集髓样分化因子MyD88样接头蛋白,而MyD88可以与IL⁃1等受体相关激酶家族蛋白形成复合物,最终促使核转录因子(κB)进入细胞核发挥调控作用[12-14]。诱导帕金森病的外界影响因素很多,这类因素可以损伤人脑组织中星形胶质细胞、小胶质细胞等进而激活释放 HMGB1[15],激活的胶质细胞或者神经元通过旁分泌或自分泌激活HMBGI⁃TLR4信号,在HMGB1参与的神经炎症研究中发现HMGB1具有促神经炎因子样作用,脑室内注射HMGB1可以促进小鼠脑组织中TNF⁃α和IL⁃6的表达,NF⁃κB作为HMBGI⁃TLR4信号的下游因子之一,它可以诱导巨噬细胞中白介素6的表达,由于白介素6是一种多效性促炎因子,在慢性炎症以及神经炎症中发挥着重要的作用,而TNF⁃α通过NF⁃κB的诱导活化后也可以参与炎症反应。MyD88通过多种Toll样受体激活[16-17],介导白介素6的活化。所以NF⁃κB、TNF⁃α、MyD88的表达水平可以反应神经炎症水平,以及HMBGI⁃TLR4轴的表达。
在神经炎症的研究中已经有多项报道称,炎症因子的水平和病情的发展具有相关性,帕金森病虽然是一种中枢退行性的疾病,但是在发病机制的报道中也存在星形胶质细胞过度激活、炎症因子过度释放等。而据以往的报道,HMGB1⁃TLR4作为中枢神经炎症反应的核心信号是否与帕金森病发生发展具有关系则未见报道,所以本研究的结果初步探明了HMBGI⁃TLR4轴及其下游信号因子在帕金森病的表达异常,从结果来看,随着病程的进展,分级的提高,HMGB1⁃TLR4轴表达水平明显增高。这可能为临床中帕金森病分级诊断提供一种标志物的参考。但是本研究从临床角度出发,未进行深入的机制研究,所以HMGB1⁃TLR4轴促进帕金森并进展的机制尚未被揭示,这也是笔者后续所需要开展的研究。
