小肾嗜酸细胞腺瘤的CT增强表现及与小肾透明细胞癌的鉴别
2018-07-25马丽娅胡道予李佳丽沈亚琪李震罗彦
马丽娅, 胡道予, 李佳丽, 沈亚琪, 李震, 罗彦
肾嗜酸细胞腺瘤(renal oncocytoma,RO)是起源于肾远曲小管和集合管的良性肿瘤,占原发肾肿瘤的3%~9%[1]。由于其发病率不高,缺乏特异的影像学特征,特别是<4cm的肿瘤,诊断和鉴别较为困难,常误诊为透明细胞肾细胞癌(clear cell renal cell carcinoma,CCRCC)。本文回顾性分析经病理证实的小RO病例,通过定性及定量分析探讨其CT影像特点及与小CCRCC的鉴别要点。
材料与方法
1.一般资料
回顾性搜集本院2012年5月-2017年9月经手术及病理证实、术前行CT三期增强扫描的RO及CCRCC病例,病灶最大径均≤4 cm。共搜集RO 10例,其中男5例,女5例,年龄33~66岁,平均51岁。9例患者无症状,因体检偶然发现,1例因患侧间断腰痛1年体检发现。CCRCC 20例,其中男13例,女7例,年龄26~78岁,平均53岁。14例患者无明显症状,因体检偶然发现,4例因急性或慢性腰痛,2例因血尿就诊。
2.检查设备与方法
CT扫描采用多排螺旋CT(GE discovery 750、Lightspeed VCT,Philips Briliance 256)。扫描范围自膈肌平面至腰4椎体水平。增强扫描采用双筒高压注射器自肘静脉注入非离子型碘对比剂,碘普罗胺(370 mg I/mL)1.0~1.5 mL/kg(50~80 mL),流率2.0~4.0 mL/s。采用团注追踪技术,皮质期、髓质期及肾盂期扫描延迟时间分别为20~30 s、40~60 s、180~240 s。
两名放射科医师分别阅片,记录肿瘤部位、边缘、密度、有无钙化、囊变、坏死、与正常肾实质夹角、中心星状瘢痕、节段强化反转征及假包膜,意见不一致时,共同协商。
CT图像处理和定量分析:皮质期、髓质期及肾盂期测量病灶时ROI取明显强化区,同侧肾皮质测量取强化均匀处,肾盂期测量避开明显强化的肾盂,各测量三次,取平均值。分别计算皮质期、髓质期及肾盂期病灶/皮质CT值比值。
3.统计学分析
统计学分析采用SPSS 22.0,对于连续型变量表示为均数±标准差,先检验是否服从正态分布,如符合则使用t检验,不符合则使用秩和检验。对于二分类变量使用Fisher精确检验。使用MedCalc 12.7将两组间有统计学差异的CT征象以及各种模型组合绘制ROC曲线,并得到相应的敏感度和特异度。以P<0.05为差异具有统计学意义。
结 果
1.临床资料
RO及CCRCC患者临床资料及CT征象见表1。本组病例中RO及CCRCC均为单发。RO共10例,其中位于右肾上极2例、中部1例、下极2例,左肾中部3例、上极2例。肿瘤轴位最大径1.5~4.0 cm,平均3.0 cm。CCRCC共20例,其中位于右肾上极4例、中部4例、下极2例,左肾上极4例、中部5例、下极1例。肿瘤轴位最大径1.5~4.0 cm,平均3.0 cm。
RO及CCRCC的患者年龄、性别及病灶大小差异均无统计学意义(P<0.05)。

表1 RO及CCRCC患者临床特征及CT征象
2.CT表现
CT显示RO病灶边界清晰,所有病灶均突出于肾轮廓外,1例与正常肾实质交界为锐角,其余为钝角。3例可见中心星状瘢痕(肿瘤最大径3.0~3.9 cm)(图1),5例可见假包膜,无囊变坏死。5例肿瘤可见节段强化反转征(图2),该5例肿瘤轴位最大径2.1~3.1 cm,占本组病例的50%。1例肿瘤皮质期呈明显轮辐状强化,3例边缘环状强化,1例强化均匀,5例强化不均匀。CCRCC病灶部分边缘清晰,部分模糊。1例病灶位于肾轮廓内(图3),其余19例均突出于肾轮廓外,其中12例与正常肾实质交界为锐角,7例为钝角。18例可见囊变/坏死,1例有小点状钙化(图4)。增强扫描2例呈环状强化,1例呈局部结节状强化,17例呈不均匀强化,5例肿瘤周围可见明显增粗血管影。有1例病灶可见节段强化,但没有明确强化反转。
其中两组间病灶与正常肾实质夹角(P=0.008)、病灶的中心星状瘢痕(P=0.030)及节段强化反转征(P=0.002)差异均有统计学意义,前者敏感度较高(90%),后两者特异度较高(均为100%),三者ROC曲线下面积(area under curve,AUC)分别为0.778、0.650、0.750(表2、图5),但三者间差异无统计学意义。最大径、是否突出肾轮廓差异均无统计学意义(表1)。
将病灶与正常肾实质夹角(角度)、中心星状瘢痕(瘢痕)、节段强化反转征(反转)进行组合,分别进行模型1(角度+瘢痕+反转)、模型2(角度+瘢痕)、模型3(角度+反转)、模型4(瘢痕+反转)预测分析,其中模型1和3的敏感度较高(100%),而模型4特异度较高(100%),AUC值从高到低依次为模型1(0.930)、3(0.912)、2(0.830)、4(0.800),四者间差异无统计学意义(表2、图6)。

图1 女,33岁,RO。a) CT增强扫描皮质期示病灶中心无明显强化星状瘢痕(箭); b) CT增强扫描髓质期示病灶中心星状瘢痕仍无明显强化(箭); c) CT增强扫描肾盂期示星状瘢痕与周围病灶实质强化相仿。 图2 男,42岁,RO。a) CT增强扫描皮质期示增强相对强化区(长箭)及增强相对减弱区(短箭),CT值分别为128HU、114HU; b) CT增强扫描髓质期示上述节段强化反转为增强相对减弱区(长箭)及增强相对强化区(短箭),CT值分别为102HU、179HU; c) CT增强扫描肾盂期示上述强化区强化均减弱,CT值分别为66HU、74HU。

表2 两组不同CT征象及各种模型的AUC及95%置信区间
3.CT图像测量及处理
RO与CCRCC增强扫描各期病灶强化区及邻近正常肾皮质CT值差异均无统计学意义(P>0.05,表3)。两组各期病灶/皮质CT值比及CT值差值差异亦无统计学意义(P>0.05,表4)。
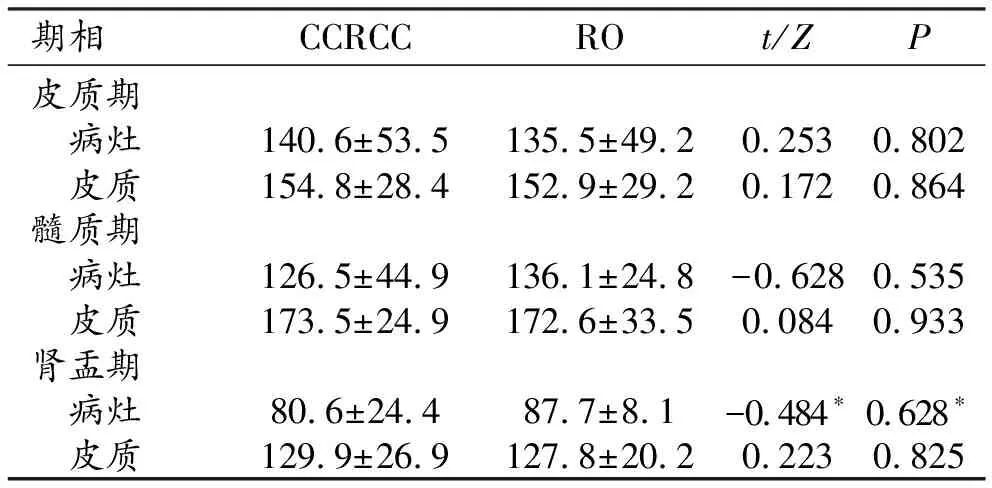
表3 两组病灶不同期相病灶及肾皮质的CT值
注:*为秩和检验。

表4 两组间病灶/皮质CT值比较
注:*为秩和检验。
讨 论

图3 男,47岁,CCRCC。a) CT增强扫描皮质期示病灶完全位于右肾中份后部肾实质内,边界欠清晰,不均匀强化(箭); b) CT增强扫描髓质期,病灶强化减弱(箭); c) CT增强扫描肾盂期病灶密度低于周围肾实质,累及肾盂(箭)。 图4 女,52岁,CCRCC。a) CT增强扫描皮质期示病灶位于右肾中份前缘(箭),突出肾实质,边缘明显强化,中心可见小点状致密影; b) CT增强扫髓质期,病灶边缘明显强化,中心小点状致密影未见明显变化(箭); c) CT增强扫描肾盂期示病灶边缘强化明显减低,中心仍可见小点状致密影(箭)。中心致密影三期测值均>170HU,为小点状钙化灶。
RO与CCRCC均好发于中老年,男性较女性多见[2-3]。RO通常无临床症状,多为偶然发现,少数患者可表现为腰部不适,肿物或血尿[2]。近年来,无症状CCRCC检出率逐年升高,占33%~50%[3]。本组病例RO及CCRCC在发病年龄、性别及临床症状方面均无显著差异。
RO多起源于肾皮质,突出于肾脏轮廓外,单侧多见,多发率为2%~12%,双侧发生率为4%~12%[4]。肿瘤边界清晰,CT平扫肿瘤呈等/低密度,可见完整假包膜。钙化、出血及坏死相对少见。钙化多发生在星状瘢痕内。增强扫描<4 cm的RO最常见的强化方式为皮髓质期不均匀强化,延迟期均匀强化,密度低于正常肾皮质[5]。本组10例RO均位于肾皮质,突出于肾轮廓外,强化方式与文献相符。5例可见假包膜。假包膜是由于肿瘤膨胀性生长,推挤邻近正常肾实质所致,包膜多完整。
本研究显示,中心星状瘢痕、节段性强化反转征以及与正常肾实质夹角为钝角有助于RO与CCRCC的鉴别。
文献报道,星状瘢痕是RO的较特征性表现,尤其是较大的肿瘤。瘢痕多为中心性,也可呈偏心性。CT上表现为低密度,增强扫描皮髓质期强化不明显,部分瘢痕可见延迟强化。Eiss等[6]报道,对于>3 cm的RO,55%显示星状瘢痕。本组病灶中3例RO显示星状瘢痕,最大径均>3 cm,占本组30%。本组病例中星状瘢痕增强各期均未见明显强化。而在CCRCC病灶中并未见到明确星状瘢痕,因此病灶内出现星状瘢痕则可提示更倾向于诊断为RO。
Kim等[7]报道节段性强化反转有助于鉴别<4 cm的RO和CCRCC。节段性反转强化指CT增强扫描皮、髓质期肿瘤内呈现两种强化程度不同的部分,在排泄早期,这两部分强化程度发生反转,即皮髓质期强化明显的部分在排泄早期强化减弱,而皮髓质期强化不明显的部分在排泄早期强化明显。组织病理学证实皮髓质期明显强化的部分为紧密排列的肿瘤实性结构,强化不明显的为肿瘤玻璃样变的间质成分。2014年的一篇系统评价总结认为节段性强化反转是RO较特异的影像学征象,但不同文献报道的敏感度差别很大,可能与扫描延迟时间差异有关[8]。本组中5例RO可见节段性强化反转,发生率达50%,而CCRCC中未见明确节段强化反转征。

图5 两组间不同CT征象的ROC曲线。 图6 两组间各种模型的ROC曲线。
本组病例中10例RO病灶边缘均与肾实质呈钝角,即大部分位于肾实质内,而CCRCC中有19例病灶边缘均突出肾轮廓(12例呈锐角),仅1例完全位于肾实质内,两组间病灶与肾实质夹角差异有统计学意义,提示在RO和CCRCC鉴别中具有一定价值。
在ROC曲线分析中,各单独征象(与正常肾实质角度成钝角、具有中心瘢痕及节段强化反转征)单独的AUC值均<0.8,检验准确性并不突出。而进行模型组合后,各模型的AUC值均>0.8,即说明如出现任何2种或3种上述征象,则诊断为RO的准确性明显增加,以模型1和模型3检验效能最高,可进一步指导临床工作。其中瘢痕征及反转征在本组研究中特异度均达到了100%,两者组合的模型4特异度也达到100%,其敏感度(60%)较两种征象单独的敏感度(分别为30%、50%)有所提高。RO患者中有2例同时具有三种征象,3例患者同时有钝角角度及节段强化反转征,1例患者仅具有中心瘢痕征,即RO患者中有6/10例(60%)在术前更倾向于被诊断为RO。而在CCRCC患者中无病例具有中心瘢痕或节段强化反转征,与正常肾实质的夹角12例为锐角,7例为钝角。
然而需要注意的是,有文献报道星状瘢痕、轮辐状强化或节段性强化反转均可见于肾癌,且中心星状瘢痕有时与肾癌肿瘤中心坏死不易鉴别。部分学者认为,星状瘢痕、轮辐状强化及节段性强化反转等征象的发生率在RO与肾癌中并无差异,术前CT不能准确鉴别两者[9-10]。
有文献显示,定量测定病灶增强扫描CT值可能有助于RO与CCRCC的鉴别,然而不同学者得出的结论并不一致。尚燕宁等[11]显示RO与CCRCC皮质期病灶/皮质比值有统计学差异。张光锟等[12]发现RO呈快进慢出的强化方式,CCRCC则为快进快出,病灶皮质期与髓质期CT值差值,CCRCC高于RO。而Young等[13]研究则认为CCRCC皮髓质期和排泄期的CT值都高于RO。本研究中RO与CCRCC在术前CT增强检查中各CT值及处理差值、比值差异均无统计学意义。各研究中结论的差异,可能与肿瘤大小(本文仅选取最大径≤4 cm的病灶),各研究增强扫描时相差异有关。另一方面也提示RO影像学表现并不特异,术前CT增强的影像学表现可能并不能有效区分RO与CCRCC,此结论与之前文献相似[14]。
综上所述,RO为相对少见的肾脏良性肿瘤,影像学表现具有一定的特点。对于无症状偶然发现的小肾皮质肿块,突出于肾轮廓外、与肾实质夹角为钝角、伴中心瘢痕及节段强化反转,可提示倾向于RO的诊断。但术前CT增强检查并不能完全区分RO与CCRCC。对于鉴别困难者,可行穿刺活检或术中冰冻切片,避免不必要根治性肾切除。