单指数、双指数及拉伸指数模型扩散加权成像在卵巢良恶性肿瘤鉴别中的价值
2018-07-25孟楠翟战胜殷慧佳金兴兴刘文玲韩东明
孟楠, 翟战胜, 殷慧佳, 金兴兴, 刘文玲, 韩东明
在女性生殖系统诸多恶性肿瘤中,卵巢癌以高发病[1]、高致死[2]、多种类而闻名,准确的早期诊疗对于患者的生存和预后意义非凡[3]。随着定量MRI的发展,扩散加权成像(diffusion weighted imaging,DWI)在卵巢良恶性肿瘤的鉴别诊断方面展现出一定优势[4],但鉴于人体内水分子运动方式复杂多样,其可靠性逐渐令人质疑。体素内不相干运动(intravoxel incoherent motion,IVIM)成像,弥补了传统DWI成像仅靠单指数分析病变特征的不足,以双指数[5]模型和拉伸指数模型[6]为基础,能够从扩散、灌注、异质性等多个角度反映病变特点,并已在前列腺癌[7]、乳腺癌[8]的诊疗及预后评估领域获得认可。本研究旨在探讨单指数、双指数及拉伸指数模型DWI在卵巢良、恶性肿瘤鉴别诊断中的价值,为临床诊疗提供参考。
材料与方法
1.研究对象
搜集2016年9月-2017年6月在本院行MRI检查的卵巢肿瘤患者。纳入标准:①患者及家属知情同意;②卵巢肿瘤患者;③扫描后1周内行手术/病理检查获得明确病理结果。排除标准:①检查前接受过放化疗;②扫描序列不完整或图像存在明显运动/金属伪影。符合纳入标准的卵巢恶性肿瘤患者共34例,年龄(59±11)岁;卵巢良性肿瘤患者36例,年龄(56±12)岁。
2.检查方法
采用Discovery MR750 3.0T MR扫描仪和8通道相控阵体线圈对患者进行盆腔MRI扫描。扫描序列轴位T1WI序列(视野36 cm×28 cm,层厚5.0 mm,层间距1.0 mm,矩阵288×256;TR 659 ms,TE minimum),脂肪抑制T2WI序列(TR 2959 ms,TE 68 ms,矩阵,层厚、层间距同T1WI);横轴面单指数模型DWI(b=0、600 s/mm2,NEX 4),横轴面双指数及拉伸指数模型DWI序列(SE-EPI序列,FOV 36 cm×28 cm,层厚5.0 mm,层间距1.0 mm,b=0,20,40,80,160,200,400,600,800,1000 s/mm2,NEX=2、2、2、2、2、4、4、6、6,矩阵288×256,TR 3014 ms,TE minimum)。
3.图像处理及分析
图像后处理方法:将多b值DWI图像传至GE AW 4.6工作站,利用Functool工具包中的MADC软件进行后处理。由1名主治医师和1名副主任医师(分别具有5年及10年临床诊断经验)共同阅片。测量单指数模型参数(ADCstand值)、双指数模型参数(ADCslow、ADCfast和f值)、拉伸指数模型参数(DDC和α 值)。
ROI的选取方法:手动选取ROI,在肿瘤实性部分勾画3个形状、大小近似的ROI,面积为50~200 mm2,获取每个ROI的平均参数值,每位观察者连续测量2次,最终取2次的平均值。参考标准:①选取肿块最大的横断层面,尽量包括肿块DWI明显高信号区域;②ROI边缘与病灶边缘保持一定距离,以避免容积效应;③所有ROI的选择应尽量避开肉眼可见的囊变、出血和坏死区域。
4.统计方法
采用SPSS 21.0统计学软件对数据进行统计分析。采用独立样本t检验比较良性肿瘤组与恶性肿瘤组各参数值的差异;采用Pearson双侧检验法分析良、恶性肿瘤组ADCstand值和其他参数值的相关性 ;采用受试者操作特征(ROC)曲线评价各参数值的诊断效能及最佳诊断阈值,以P<0.05为差异有统计学意义。
结 果
1.病理结果
良性肿瘤36例,包括粘液性囊腺瘤13例,浆液性囊腺瘤9例,成熟性畸胎瘤5例,异位妊娠4例,平滑肌瘤3例,巧克力囊肿2例。恶性肿瘤34例,包括高级别浆液性癌16例,子宫内膜样腺癌6例,恶性畸胎瘤2例,黑色素瘤1例,颗粒细胞瘤1例,浸润性导管癌2例,转移癌6例。
2.恶性肿瘤组和良性肿瘤组各DWI模型的参数
各模型拟合得出的各参数伪彩见图1。恶性肿瘤的ADCstand、ADCslow、DDC和α均低于良性肿瘤(P均<0.05),恶性肿瘤的ADCfast和f值与良性肿瘤差异无统计学意义(表1)。ADCstand、ADCslow、DDC及α值鉴别良、恶性肿瘤的诊断效能及阈值见表2、图2。
卵巢良、恶性肿瘤组中ADCstand与ADCslow、DDC之间呈正相关(r=0.914/0.871、0.923/0.882,P<0.05)。

表1 两组的单、双指数和拉伸指数DWI测量参数结果

表2 单、双指数和拉伸指数DWI参数鉴别卵巢良恶性肿瘤的效能
讨 论
卵巢良、恶性肿瘤之间有很多征象相互重叠[9],但其治疗及预后评估却存在巨大差异。据统计[10],65岁以下女性罹患卵巢恶性肿瘤的风险在发展中国家约为0.36%,发达国家约0.64%。由于早期鉴别诊断方法的特异性有限,约75%的患者确诊时已处于FIGO分期的Ⅲ期或Ⅳ期,失去了最佳治疗机会。因此,卵巢良恶性肿瘤的早期鉴别诊断极为重要。

图1 女,66岁,高级别浆液性癌。a) 横轴面压脂T2WI图示盆腔后部不规则稍高信号肿块; b) b=600s/mm2,DWI图示病变呈高信号; c) ADCstand伪彩图示病变呈绿蓝色混杂信号; d) ADCslow伪彩图示病变呈蓝绿色混杂信号; e) ADCfast伪彩图示病变呈红色信号; f) f伪彩图示病变呈红蓝色混杂信号; g) DDC伪彩图示病变呈深蓝绿色混杂信号; h) α伪彩图示病变呈蓝绿色混杂信号。
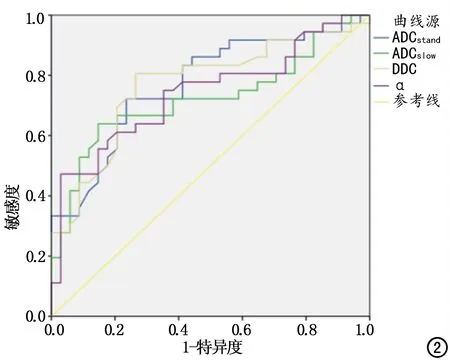
图2 ADCstand、ADCslow、DDC及α鉴别卵巢良、恶性病变的ROC曲线。
DWI技术的出现,在一定程度上缓解了之前仅依靠形态学特征鉴别卵巢良恶性肿瘤的尴尬,它能够通过检测组织中水分子的运动状况来反映组织是否处于异常状态,并通过信号强度和ADC值将组织的异常改变显示出来。通常情况下,恶性病变增殖速度快、细胞密度高,水分子运动受限,在DWI图像上表现出较高的信号强度和较低的ADC值。本研究中,DWI图像卵巢良性病变实性部分信号强度普遍低于恶性病变实性部分,ADCstand值普遍低于恶性病变实性部分,且差异具有统计学意义,与部分研究结果一致[11-12]。但亦有研究表明,包括纤维卵泡膜瘤、退化的纤维瘤[13]等在内的卵巢良性病变也可表现为明显的扩散受限。同时近期有研究发现,由于卵巢肿瘤具有明显的异质性,单指数模型ADC值的测量方法[14]以及ROI的选取方法[15]均可能影响卵巢良恶性肿瘤的鉴别。由此可见,单纯依靠单指数模型DWI对卵巢肿瘤进行定性诊断具有一定的局限性。
组织内水分子的运动情况不仅与细胞密度有关,同时与组织血管化程度即微灌注有关[16],IVIM双指数模型利用不同b值下参与扩散和灌注的质子信号衰减时机不同的原理[17],将灌注信息和扩散信息分离开来,得到反映扩散信息的ADCslow和反映灌注信息的ADCfast、f。本研究中,卵巢良性病变的ADCslow值明显高于恶性病变,推测原因,可能是恶性病变细胞密度较良性病变高,细胞间隙缩小,水分子扩散受限,这与Woo等[18]的研究结果一致。同时,在卵巢良恶性病变组中,ADCslow与ADCstand呈正相关(r=0.914、0.817,P均<0.05),且ADCslow值均明显低于ADCstand值(P<0.05),进一步印证了单指数模型DWI包含微灌注效应,并不能真实反映组织内水分子的扩散受限程度的理论。ADCfast、f均是用于反映组织灌注信息的参数,不同于DCE-MRI以及3D-ASL序列需要外源或内源标记物,IVIM的灌注信息是通过不同运动状态下质子的信号对比获得[17],且低于200s/mm2的b值个数越多,结果越准确[19]。本研究中,卵巢良恶性病变组的ADCfast和f值并无明显差异,这与Gaing等[20]的研究结果略有不同。除可能因为本研究b值选取个数较少外,还可能与恶性病变细胞密度较高、细胞间隙较小、微血管受压进而影响组织灌注水平有关。同时,Sumi等[21]研究表明长T2的组织会低估其ADCfast值,而卵巢良恶性肿瘤中并不乏此类型病变。
IVIM拉伸指数模型摒弃了水分子来源于若干不同区间的观点,力求通过分布扩散系数(distributed diffusion coefficients,DDC)及拉伸因子(α)来反映水分子的整体运动情况和病变成分的复杂程度,其中α 取值范0~1,α越趋向1,病变成分越单一,α愈趋向0,病变成分越复杂。本研究中恶性病变组DDC和α值均低于良性病变组,一方面是因为恶性病变细胞密度大,阻碍了水分子扩散运动;另一方面是由于恶性病变细胞异型性较大且增殖较快,易使自身出现缺血、坏死等改变,进而增加了组织异质性。Liu等[22]的研究显示,前列腺肿瘤的DDC及α值显著低于正常前列腺组织,这与本研究结果一致。同时本研究还进行了DDC与ADCslow、ADCstand相关性分析,结果显示在卵巢良恶性肿瘤组中DDC均与ADCstand、ADCslow显示出良好的正相关(r=0.923/0.882、0.964/0.778,P均<0.05),表明在反映水分子扩散运动方面,三者之间具有一定的一致性。
本研究的局限性:①病例数及病种数较少,后续实验将进行大样本细化研究;②低b值取值及数量的选择有待优化,后续实验将结合更多权威研究成果优化b值选择;③ROI的选择区域较为局限,有可能影响α值的诊断效能,后续实验中将进行扩大ROI选择区域的尝试,力求使结果更加准确。
通过上述讨论分析,可以发现在多模型扩散加权成像中反映水分子扩散信息的参数ADCstand、ADCslow、DDC以及反映组织成分的参数α具有较好的诊断效能,而反映组织灌注信息的ADCfast、f的价值则有待进一步探讨,这在一定程度上说明了细胞密度及组织成分在良、恶性病变诊断中的重要性。在今后的工作中,应继续将上述三种模型联合应用,不仅可以进一步探索ADCfast、f的诊断潜能,更能够从多个角度反映病变组织的水分子扩散运动情况及成分复杂程度,不断提高诊断的准确性。
