海洋弧菌中褐藻胶裂解酶Alg的克隆表达及酶学性质
2018-07-25李云涛汪立平黄宇良
李云涛,张 齐,汪立平,2*,黄宇良
1.上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306
2.上海海洋大学食品学院,食品热加工工程技术研究中心,上海 201306
褐藻作为丰富的海洋藻类资源之一,其年产量仅次于纤维素[1],随着海洋大型野生藻类的培养技术的快速发展,可作为可持续发展资源的应用开发提供保障,具有巨大的经济效益。据报道[2],从马尾藻中可以提取超过30%~35%的褐藻胶,经过降解处理后可产生具有较强的生物活性作用的褐藻寡糖,已经广泛应用于食品保健[3,4],医疗医药[5,6],农业化工[7-10]、生物原料[11]以及饲料添加剂[12]等行业中,具有广阔的应用前景。但是通过传统降解法制备褐藻寡糖具有低效率,反应条件剧烈,易腐蚀设备,造成环境污染,制备的褐藻胶寡糖产量低且对其活性破坏大,同时还会产生盐不利于后面的分离纯化和分析,难以达到工业化生产要求。褐藻胶裂解酶作为褐藻胶降解的关键酶,因其反应条件温和,底物专一性高,反应易于控制,生产效率高,副产物少,对环境友好等优势逐渐成为科研工作者关注的焦点,对多功能的褐藻胶裂解酶的开发具有很高的研究价值。
褐藻胶裂解酶来源广泛,当前的酶主要来源于海洋微生物、土壤微生物、部分海洋动植物以及少量的病毒中,但大部分来源的产褐藻胶裂解酶菌株产酶产酶周期长,含量少,从而无法实现大批量获得褐藻胶裂解酶应用到工业生产中。随着分子生物技术的快速发展,采用基因工程手段及生物信息学手段分析褐藻胶裂解酶蛋白结构特性以便对酶蛋白进行修饰以及将褐藻胶裂解酶基因进行克隆与高效表达,是开发高效褐藻胶裂解酶的有效手段[13,14]。
实验通过研究来源于海洋弧菌Vibriosp.SS-1褐藻胶裂解酶基因Alg在大肠杆菌E.coliBL21(DE5α)中的异源表达,对褐藻胶裂解酶基因推断的重组蛋白分子特性为后续蛋白分子修饰提供理论基础,实验还将得到的纯的重组酶并深入研究酶学性质,从而确定重组酶的有效应用条件,试图探索分子特性与其酶学性质之间的联系,为研究高效褐藻胶裂解酶提供技术支撑。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒 海洋弧菌(Vibriosp.SS-1)菌株:由本实验室从上海市芦潮港水产交易市场(30°51'52.17"N,121°51'26.20"E)购买的鲍鱼肠道中筛选得到并保存;
克隆载体pEASY-T3 Cloning Kit及感受态细胞Trans1-T1(DH5α)购自北京全式金生物技术有限公司;表达载体pET28a(+)、宿主菌株E.coliTop10和表达菌株E.coliBL21(DE5α)由实验室保存。
1.1.2 仪器和试剂 GHP-9080型隔水式恒温培养箱,上海一恒科技有限公司;pHS-3C型pH计,上海精密仪器有限公司;A300型梯度PCR仪,杭州朗基科学仪器有限公司(LongGene);H2050型冷冻离心机,湖南湘仪实验室仪器开发有限公司;UV-2000型紫外分光光度计,美国UNICO公司。限制性内切酶、T4 DNA连接酶、DNA聚合酶购自TaKaRa公司;X-gal、IPTG、氨苄青霉素(Amp)、卡拉霉素(Kan)、蛋白质Maker购自生工生物(上海)工程有限公司;海藻酸钠及其他化学试剂为国产分析纯试剂,购自上海国药集团。
1.1.3 培养基 LB液体培养基(g/L):胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 10.0 g,加蒸馏水至1 L,调节培养基初始pH值至7.2左右。固体培养基添加1.2%~1.5%的琼脂粉。
1.2 实验方法
1.2.1 海洋弧菌总DNA的提取 按照生工生物(上海)技术有限公司提供的细菌总DNA提取试剂盒操作说明,抽提海洋弧菌总DNA,-20℃低温保存备用。
1.2.2 引物设计及海洋弧菌Alg基因的克隆 上游引物序列为Alg-F:5'-GCG AAG CTT TTAATAATT CTC TCAAAC G-3',下游引物序列为Alg-R:5'-CG CCATGG AGG GAT GGAATA GAAATG ATA G-3',其中上下游引物中分别引入HindIII和NcoI作为酶切位点。以海洋弧菌基因总DNA为模板,进行PCR反应,体系为50 μL,设计反应:2*Taq mix 25 μL,总DNA 模板2 μL,Alg-F 2 μL,Alg-R 2 μL,ddH2O 19 μL。反应条件:94℃预变性5 min后,94℃变性30 s,55℃退火30 s,72℃延伸60 s,进行30个循环,最后72℃延伸10 min,将PCR产物-20℃保存并进行琼脂糖凝胶电泳实验验证,割胶回收目的片段。
1.2.3 重组表达载体的构建 将得到的目的Alg基因与表达质粒pET28a(+)同时经HindIII和NcoI双酶切,割胶回收目的片段及酶切质粒,以T4 DNA连接酶进行连接反应,构建重组表达质粒pET28a(+)-Alg,通过热激法(42℃,30 s)转入感受态大肠杆菌TOP10中进行高拷贝复制,提取重组质粒以同样的转化方法转入到表达宿主细胞中构建工程菌株E.coliBL21(DE5α),均匀涂布于含X-gal与IPTG的抗性平板上进行筛选,挑取挑取阳性克隆菌株接种于含Kan(50 μg/mL)的LB液体培养基中培养,进行双酶切鉴定并送生工生物(上海)工程有限公司进行测序。
1.2.4 重组酶的诱导表达及纯化 将含重组质粒的工程菌分别按1%接种量接种于5 mL含50 μg/mL Kan的LB液体培养基中,37℃,180 r/min过夜培养。取2.5 mL过夜培养的菌液转接到250 mL含Kan的LB液体培养基中,37℃,180 r/min培养至OD600约为0.8时,取1 mL菌液做未诱导对照;剩余培养液中加入IPTG至终浓度1 mmol/L,28℃,180 r/min诱导表达6 h,收集发酵液。
将发酵液于4℃,12000 r/min条件下离心30 min,分别收集得到发酵上清及菌体沉淀。上清液经硫酸铵沉淀除去杂蛋白,并通过膜透析除去盐离子,将粗纯化后的发酵上清液A于-20℃保存;所得的菌体沉淀重悬于50 mmol/L的PBS缓冲液中,参照石荣莲等[15]方法,以功率150 W,工作/间隙时间为4 s/8 s超声破碎15 min,破碎液经12000 r/min,4℃条件下离心30 min,分别收集上清B及沉淀C。由于重组的褐藻胶裂解酶蛋白中含有组氨酸标记的His标签,能与Ni-NTAresin柱上的Ni+亲和吸附,利用不同浓度的洗脱缓冲液可将重组褐藻胶裂解酶蛋白进一步纯化,将收集后的蛋白加入到复性缓冲液(50 mmol/L Tris-HCl,pH 8.0,5 mmol/L reduced glutathione,1 mmol/L oxidized glutathione)中进行复性,最后通过膜透析除去盐离子,得到纯度较高的重组酶蛋白,以SDS-PAG凝胶电泳进行分析。
1.2.5 蛋白质含量测定 以牛血清白蛋白配置蛋白标准溶液,采用改良Lowry法[16]蛋白质含量测定。
1.2.6 酶活力的测定 褐藻胶裂解酶能作用于褐藻胶产生不饱和低聚糖醛酸在235 nm条件下有强烈吸收峰,可以依据吸光值大小来确定酶活力[17]。取0.1 mL纯化后的重组酶液与2.9 mL质量浓度0.2%海藻酸钠溶液(0.05 mol/L Tris-HCL缓冲液配置,pH 7.2)混合均匀,30℃水浴反应20 min后,以灭活的重组酶液添加相同体积的反应底物作为空白对照,设置3组平行实验,用紫外分光光度计于235 nm波长条件下测定其吸光值。
酶活定义:1 mL酶液在30℃恒温条件下,每分钟裂解海藻酸钠反应底物,使其吸光度值增加0.01为一个酶活单位(U)。
1.2.7 重组酶的酶学性质研究
1.2.7.1 pH值对重组褐藻胶裂解酶活性的影响 在不同pH反应条件下测定重组褐藻胶裂解酶的活力;将重组褐藻胶裂解酶在相同温度的不同pH值的缓冲液中保温2 h,检测剩余酶活力大小。每组实验均设置3组平行,下同。
1.2.7.2 温度对重组褐藻胶裂解酶活性的影响 在不同温度条件下测定重组褐藻胶裂解酶的酶活力;将重组褐藻胶裂解酶在相同pH值的不同温度下分别保温2 h,检测剩余相对酶活力大小。
1.2.7.3 金属离子对重组褐藻胶裂解酶活性的影响 将不同的金属离子、EDTA及表面活性剂加入纯化的酶液中至终浓度为1 mmol/L,30℃条件下反应20 min,测定其相对酶活力大小。
1.2.7.4 重组褐藻胶裂解酶底物特异性研究 分别取2.9 mL不同酶反应底物(Tris-HCl缓冲液pH 8.6,0.2%褐藻酸钠;0.2%聚甘露糖醛酸与古罗糖醛酸混合片段poly(MG);0.2%聚甘露糖醛酸poly(M);0.2%聚古罗糖醛酸poly(G)于试管中,加入0.1 mL纯化后的重组褐藻胶裂解酶,以高温灭活的酶做空白对照,使总体系为3 mL于30℃水浴反应20 min,在波长235 nm下测定其相对酶活力大小。
1.2.7.5 重组褐藻胶裂解酶动力学研究 取干净的试管中加入0.1 mL纯化后的重组褐藻胶裂解酶液,再分别加入0.9 mL不同浓度(w/v)(0.2%,0.4%,0.6%,0.8%,1.0%,1.2%,1.6%)的褐藻酸钠。于30℃反应20 min,再分别在测定紫外波长235 nm条件下反应前后的吸光值。以反应速率1/[V]作为纵坐标,以底物浓度1/[S]为横坐标作Lineweaver-Burk图。根据双倒数作图法(Lineweaver-Burk),可以通过横截距和纵截距以及曲线斜率求出米氏常数方程Km和Vmax值大小。
1.2.7.6 重组酶对多糖降解产物分析 为了确定重组褐藻胶裂解酶降解产物的组分,将聚甘露糖醛酸poly(M)经过重组酶的充分降解后,通过出去产物中盐离子及杂蛋白,经过低温浓缩干燥溶解于甲醇溶液中,参照Zhu Benwei[18]实验方法,利用电离喷雾质谱(ESI-MS)对降解产物进行分析。
1.3 褐藻胶裂解酶结构特性分析
依照2016年,韩伟等[19]方法,预测重组褐藻胶裂解酶的蛋白质分子量、等电点及氨基酸所占百分比,并在线模拟重组褐藻胶裂解酶蛋白空间结构,对其理化性质的分析提供依据。
2 结 果
2.1 海洋弧菌褐藻胶裂解酶基因Alg的克隆
以海洋弧菌基因组DNA为模板,扩增出海洋弧菌褐藻胶裂解酶基因Alg的全长序列,通过DNA琼脂糖凝胶电泳检测条带大小约为1.1 kb左右。通过送样测序得到基因序列长度1032 bp,与凝胶图像结果相一致(见图1)。

图1 海洋弧菌褐藻胶裂解酶基因Alg的克隆电泳图Fig.1 Clone electrophoretogram of marine vibrio alginate lyase gene Alg
2.2 重组质粒pET28a(+)-Alg的双酶切鉴定
提取工程菌株的质粒DNA,经过HindIII和NcoI双酶切后,将双酶切后的产物进行琼脂糖凝胶电泳,电泳鉴定结果与理论值相符(见图2),测序结果表明插入片段在pET28a(+)中存在正确的开放阅读框,说明表达载体pET28a(+)-Alg成功构建完成。

图2 重组质粒pET28a(+)-Alg的双酶切和PCR鉴定Fig.2 Double-enzyme digestion and PCR identification of recombinant plasmid pET28a()–Alg
2.4 重组褐藻胶裂解酶诱导表达及蛋白纯化
含重组表达质粒pET-28a(+)-Alg的大肠杆菌BL21(DE5α)在37℃,1 mmol/L IPTG诱导培养6 h后,成功表达了重组蛋白Alg。经细胞破碎后通过SDS-PAGE凝胶电泳发现,该蛋白存在与菌体内以包涵体形式存在,通过超声破碎溶解经Ni-NTAresin柱纯化后,得到纯的重组褐藻胶裂解酶蛋白,将所得重组蛋白逐滴加入到10 mL复性缓冲液中使其终浓度为20 μg/mL,并在4℃低温下不停搅拌24 h后,通过膜透析12 h,收集透析后的蛋白液即为纯化后的重组蛋白,用于SDS-PAGE凝胶电泳检测。可以看出重组蛋白分子量大约38.0 kD,与预期的分子量相一致(见图3)。与野生型菌株相比较,重组工程菌E.coliBL21(DE5α)/pET28a(+)-Alg产酶量极大增加,得到的酶蛋白纯度提高了近51.01倍,测定其酶活力达187.5 U/mL,比酶活力为138.9 U/mg,因此也验证了所得的PCR产物为褐藻胶裂解蛋白的成熟编码序列(见表1)。

图3 重组褐藻胶裂解酶的诱导表达和纯化后SDS-PAGE凝胶电泳图Fig.3 Induced expression of recombinant alginate lyase and purified SDS-PAGE gel electrophoretic diagram

表1 重组蛋白分离纯化步骤Table 1 The procedure for recombinant alginate lyase purification
2.5 重组酶的酶学性质研究
2.5.1 重组酶最适反应pH及pH稳定性 在相同温度不同pH条件下,测定重组褐藻胶裂解酶的活力,如图4(A)所示,其最适pH值为8.0左右,适应在偏碱性环境。将重组褐藻胶裂解酶在不同pH缓冲液中进行保温实验,检测剩余酶活力,如图4(B),发现该酶在pH在4.0~9.0之间保温2 h后相对酶活力仍保留在60%以上,具有很强的pH适应性。
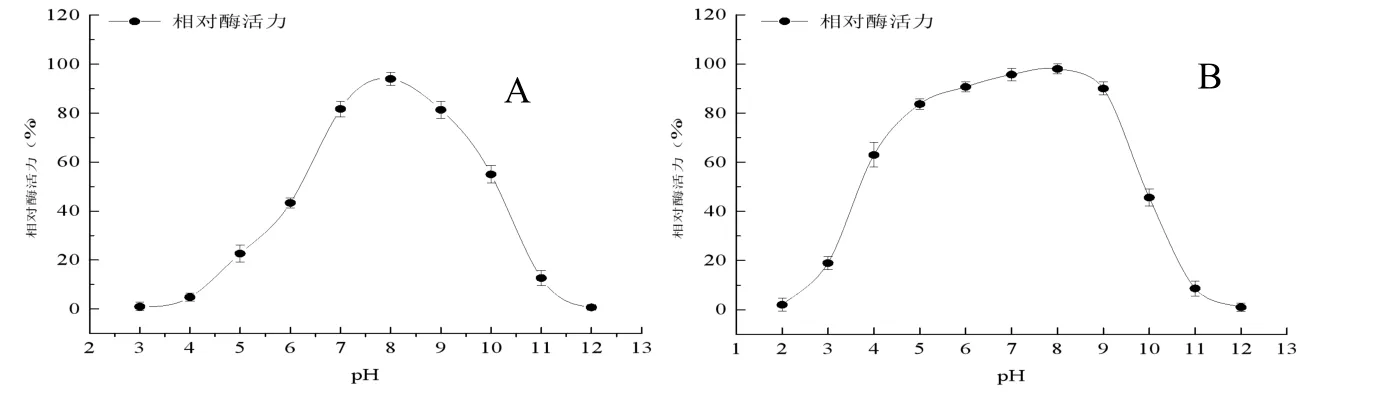
图4 pH值对重组酶活力(A)及稳定性(B)的影响Fig.4 Effect of pH on activity(A)and stability(B)of the recombinant enzyme
2.5.2 重组酶最适反应温度及温度稳定性 在不同温度条件下测定褐藻胶裂解酶活力,发现该酶最适反应温度为30℃,温度在50℃以上,基本丧失了酶活力,实验结果如图5(C)所示。将重组褐藻胶裂解酶分别在不同温度下保温2 h,检测剩余酶活力,结果如图5(D)所示。结果表明重组褐藻胶裂解酶在40℃以上条件下保温,其酶活力急剧下降,损失了60%以上,热稳定性较差。

图5 pH值对重组酶活力(C)及稳定性(D)的影响Fig.5 Effect of pH value on activity(C)and stability(D)the recombinant alginate lyase
2.5.3 金属离子及表面活性剂对重组酶活性的影响 通过测定不同金属离子对重组酶活力的影响。当离子浓度为1 mmol/L时,K+、Na+、Mg2+等离子对重组酶具有明显的促进作用,酶活力提升了近30%;相反Cu2+、Fe3+、Ba2+、Fe2+、Al3+、SDS、EDTA等离子及表面活性剂对重组酶的抑制作用较明显,其中SDS几乎使得重组酶活性丧失(见表2)。
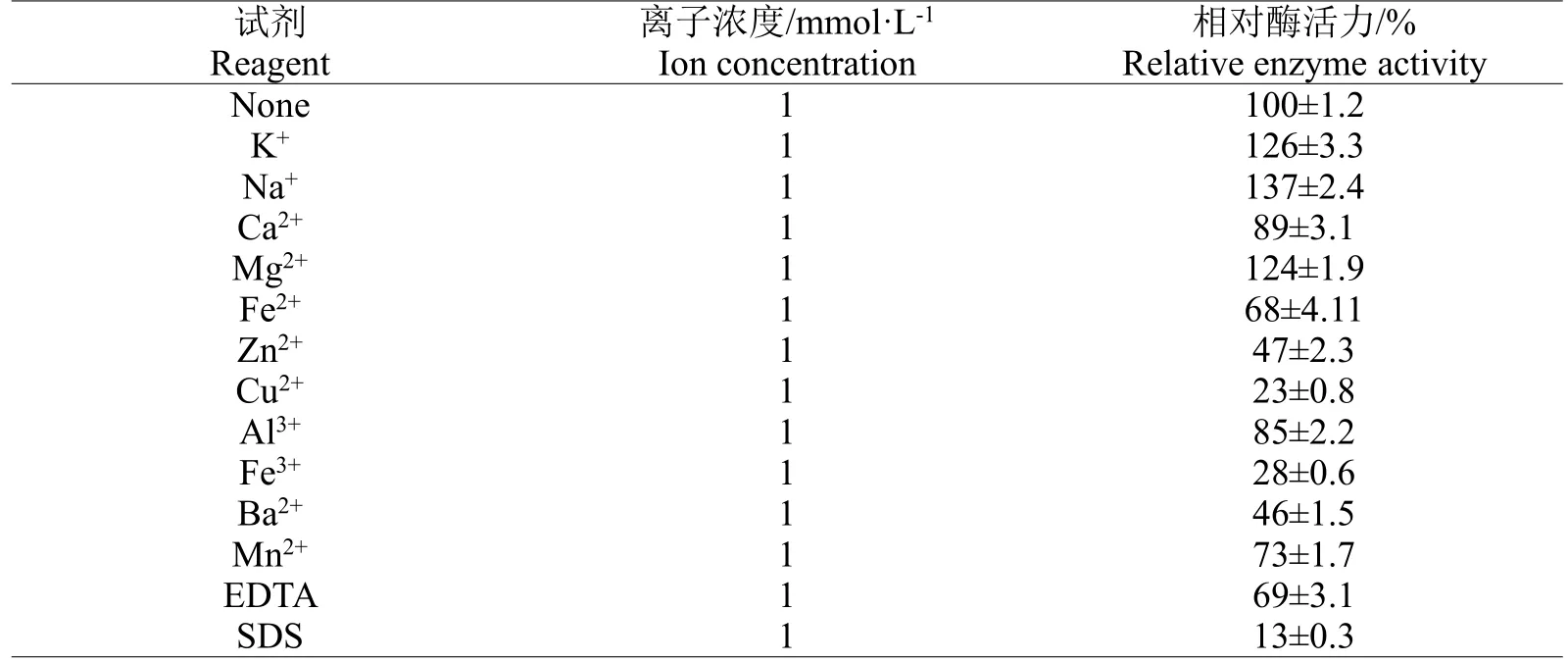
表2 金属离子对重组褐藻胶裂解酶活性的影响Table 2 Effect of metal ions on the activity of recombinant alginate lyase
2.5.4 重组褐藻胶裂解酶底物特异性研究 可以看出重组褐藻胶裂解酶对不同底物的褐藻胶产生褐藻胶寡糖能力有明显的差异性,特别是对聚甘露糖醛酸poly(M)、褐藻酸钠有明显的降解作用,其中对poly(M)底物特异性作用最显著,而在底物为聚古罗糖醛酸poly(G)片段中水解产生寡糖能力较弱,表明该重组酶可以作为一种底物偏好型的双功能酶,应用于寡糖制备工艺中(见表3)。

表3 重组酶的底物特异性研究Table 3 Study on the substrate specificity of recombinant enzyme
2.5.5 重组褐藻胶裂解酶动力学方程 以反应速率1/[V]作为纵坐标,以底物浓度1/[S]为横坐标作Lineweaver-Burk图,通过横截距和纵截距以及曲线斜率测得重组酶米氏常数Km为5.93 mg/mL,Vmax值为 826.44 mg/(mL·min)(见图6)。

图6 重组酶Lineweaver-Burk双倒数图Fig.6 Lineweaver-Burk double reciprocals of recombinase
2.5.6 重组褐藻胶裂解酶对多糖降解产物分析 利用电离喷雾质谱(ESI-MS)进行分析,根据物质的质荷比不同,确定出主要峰值371.69 m/z(DP2)、549.28 m/z(DP3)、734.51 m/z(DP4)和923.59 m/z(DP5)分别对应着不饱和二糖、三糖、四糖和五糖,对于聚甘露糖醛酸poly(M)的降解产物出现的单糖,其中以DP2(二糖)的含量最高,是其重组酶降解的主要产物,可应用于褐藻寡糖的功能性研究(见图7)。
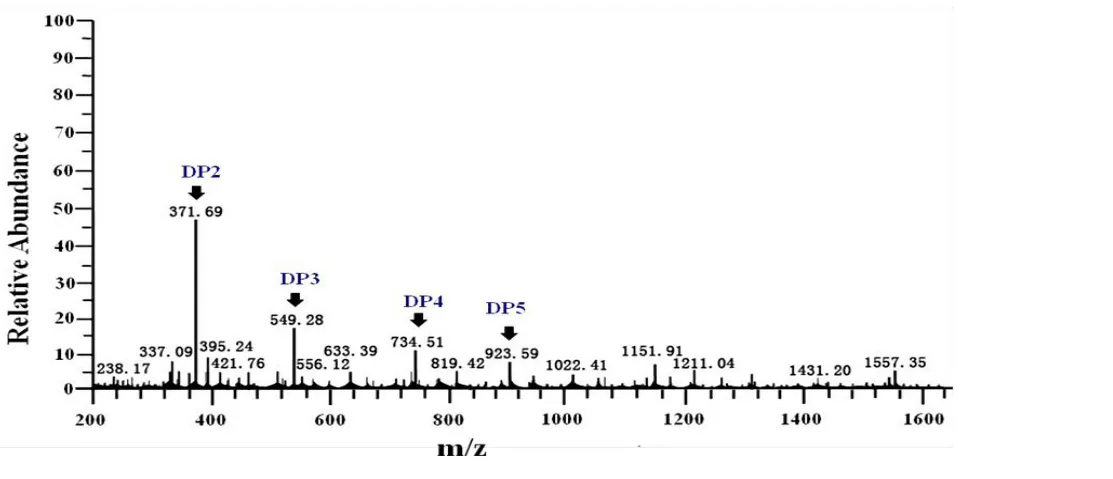
图7 重组褐藻胶裂解酶降解poly(M)的产物ESI-MS分析Fig.7 ESI-MS analysis of poly(M)products degraded by recombinant alginate lyase
2.6 褐藻胶裂解酶蛋白分子分析
采用ProtParam对褐藻胶裂解酶的氨基酸组成及理化性质分析可知,海洋弧菌SS-1褐藻胶裂解酶蛋白的编码氨基酸为344个,分子量约为38.2 kD,等电点pI为5.08,其中带负电荷氨基酸Asp和Glu总个数为51,带正电荷的氨基酸Arg和Lys的总个数为36,各氨基酸含量,由此可以推断该重组酶为一种碱性蛋白酶,这与重组酶理化特性相一致(见表4)。
为了更深入了解重组酶的理化特性,利用SWISS-MODEL在线工具模拟了重组酶的空间三维结构图,以4dvj.1.A为模板,可知该重组蛋白酶为一种同源性为51.08%的低聚集单链蛋白分子,其中由大部分的不规则线性卷曲(约占44%)及少量的α-螺旋(约占27%)和β-折叠(约占27%)相互分散排列,导致重组酶理化性质较差,并由酶学性质进行了验证(见图8)。

表4 推导出的碱性重组酶的各氨基酸含量Table 4 Deduced amino acid content of alkaline recombinase

图8 重组褐藻胶裂解酶的三维模型预测Fig.8 Prediction for recombinant alginate lyase by 3D model
3 讨 论
褐藻胶裂解酶是以海洋褐藻类中所含褐藻胶为底物制备具有多功能活性低聚褐藻寡糖的关键酶,对海藻资源的开发利用及水产养殖业具有很高的经济价值,通过对褐藻胶裂解酶的酶学性质及降解产物深入分析,为实现酶的工业化应用奠定基础。目前,关于实现褐藻胶裂解酶的异源表达的报道较多[14,19-22],与野生型筛选得到的产褐藻胶裂解酶菌株相比,采用基因工程技术手段得到重组菌株在蛋白表达水平及酶分离纯化上均具有绝对的优势。
本文通过双酶切构建重组工程菌株E.coliBL21(DE5α)/pET28a(+)-Alg,纯化倍数达到51.01倍,纯酶回收率近26%,测定其酶活力达187.5 U/mL,比酶活力为138.9 U/mg。与王莹等[23]相比,该在酶活力上具有明显优势,可以很好应用于工业生产。酶学性质研究表明,该重组酶最适反应pH 8.0,为一种碱性蛋白酶,且pH稳定性好,在pH为4.0~9.0范围内能保持较高的酶活力。酶的最适反应温度为30℃,稳定性相对较差,对离子反应敏感。与已报道的重组酶相比[20-21],该重组酶的最适反应温度更低,属于典型低温酶的特点,依据其热不稳定性的特点,在后续工业生产通过高温进行选择性灭活。
通过对重组酶的构效关系研究和降解产物的研究,为实现褐藻胶裂解酶向商业酶转化并大量应用于工业中奠定重要的研究基础。酶动力学方程为褐藻胶裂解酶的酶降解过程提供技术参数。底物特异性表明该重组酶具有有效降解poly(M)的双功能酶,可以有效降解褐藻胶为褐藻寡糖,广泛应用于食品、医疗、水产养殖等行业中。如2016年,潘金路等[12]在饲料中添加褐藻寡糖喂食大菱鲆可以有效改善其肠道杯状细胞,促进肠道脂肪酶活性。2016年,李丽妍等[24]褐藻寡糖能提高小鼠的抗热应激能力,表明褐藻寡糖潜在的应用价值。
随着褐藻胶裂解酶研究的不断深入,更多潜在的价值也会被不断发掘,该研究为褐藻胶裂解酶的酶学性质分析提供了很好的技术基础,为褐藻寡糖的制备提供了好的酶资源。
4 结 论
以产褐藻胶裂解酶的海洋弧菌Vibriosp.SS-1为模板,通过基因工程手段扩增得到褐藻胶裂解酶基因Alg,构建重组工程菌株E.coliBL21(DE5α)/pET28a(+)-Alg,经1 mmol/L浓度的IPTG于37℃诱导表达6 h,能最大量获得重组褐藻胶裂解酶,由Ni-NTAresin柱纯化后,纯化倍数达到51.01倍,纯酶回收率近26%,测定其酶活力达187.5 U/mL,比酶活力为138.9 U/mg。酶学性质研究表明,该重组酶最适反应pH 8.0,为一种碱性蛋白酶,且pH稳定性好,在pH为4.0~9.0范围内能保持较高的酶活力。酶的最适反应温度为30℃,稳定性相对较差,属于典型低温酶的特点。金属离子对重组酶的酶活性影响较大,其中K+、Na+、Mg2+等显示出对重组酶有明显的促进作用,Cu2+、Fe3+、Ba2+、Fe2+、Al3+、SDS、EDTA等离子对该酶抑制作用明显。酶动力学参数Km为5.93 mg/mL,Vmax为826.44 mg/(mL·min);电离喷雾质谱(ESI-MS)分析其降解褐藻胶产物主要为二糖,可用于褐藻寡糖制备。
