湖羊羔皮毛囊候选miRNA在不同花纹间的表达与毛囊发育特性关联的研究
2018-07-25金澄艳吕晓阳高雯王悦陈炜昊盛水兴陈玲林杰孙伟
金澄艳,吕晓阳,高雯,王悦,陈炜昊,盛水兴,陈玲,林杰,孙伟
(1扬州大学动物科学与技术学院,江苏扬州225009;2苏州市畜牧兽医站,江苏苏州215200;3丹阳市皇塘镇动物防疫站,江苏丹阳213027)
0 引言
【研究意义】湖羊是中国独有的白色羔皮羊品种,也是世界著名的多胎绵羊品种。其羔皮呈水波状花纹,色泽洁白、毛质柔软、扑而不散,在国内外裘皮市场享有盛誉。毛囊作为皮肤的衍生物,调节湖羊毛发的生长,可分为生长有髓毛的初级毛囊和生长无髓毛的次级毛囊。毛囊的发育及其再生由多种信号传导途径、转录调节因子和表观遗传调节因子控制[1-3]。miRNA是参与转录后表达水平调节的重要因子,是表型调控的重要潜在位点。目前对 miRNA的功能已有一定的了解,但其在毛囊发育中的作用机制还不完全清楚。研究与毛囊生长发育相关的候选 miRNA可进一步了解湖羊毛囊的生长发育,从分子遗传规律上揭示湖羊羔皮形成不同花纹的分子机理及其调控机制,从而制定提高湖羊羔皮质量的育种方案。【前人研究进展】目前,在绵羊、山羊和鸭等动物上,已有使用皮肤和毛发或毛囊中的 miRNA表达谱来鉴定与毛囊发育和生长相关的miRNA[4-8]。研究发现,一些miRNA能够影响皮肤毛囊细胞的增殖分化及毛色[9],其相关靶基因在调控毛囊周期性生长的过程中充当重要的角色[10-12]。目前,miRNA-143已被发现在多种恶性肿瘤中发挥重要作用,在这些恶性肿瘤细胞中高表达miR-143,细胞生长会受到限制,这也就提示miR-143参与细胞的分化、增殖、凋亡及新陈代谢过程[13-20]。let-7c和let-7i都属于极为重要的抑癌 miRNA的let-7家族,在多种恶性肿瘤中低表达,其可以调控部分与细胞周期相关的基因,参与细胞凋亡过程[21-23]。miR-199a-3p参与细胞的增殖、发育等生物学过程,miR-199a-3p可以抑制癌细胞的生长,减少肿瘤细胞增殖、迁移与侵染[24-28]。此外,miR-199a-3p还参与C2C12成肌细胞的细胞分化[29]。miRNA-10a也参与细胞的增殖、迁移等过程,但与miR-199a-3p抑制肿瘤细胞增殖、迁移、侵染相反,miRNA-10a能够促进肿瘤细胞的增殖、侵袭和迁移[30-31]。【本研究切入点】本课题组前期利用安捷伦基因芯片技术及GO功能分析,筛得初生湖羊大花和小花皮肤组织差异表达基因,如 BMP7、MMP2、SNAI1、SFXN1、CDKNIC、MT3、POU1F1等对湖羊大花、小花性状形成可能具有重要影响的候选基因[32]。基于前期利用高通量测序技术及生物信息学分析筛选湖羊大花、中花、小花羔皮毛囊差异表达miRNA,结果表明miRNA-143、miRNA-10a、let-7c、miRNA-199a-3p、let-7i 、NW_004080189.1_7961、NW_004080184.1_6535、NW_004080184.1_6326、NW_004080165.1_8572、NW_004080166.1_9139、NW_004080181.1_3961、NW_004080174.1_726、NW_004080166.1_10417、NW_004080190.1_13733等候选miRNA可能参与湖羊不同花纹的形成,但尚无这些差异表达 miRNA在湖羊羔皮毛囊中表达值与毛囊发育之间的详细资料。目前关于绵羊毛囊的研究主要集中于生长周期的研究[2],关于miRNA表达与毛囊发育的研究在湖羊这一优质羔皮用羊品种上尚属空白。【拟解决的关键问题】本研究拟通过分析刚出生湖羊大花、中花、小花毛囊发育状况和miRNA-143、miRNA-10a、let-7c、miRNA-199a-3p、let-7i、W_004080189.1_7961、NW_004080184.1_6535等14个候选miRNA表达变化及两者相关性,揭示这14个miRNA在毛囊发育中的作用,筛选候选miRNA,为湖羊优质羔皮的选育提供理论依据。
1 材料与方法
研究于2014年8—12月在扬州大学动物遗传育种与分子设计实验室完成。
1.1 试验群体
选取6组出生2d内的湖羊全同胞个体(由苏州市种羊场提供),每组全同胞个体分别包含大、中、小花各一只。在湖羊羔羊活体状态下,从其背侧部成股拔取羊毛,在距离羊毛根部毛囊泡1cm处用剪刀将羊毛剪断,放入装有Trizol的1.5mL离心管中。一般情况下,每个1.5mL离心管中加入1mL Trizol,毛囊收集至Trizol体积的1/3,并用小型塑料研磨杵在离心管内迅速研磨,一般研磨时间为 1min左右,完成后盖好,用封口膜封好离心管。轻甩离心管使毛囊完全浸入到Trizol液体中,在避光条件下,24h内将装有样品的离心管放入-20℃冻存备用。将羔羊另一侧背侧部剪毛,剪取约1.5 cm2的皮肤组织,并将其展平贴于硬纸板上,连同硬纸板一起放入装有 4%甲醛溶液的离心管中固定备用。
1.2 主要试剂及仪器
miRcute miRNA cDNA 第一链合成试剂盒、miRcute miRNA荧光定量检测试剂盒、ABI 7500荧光定量PCR仪、石蜡切片机、甲醛、苏木素、伊红、中性树脂等。
1.3 石蜡切片的制作
将羔皮皮肤组织按常规石蜡切片制片流程,经脱水、透明、包埋、切片、H.E染色后,在光学显微镜下观察毛囊结构,并利用显微成像系统拍照,每张切片选择3个不同视野,统计初级毛囊数、次级毛囊数、初级毛囊直径、次级毛囊直径,并用SPSS17.0软件进行单因素方差分析(ANOVA),统计分析毛囊各指标在大、中和小花之间的差异显著性。
1.4 Real-time PCR
采用Trizol 法提取样品RNA。利用天根miRcute miRNA cDNA 第一链合成试剂盒生成miRNA对应的cDNA。引物由上海生工合成,引物信息见表1。以U6作为内参基因,采用2-△△Ct方法计算目的基因的相对表达量,反应体系参考天根miRcute miRNA荧光定量检测试剂盒(天根,目录号:FP401)说明书。

表1 荧光定量引物序列Table 1 Relevant information of genes and primers sequence for RT-PCR
1.5 统计分析
试验数据采用 2-ΔΔCt方法计算相对表达量,其中 ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt(大花组、中花组)-ΔCt(小花组),利用 SPSS17.0 计算重复样品间的 Ct均值及标准偏差,采用单因素方差分析(ANOVA)进行差异显著性分析。
2 结果
2.1 湖羊大、中、小花不同花纹羔皮毛囊的组织学观察
湖羊大花、中花和小花羔皮皮肤组织切片显微照片如图1所示,毛囊各指标统计结果如表2。
从图1湖羊大、中和小花毛囊切片照片中可以看出,在大花、中花和小花羔皮毛囊中,直径较大的为初级毛囊,直径相对较小的为次级毛囊,毛囊分布以毛囊群形式为主,即以初级毛囊为中心,次级毛囊围绕在初级毛囊的一侧。
表2毛囊各指标数据显示,在显微镜相同视野中,湖羊大花、中花、小花3种不同类型花纹羔皮的初级毛囊数差异不显著(P>0.05);小花组的次级毛囊数多于大花组和中花组的次级毛囊数且差异极显著(P<0.01),中花组与小花组二者次级毛囊数相仿,差异不显著(P>0.05)。因此,在相同的单位面积中,小花的毛囊总数要高于大花组和中花组。大花组的初级毛囊直径比中花组和小花组的初级毛囊直径要大的多,与中花组和小花组的初级毛囊直径均差异极显著(P<0.01),大花组的次级毛囊直径也比中花组和小花组的次级毛囊直径大,同时二者差异极显著(P<0.01),中花组和小花组二者的初级毛囊直径以及次级毛囊直径均差异不显著(P>0.05)。
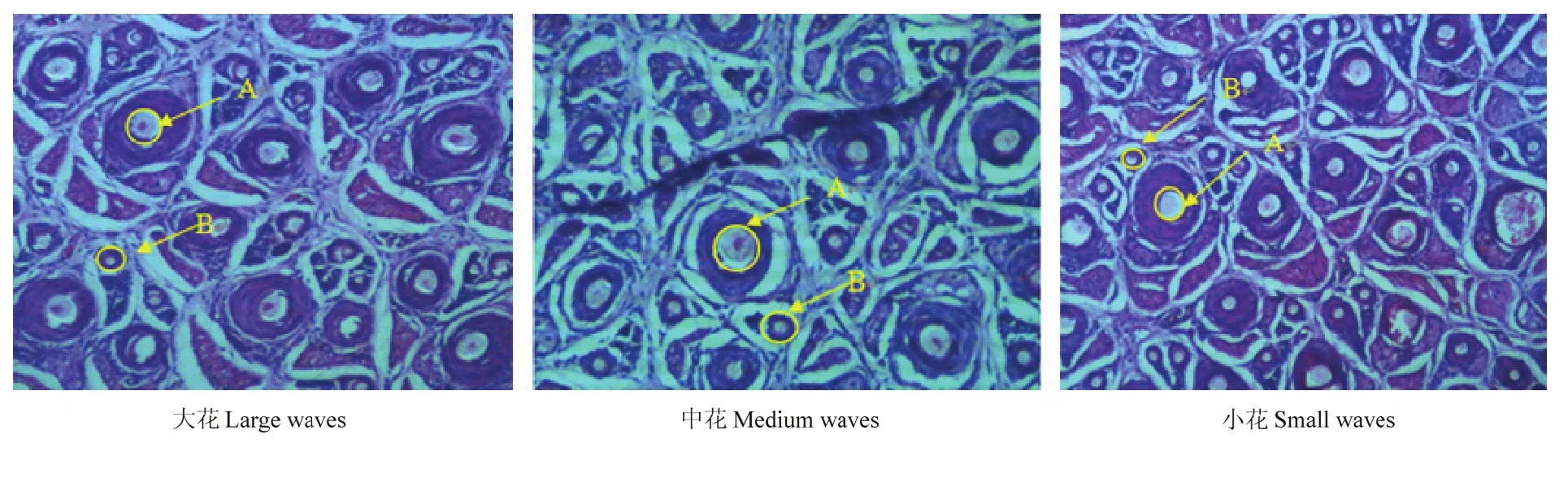
图1 湖羊大花、中花、小花毛囊横切图Fig. 1 Transverse section images of large, medium and small waves(100×)
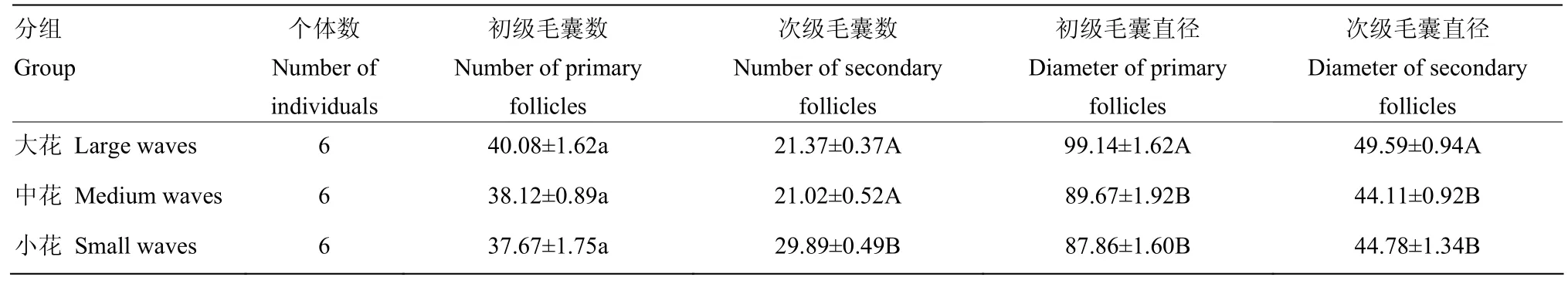
表2 湖羊大、中、小花毛囊各指标测定Table 2 Determination indexes of large, medium and small waves
2.2 实时荧光定量PCR结果
为验证测序数据的可靠性,本研究从测序筛选出的显著差异miRNA中随机选取了5个,利用与测序送样相同的样品进行了荧光定量 PCR验证。测序结果与差异表达的miRNA的RT-PCR基本相同(表3)。
2.3 14个差异miRNA在大花、中花和小花羔皮毛囊中的表达
由表4可知,在已知的miRNA中,miRNA-143在大花组中的表达量与小花组差异极显著(P<0.01),miRNA-10a在小花组的表达量与大花和中花组相比差异显著(P<0.05),let-7i在大花组的表达量与中花组差异显著(P<0.05);在测序新预测的差异miRNA中, NW_004080184.1_6326在中花组的表达量与大花组差异显著(P<0.05),与小花组差异极显著(P<0.01),NW_004080165.1_8572在中花组的表达量与大花组和小花组差异极显著(P<0.01),NW_004080181.1_3961在中花组的表达量与小花组差异极显著(P<0.01),NW_004080190.1_13733在中花组的表达量与大花组差异极显著(P<0.01)。其余miRNA在大、中和小花中的表达差异不显著。
2.4 14个差异miRNA荧光定量表达值与毛囊各指标的相关分析
根据6组湖羊(大花组、中花组和小花组)背侧部皮肤组织切片各指标统计结果及14个miRNA在3组花型中的表达情况,利用SPSS17.0软件进行相关性分析,分别计算14个miRNA与3组不同花纹毛囊指标的相关系数,分析14个miRNA表达情况与毛囊各指标的相关性。分析结果如表5所示:14个 miRNA的相对表达量均与毛囊部分指标存在相关性,表明14个miRNA均有可能参与毛囊的生长发育。通过使用SPSS 17.0分析了14种miRNA的表达与毛囊各组织学性质之间的关联,表明它们参与毛囊的生长和发育。

表3 差异miRNA的测序与荧光定量Table 3 The companions on the results of sequencing and RT PCR for differentially expressed miRNA
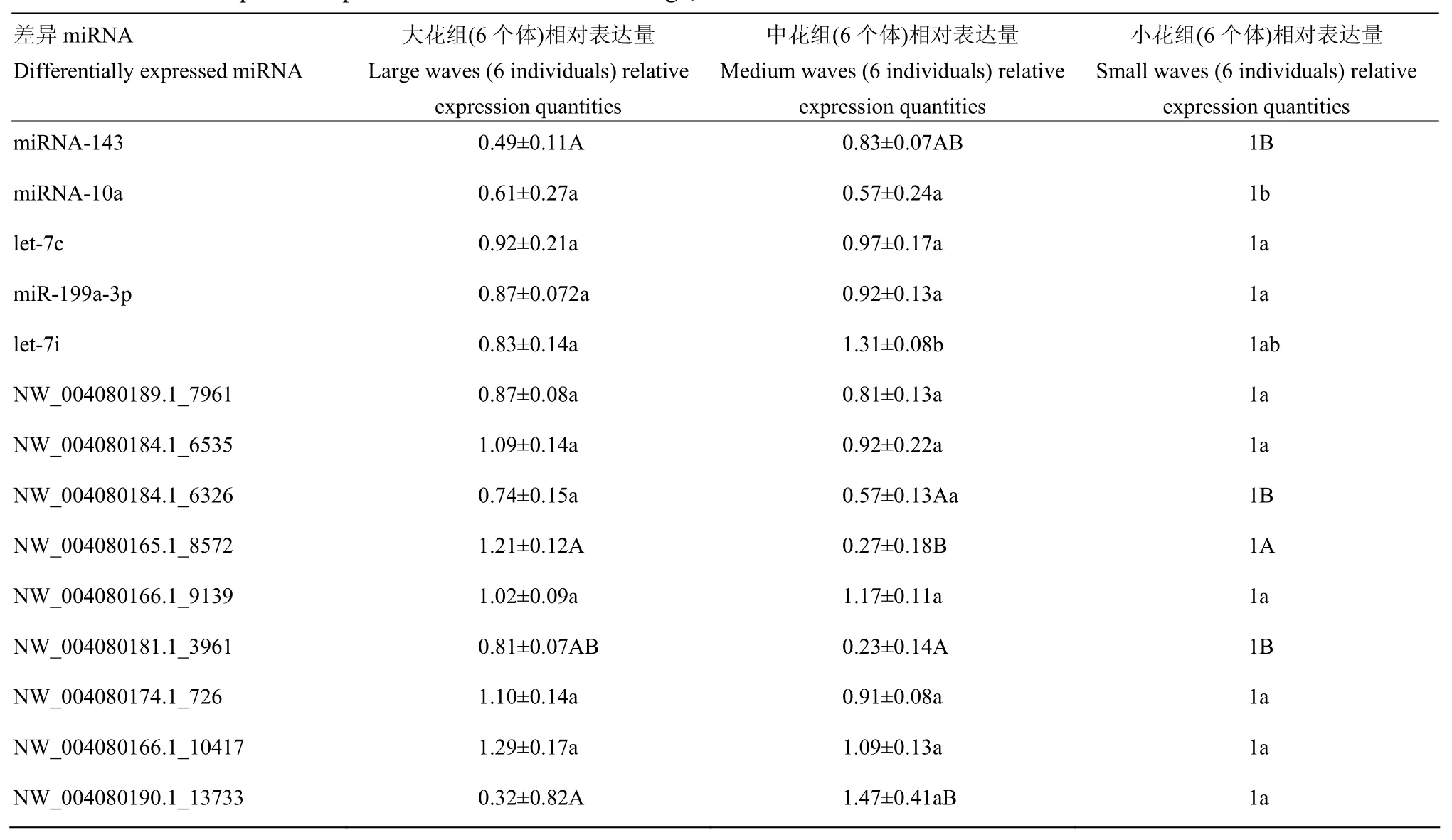
表4 大花、中花、小花毛囊14个miRNA相对表达量Table 4 Relative expression quantities of 14 miRNAs in large, medium and small waves hair follicle
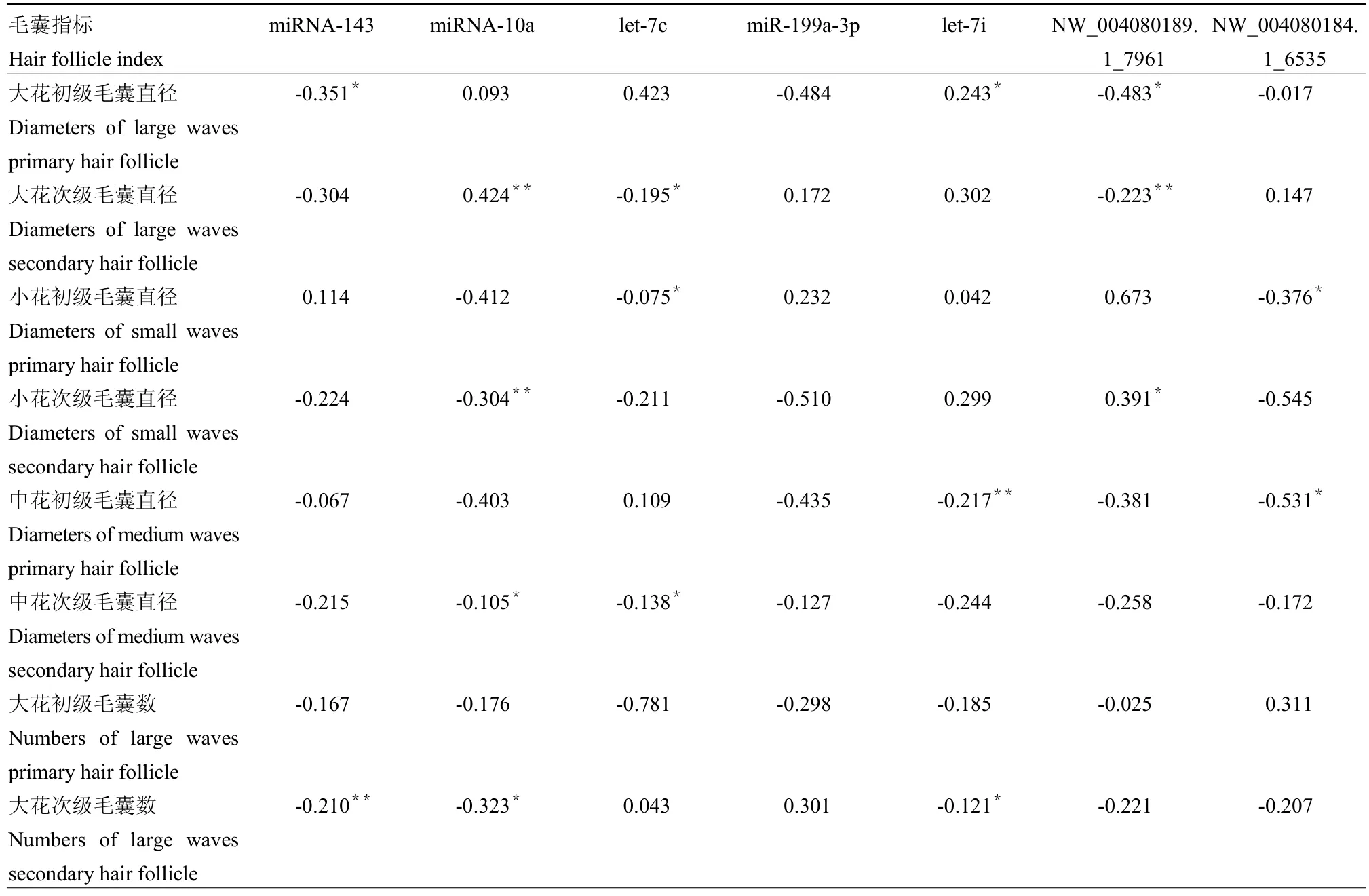
表5 14个miRNA相对表达量与毛囊组织学特性关联分析Table 5 Correlation between the expressed miRNA and the indicators follicles

续表5 Continued table 5
3 讨论
3.1 14个miRNA在湖羊大、中和小不同花纹个体间的表达
在这些miRNA中,miRNA-143作为测序所筛得的湖羊毛囊组织表达丰度较高的 miRNA之一,在本研究的结果中显示,miRNA-143同一时期在小花中的表达量远高于大花和中花,且在大花和小花羔皮毛囊中的表达量差异极显著。由此可推测,miRNA-143很可能参与毛囊细胞的发育过程,参与被毛生长的调控。但是,关于miRNA-143在动物毛囊领域的研究尚未有相关报道,以前的研究表明,miRNA-143在各种恶性肿瘤中起重要作用[33-34]。据报道,miRNA-143在膀胱癌[16]、前列腺癌[18]、乳腺癌[19]和胃癌[20]中表达下调,在这些恶性肿瘤中,miR-143的表达上调抑制了细胞的生长。
miRNA-10a以及let-7i两个miRNA的研究目前也主要集中于肿瘤方面,在动物毛囊领域也尚无报道。miRNA-10a在肿瘤中的作用主要体现在它能促进肿瘤细胞的增殖和分化过程[30-31],这一点与let-7i正好相反,let-7i作为重要的抑癌miRNA家族let7家族的一员,它在肿瘤细胞中低表达,参与细胞凋亡过程[22-23]。本研究结果显示,miRNA-10a和let-7i分别在湖羊中花与小花、大花与中花中的表达量差异显著,由此推测,miRNA-10a和let-7i在不同花纹羔皮毛囊中的差异表达可能会对湖羊毛囊的生长发育产生影响。
在新miRNA中,NW_004080184.1_6326在小花与大花中的表达量高于中花,且小花组的表达量与中花组差异极显著,NW_004080165.1_8572在大花与小花中的表达量高于中花组且均与中花组差异极显著,NW_004080181.1_3961和NW_004080190.1_13733分别在中花和小花组、大花和中花组差异极显著。这些通过测序得到的新的 miRNA在湖羊不同花纹羔皮毛囊中的差异表达,也很可能在羔皮花纹的形成过程中发挥重要作用,这也需要后续实验的进一步验证。此外,其余的7个miRNA在大、中、小花3组的表达差异均不显著,暂时不列入候选miRNA的选择范围。因此,可初步推测miRNA-143、miRNA-10a、let-7i、NW_004080184.1_6326、NW_004080165.1_8572、NW_004080181.1_3961、NW_004080190.1_13733 等7个 miRNA可以作为参与湖羊毛囊发育调控的候选miRNA。
3.2 14个miRNA在湖羊不同花纹羔皮毛囊中的表达与毛囊各指标之间的相关分析
目前,通过对人类以及模式动物如小鼠等miRNA的研究已证实,miRNA在脑、心脏、肝脏、皮肤等各种组织及器官的发育过程中起重要的调节作用[35-39],而且 miRNA的表达还呈现出不同发育阶段特异性表达和组织特异性表达的特点。当前对于皮肤及毛囊的研究表明,miRNA参与多种动物表皮的发生及毛囊的生长发育过程。ANDL等进一步研究表明,miRNA在毛囊周期性生长的不同时期的表达存在差异性,miRNA是调控皮肤和毛囊生长发育过程的重要因子[40]。关于 miRNA-143在动物毛囊领域的研究目前还尚未有相关报道,miRNA-143主要在多种恶性肿瘤中发挥重要作用,参与细胞增殖、侵袭、转移等过程的调控。本研究结果表明,在miRNA-143表达量相同的情况下,小花次级毛囊数大于大花次级毛囊数,这与切片结果相符,结合miRNA-143在大花、中花和小花间表达差异研究初步推测,miRNA-143可能对湖羊毛囊发育起调控作用。
目前关于miRNA-10a和let-7i也尚无毛囊生长发育方面的研究,本研究结果显示,在miRNA-10a表达量相同的情况下,大花初级毛囊直径大于小花次级毛囊直径,大花次级毛囊数小于中花和小花的次级毛囊数,这些结果与切片数据相吻合。此外,在let-7i表达量相同的情况下,结果显示大花次级毛囊数小于中花次级毛囊数,而在切片结果中,大花的次级毛囊数和中花的次级毛囊数接近,差异并不显著,因此在这一点与切片数据稍有出入;出现此情况可能是由于样本量不足导致的,因为本试验的研究对象为湖羊大、中和小花不同花纹的全同胞个体,此类全同胞个体较为稀少。但在let-7i表达量相同的情况下,大花初级毛囊直径大于中花初级毛囊直径,这一结果还是符合切片结果的。因此,这些相关性分析结果与相应的切片数据基本吻合。此外,在所筛得的新miRNA中,NW_004080184.1_6326、NW_004080165.1_8572、NW_004080181.1_3961以及 NW_004080190.1_13733等在大、中和小花组的表达量也分别与大花次级毛囊直径、小花次级毛囊数和中花次级毛囊直径等指标存在相关性,且分析结果也与切片数据相符合。其余的miRNA虽然与毛囊的相关指标也存在关联性,但鉴于其在大、中和小花组的表达差异不显著,可将其排除在候选miRNA的选择范围之外。
4 结论
综合14个miRNA在大花、中花和小花毛囊中的表达情况以及表达值与毛囊各指标的相关性分析,miRNA-143、miRNA-10a、let-7i、NW_004080184.1_6326、NW_004080165.1_8572、NW_004080181.1_3961和NW_004080190.1_13733可以作为湖羊羔皮毛囊发育的重要候选miRNA,在后续试验中将进行更深入的研究。
