栀子花中栀子苷的提取与测定*
2018-07-25朱慧慧
朱慧慧 白 岩
1 浙江省湖州市南浔区中医院 浙江 湖州 313009
2 浙江农林大学 浙江 临安 311300
栀子来源于茜草科Rubiaceae植物栀子Gar denia j asminoides El l is的干燥成熟果实,其性寒味苦,入心、肝、肺、胃经。目前对栀子的研究比较成熟,但对栀子花的研究却甚少,偶有学者涉及[1]。本试验旨在分析不同采摘时期和炮制方法对含量测定的影响,从而确定最佳采摘时期和最佳炮制方法的最优组合,为栀子花药材质量控制提供依据。
1 仪器与材料
1.1 仪器:Water s 600高效液相色谱仪;精密分析天平(FA2104N);无级可调台式超声清洗器(SK8200HP);超纯水器(Mil l ipor e Simpl icit y型);循环水式多用真空泵(SHB-IIIA河南省太康科教器材厂)。
1.2 试剂:甲醇(一级色谱纯,天津市四友精细化学品有限公司);栀子苷对照品(纯度≥98%,上海同田生物制品有限公司,序列号为4866/2010);超纯水为实验室自制。
1.3 材料:以不同采摘时期的栀子花和蕾作为原料,采用不同的炮制方法对原料进行处理,粉碎,待用。花1:花盛开,花色洁白;花2:花近开败,颜色发黄;蕾1:蕾长约5cm,花瓣紧卷,顶部绿色;蕾2:蕾长约6cm,花瓣略松,近开放。
2 方法与结果
2.1 色谱条件:色谱柱(shimpack HRC-ODS分析柱4.6mm×250mm,5μm);流动相:甲醇∶水=30∶70(v/v);流速:1ml/min;柱温:25℃;检测波长:240nm;进样量:10µl。
2.2 溶液制备:具体如下。
2.2.1 对照品溶液制备:精密称取栀子苷对照品2.4mg(精确到0.01mg)置10ml容量瓶中,加甲醇-水(1∶1,v/v)至刻度,摇匀,配成栀子苷含量为240μg/ml的储备液。取一定量的储备液,用甲醇-水(1∶1,v/v)稀释成浓度为30、60、120、240μg/ml的标准溶液,备用。
2.2.2 供试品溶液制备:将栀子花细粉过四号筛,精密称取1g,精确到0.0001g,置50ml容量瓶中,采用甲醇-水(1∶1,v/v)作为提取溶剂,本试验采用段起[2]等人在测定栀子苷时使用的方法,按照超声提取技术进行提取,提取时间为1h,功率为250w。再加甲醇-水同浓度的定容至50ml,摇匀。按上述方法将每种栀子花分别提取后,待用。将提取溶液分别抽滤,取滤液经0.45μm微孔滤膜再次过滤,取1ml滤液用甲醇-水(1∶1,v/v)定容至25ml,作为栀子花供试品溶液[3]。
2.3 方法学考察:具体如下。
2.3.1 线性关系考察:精密称取栀子苷对照品2.4mg,精确到0.01mg,置10ml容量瓶中,加甲醇-水(1∶1,v/v)至刻度,摇匀,配成栀子苷含量为240μg/ml的储备液。取一定量的储备液,用甲醇-水(1∶1,v/v)稀释成浓度为120、150、180、210、240μg/ml的标准溶液。分别吸取不同浓度的对照品10µl,注入高效液相色谱仪,按色谱条件测定对照品峰面积,计算回归方程。结果显示:回归方程为Y=198.57x+868.13,r2=0.9973。表明栀子苷对照品溶液在0~240µg/ml浓度范围内与峰面积呈良好的线性关系。标准曲线如图1所示。

图1 栀子苷标准曲线
2.3.2 精密度试验:取标准品溶液,按照优化色谱条件,重复进样6次,测定结果。经测定计算,得栀子苷平均峰面积积分值的RSD为1.2%。精密度良好。
2.3.3 稳定性试验:取供试品溶液,按照“2.1”色谱条件,分别准确吸取10μl样品液,在建立的色谱分析条件下每1h进样1次,共5次,分析测定栀子苷含量。测定栀子苷平均峰面积积分值的RSD为2.6%。结果表明,采用超声方法制备的供试品溶液中栀子苷在5h内稳定。2.3.4 重复性试验:取同一批栀子药材,分别制备6份供试品溶液,在建立的色谱分析条件下分别进样10μl,分析结果。测得栀子苷平均含量为2.47%,RSD为2.8%,结果表明方法重复性较好。
2.3.5 回收率试验:精密称定已知含量栀子果药材粉末0.1g各5份,分别精密加入浓度为0.2543mg/ml的对照品溶液10ml,再分别精密加入40ml的30%甲醇。按“2.2.2”项下方法制备供试品溶液,取10μl在上述色谱条件下测定栀子苷的含量,分析结果。结果表明该方法的回收率良好,见表1。
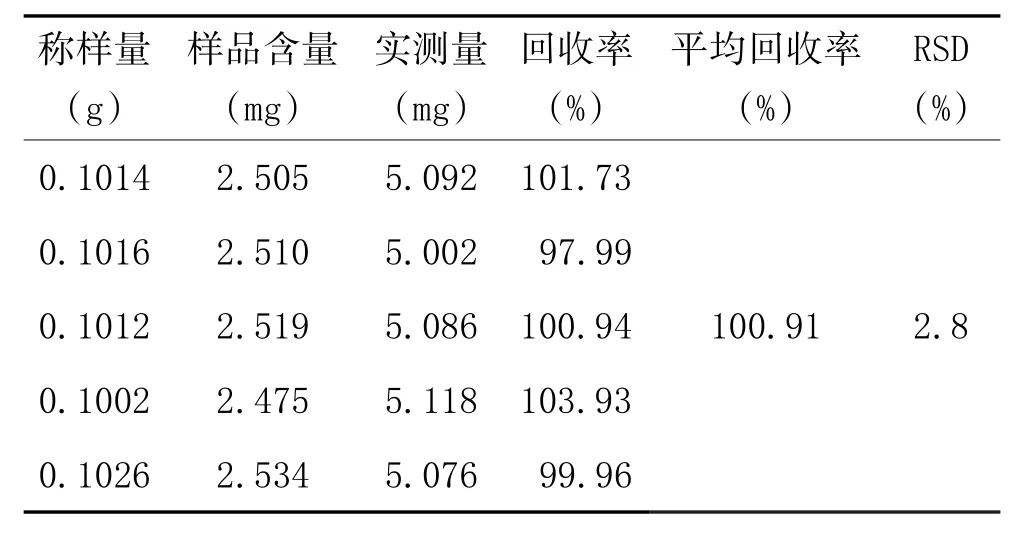
表1 栀子花中栀子苷含量测定加样回收率试验结果
2.4 样品测定:按“2.1”色谱条件测定,每个时期不同炮制方法的样品进样3次,求其平均值,记录数据。花1含量平均值:晒干7.4%,直接烘干9.4%,先烫后烘9.9%,先蒸后烘10.2%,炒干7.5%,总平均值8.9%;花2含量平均值:晒干6.6%,直接烘干4.1%,先烫后烘8.2%,先蒸后烘7.1%,炒干6.3%,总平均值6.5%;蕾1含量平均值:晒干3.6%,直接烘干7.4%,先烫后烘7.9%,先蒸后烘8.7%,炒干6.5%,总平均值6.8%;蕾2含量平均值:晒干4.9%,直接烘干8.2%,先烫后烘9.0%,先蒸后烘9.7%,炒干6.6%,总平均值7.7%。不同时期栀子苷含量:花1>蕾2>蕾1>花2。不同炮制方法栀子苷含量:先蒸后烘>先烫后烘>直接烘干>炒干>晒干。
3 讨论
3.1 不同采摘时期对栀子苷影响:栀子花在花盛开、花色洁白时采摘,其中的栀子苷含量最高,由于栀子苷是一种次级衍生物,是由光合作用生成葡萄糖,然后经一系列反应生成栀子苷[4]。根据“源-库”理论[4],栀子在蕾期和花期,花和蕾为最重要的库,所以光合产物向花和蕾运输的量在不断增加,因此栀子苷含量随着花朵的盛开也在增加。在花近开败时,一方面,通过双受精已经逐渐形成的幼栀子果成为更为强势的库,光合产物向幼果运输;另一方面,栀子苷有可能随着花朵的开败而降解,因此栀子花中的栀子苷含量明显降低。
3.2 不同炮制方法对栀子苷影响:栀子苷为环烯醚萜类物质,易水解,生成栀子苷元,生成的苷元很不稳定,易发生聚合反应[5-6]。栀子花采用先蒸后烘、先烫后烘的炮制方法,高温使栀子花中的栀子苷水解酶破坏,经过这样的处理,栀子苷在烘干的过程中不易被破坏,所以先蒸后烘和先烫后烘的栀子花中栀子苷的含量较高。另外,通过短时间的蒸制,内部水分外逸,需要烘制的时间就少,栀子苷破坏的就少,所以含量较高。而先烫后烘会使一小部分栀子苷溶于水中而丢失,所以先烫后烘的炮制方法得到的栀子花中的栀子苷含量略低于先蒸后烘的。由于直接烘干的温度较低且时间较长,酶被破坏失活的时间也较长,栀子苷被酶解的时间较长,所以直接烘干的栀子花中栀子苷含量较低;而炒干的温度过高,栀子苷极易被破坏,所以炒干中栀子苷含量也较低;栀子花通过晒干得到,因为当时气温较低,又正值梅雨季节,所以需要晒干的时间较长,长期暴露在空气中可能会使栀子苷大量水解和丢失,导致此种方法得到的栀子花中栀子苷含量最低。
3.3 栀子果与栀子花中栀子苷含量比较:本次试验测出,栀子花中栀子苷的含量在4%~10%之间,而段起[2]等人测出栀子果实中栀子苷的含量只有2%~4%之间,可以看出栀子花中栀子苷的含量明显较高。在以往用药习惯中只以栀子果实入药,通过本次试验可以看出栀子花中的栀子苷含量更高,在今后可以多关注栀子花的开发与利用。根据“源-库”理论,栀子通过疏花,还可以提高栀子果的外观形状和内在品质,如大小、颜色以及成分含量等。疏下来的栀子花也可以进行再利用。为栀子药材质量控制提供一定的依据。
此次试验证明栀子花中含有栀子苷成分,在花盛开,花色洁白时采摘,并采用先蒸后烘的炮制方法栀子苷含量最高,且栀子花中的栀子苷含量要高于栀子果实中的。
