固定化脂肪酶ANL非水催化合成L-抗坏血酸棕榈酸酯
2018-07-24徐文婷毕武丹丛方地于琬琪张树林
徐文婷,毕武丹,丛方地,,于琬琪,张树林,杨 薇,罗 巍
(1.天津农学院 基础科学学院 生物制药系,天津 300384;2.天津农学院 水产生态及养殖重点实验室,天津 300384)
L-抗坏血酸(Vc),是一种天然活性成分,是较强的抗氧化剂之一,对环境无毒无害,易被人体消化吸收,广泛用在医药、食品和化妆品等行业[1]。它不溶于脂质,稳定性差。然而,Vc酯化后,形成Vc脂肪酸酯,不但具有脂溶性[2],而且抗氧化性和稳定性也显著提高[3],另外还有抗癌作用[4],是世界上公认的安全无害的营养添加剂[5]。
Vc酯的制备通常有化学合成法和生物酶催化合成法[6]。化学合成中,化学催化剂常带入有毒物质,需高温、高压条件,伴有副反应发生及毒副性产物和非自然异构体产生,还会严重污染环境[7-8]。酶法合成是利用脂肪酶,在有机溶剂中催化Vc与脂肪酸或其酯发生酯化或酯交换反应生成Vc脂肪酸酯,具有环境友好、催化效率高、副反应少、对设备要求不高、产品下游分离比较容易等优点[4,9]。但脂肪酶在有机相中不稳定,容易变性失活,且用于合成Vc酯的酶促反应温度通常高于50 ℃,此外,因反应体系中使用了过量的脂肪酸,容易影响产物的提纯及收率[4-6]。为提高酶非水相催化作用,通常制备固定化酶或酶生物反应器,以提高其非水催化能力[10],其理论依据为脂肪酶的界面活化机制,即在水/油(有机相)上,水相优化稳定化酶蛋白,有机相激活酶活性中心[11]。对于酶促合成Vc酯的研究,已取得了一定的进展[5-10],但在提高酶活性、产物提纯和降低催化温度等方面,还有待进一步的研究。
为此,本文中,笔者以界面活化机制为基础,选择玻璃器壁和脱脂棉为载体,将黑曲霉菌脂肪酶Aspergillusnigerlipase(ANL)分别固定在器壁和脱脂棉纤维上,制备出固定化酶(器壁-ANL和脱脂棉-ANL),并用于催化Vc与棕榈酸发生酯化反应,研究酶促合成Vc棕榈酸酯的效果。
1 材料与方法
1.1 试剂与仪器
黑曲霉脂肪酶(ANL,12 000 U/g,源于黑曲霉菌Aspergillusniger),杭州创科生物科技有限公司;Vc、棕榈酸、甲醇,市售分析纯;高效液相色谱仪(HPLC,Agilent 1260 Infinity),装配HyPURITY -C18柱;HNY-100B型恒温振荡培养器,天津市欧诺仪器仪表有限公司。
1.2 HPLC分析方法
取反应液2 μL,置于2 mL离心管内,敞口放置10 min。使溶剂丙酮挥发完全后加入1 mL流动相,溶解,过滤膜(0.22 μm),HPLC分析。叔丁醇作溶剂时,取样后直接用流动相稀释,过滤膜,进行HPLC分析。检测波长254 nm,流速设为1.0 mL/min,进样量20 μL。测得的Vc积分面积(S0)和Vc棕榈酸酯积分面积(S1)用于计算反应的摩尔转化率(c),c=[S1/(S0+S1)]×100%。
1.3 ANL 固定化
称10 mg ANL酶粉,加入10 mL棕色玻璃瓶中,再加0.2 mL蒸馏水,轻轻摇动,使ANL溶解。将玻璃瓶敞口,在160 r/min、37 ℃条件下保持8 h,得器壁-ANL。2 g脱脂棉先在100 mL乙醇中分别浸泡2次,每次24 h,取出后,待乙醇挥发完,取10 mg脱脂棉加入上述含ANL酶溶液的玻璃瓶中,充分吸附酶溶液,在上述同样条件下固定化,后用镊子将脱脂棉拉至蓬松,得脱脂棉-ANL。
1.4 丙酮中酶催化
称0.01 g Vc,加入50 mL棕色容量瓶中,分次加丙酮,并振荡,直至Vc全溶,定容至刻度,Vc质量浓度为0.2 mg/mL。称0.262 g棕榈酸加入100 mL容量瓶中,加丙酮,振荡,至固体全溶,定容至刻度,溶液质量浓度为2.62 mg/mL。在含有ANL酶粉、器壁-ANL或脱脂棉-ANL的棕色瓶中(ANL质量均为10 mg,下同),加入上述Vc-丙酮溶液3 mL和棕榈酸-丙酮溶液1 mL(Vc和棕榈酸的摩尔比为1∶ 3),盖盖,并用封口膜封口,在160 r/min、37 ℃下反应,按设定时间取样分析。
1.5 叔丁醇中酶催化
在含器壁-ANL或脱脂棉-ANL的棕色瓶中,加入0.04 g Vc和0.18 g棕榈酸(Vc和棕榈酸的摩尔比约为1∶ 3),再加入4 mL叔丁醇,盖盖,并用封口膜封口,在160 r/min、37 ℃下反应24 h。按时取样分析。
1.6 底物等摩尔比的反应
在含器壁-ANL或脱脂棉-ANL的棕色瓶中,加入0.2 mg/mL的Vc-丙酮溶液3 mL和2.62 mg/mL的棕榈酸-丙酮溶液0.33 mL(Vc和棕榈酸的摩尔比为1∶ 1),盖盖,并用封口膜封口,在160 r/min、37 ℃下反应24 h。按时取样分析。
2 结果与讨论
2.1 反应体系的HPLC分析结果
由于ANL酶的选择性[12],酶促酯化反应在Vc的C6-羟基上优先进行(图1)。Vc在254 nm处有特征吸收[13],以甲醇、水和微量冰醋酸组成流动相,在不同体积配比下,分析反应体系的组分。图2为两种固定化酶反应1 h后Vc和Vc棕榈酸酯的HPLC分析图。从保留时间、峰分离度及峰形等综合考虑,最佳的流动相配比为V(甲醇)∶V(水)∶V(冰乙酸)=75∶ 25∶ 0.1,Vc和Vc棕榈酸酯的保留时间分别为3.17和4.02 min。
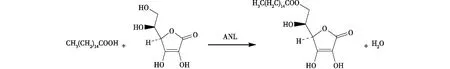
图1 酶促合成Vc棕榈酸酯Fig.1 Enzymatic synthesis of Vc palmitate
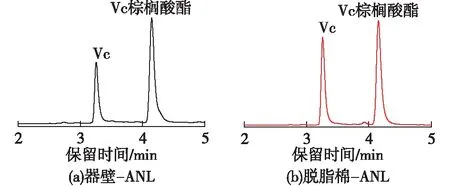
图2 酶促反应1 h后Vc和Vc棕榈酸酯的HPLCFig.2 HPLC of Vc and Vc palmitate after enzymatic reaction for 1 h
2.2 ANL酶促酯化反应
为研究固定化酶的催化反应动力学,分别使用器壁-ANL和脱脂棉-ANL为催化剂,丙酮为溶剂,Vc与棕榈酸的摩尔比为1∶ 3[14]。在较温和的条件(37 ℃、160 r/min)下进行催化反应,反应动力学见图3。
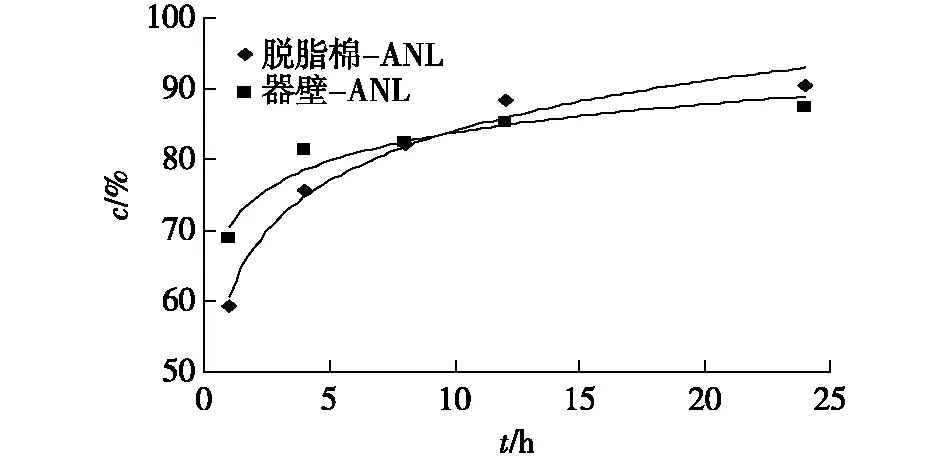
图3 固定化ANL催化酯化动力学Fig.3 Kinetics of esterification catalyzed by immobilized ANL
由图3可知:在开始阶段,两种固定化酶的催化活性相近,但器壁-ANL活性较高;1 h后,器壁-ANL转化的底物相对较多;8 h后,相对于脱脂棉-ANL,器壁-ANL转化底物的能力有所降低;24 h后,二者催化反应的转化率分别为87.3%和90.4%。可见,脱脂棉-ANL的非水相催化活性更稳定些。而近似条件下,酶粉ANL催化反应24 h后底物转化率仅为36.3%(表 1)。两种固定化酶转化底物的能力都是酶粉的2倍多。说明玻璃和棉纤维都有利于提高酶的催化活性,玻璃壁为极性材料,容易与酶蛋白结合以稳定酶蛋白;脱脂棉为多羟基、大比表面积、柔性强、惰性且与蛋白有兼容性的天然材料[15],这些特性类似水,有助于优化和稳定化酶蛋白。
2.3 溶剂和底物比对反应的影响
合成Vc棕榈酸酯时,为提高合成效果,通常以叔丁(戊)醇或丙酮为溶剂,反应温度定在50 ℃以上[16-17]。在较温和的条件(37 ℃、160 r/min)下,使用2种不同的溶剂,反应24 h,考察溶剂和底物比对反应的影响,结果如表1所示。由表1可知:叔丁醇为溶剂时,脱脂棉-ANL、器壁-ANL催化反应的转化率都较低,皆为18.5%。这可能是叔丁醇的分子结构中含有羟基的原因,虽然经过验证,它不参与反应[18],但可能会干扰反应[10];另外,叔丁醇熔点高,在37 ℃下比较黏稠,没有丙酮流动性好,不利于底物与酶蛋白之间的扩散。尽管Vc在叔丁醇中的溶解度相对较大些,但考虑到它不利于底物的转化,且沸点高,不利于产物的分离和提纯,所以选用丙酮作为溶剂用于合成Vc酯比较理想。
为增大反应的转化率,通常增加棕榈酸的摩尔比例,在Vc和棕榈酸的摩尔比(1∶ 3)~(1∶ 9)范围内,进行酶催化酯化反应[17-19],棕榈酸摩尔比例的增加,虽然一定程度上提高了反应的转化率,但却增加了产物提纯的难度,要把过量的棕榈酸从产物中除去,就会降低产物的总收率。所以,最好能在底物比例为1∶ 1时进行有效的酶催化反应,以便于产物的提纯。当底物比例为1∶ 1,且以丙酮为溶剂,24 h后器壁-ANL和脱脂棉-ANL催化反应的转化率分别为51.8%和62.2%(表 1)。脱脂棉-ANL表现出较好的催化能力。如果适当延长催化反应时间,加入吸水剂[20],增大转化率,产物的提纯只需将溶剂蒸出即可。与ANL在树脂上固定化及催化类似反应体系的研究相比较[21],器壁-ANL和脱脂棉-ANL不仅催化温度低、摇动速度小、催化时间短、溶剂易除去,而且反应转化率明显高于前者(42.1%)。
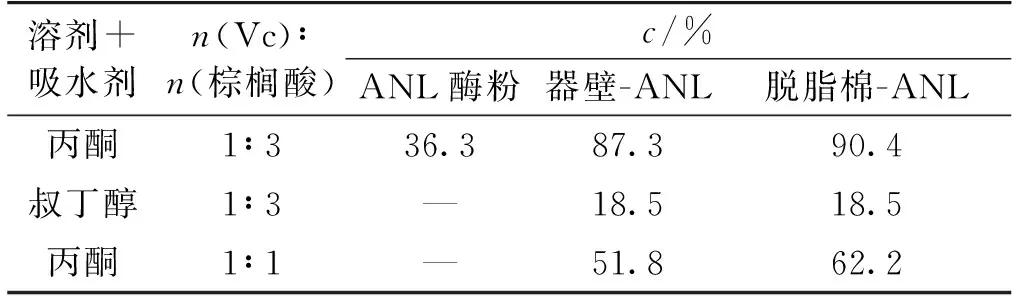
表1 ANL催化反应24 h后的转化率
3 结论
为探索Vc棕榈酸酯的低碳合成及纯化工艺,制备了固定化脂肪酶器壁-ANL和脱脂棉-ANL。以固定化ANL为生物催化剂,Vc和棕榈酸为底物,研究了酶促酯化反应的动力学,并研究了溶剂、吸水剂和底物比例对酶促反应的影响。研究发现:器壁-ANL和脱脂棉-ANL的催化能力大约是ANL酶粉的2倍,丙酮比叔丁醇更适合作为溶剂,脱脂棉-催化反应24 h后的转化率达90.4%。在底物摩尔比例为1∶ 1时,固定化酶仍保持较好的催化活性,24 h后,脱脂棉-ANL可以催化转化62.2%的底物。该结果可以作为今后进行放大实验的基础,在底物摩尔比为1∶ 1时,通过加入吸水剂、适当延长反应时间等,使反应达到足够的转化率,然后通过蒸除溶剂得到较纯净的Vc棕榈酸酯。
