茶黄素双没食子酸酯的酶法合成条件优化与纯化
2018-07-24吴光亮刘新涛曾晓雄
吴光亮,刘新涛,胡 冰,孙 怡,曾晓雄*
(南京农业大学食品科技学院,江苏 南京 210095)
茶作为一种消费量高的饮品,在世界范围内广受人们的喜爱。按照茶叶发酵程度的不同,茶叶可分为3 种类型:绿茶(未发酵茶)、乌龙茶(半发酵茶)和红茶(全发酵茶)[1]。红茶在世界茶叶产量和消费量等方面占据主导地位,研究表明红茶具有抗肿瘤[2]、预防心脑血管疾病[3-4]、预防糖尿病[5]、抗肥胖[6-7]、抗病毒[8]、抗炎症[9]和抗氧化[10-11]等生理功能,这些生理功能和红茶中茶黄素类物质密切相关[12-13]。
茶黄素类物质是在红茶生产过程中儿茶素类物质在多酚氧化酶(polyphenol oxidase,PPO)作用下成对氧化形成的一类二聚体[14],它在红茶中的质量分数为0.5%~2%,是与红茶感官品质和功能性密切相关的主要成分[15-16]。茶黄素类物质主要由4 种茶黄素单体(图1)组成,它们分别为茶黄素(theaflavin,TF1)、茶黄素-3-没食子酸酯(theaflavin-3-O-gallate,TF2A)、茶黄素-3’-没食子酸酯(theaflavin-3’-O-gallate,TF2B)、茶黄素-3,3’-双没食子酸酯(theaflavin-3,3’-O-digallate,TFDG)[17],TFDG为红茶中主要的茶黄素。TFDG是表没食子儿茶素没食子酸酯(epigallatocatechin gallate,EGCG)和表儿茶素没食子酸酯(epicatechin gallate,ECG)的氧化产物[18],但是它在红茶中含量很低,蔡海兰等[19]分析了9 个产区红茶的茶黄素含量,TFDG平均质量分数为0.32%,最低为0.21%,最高为0.54%,这为深入研究和利用TFDG带来了困难,大规模制备高纯度的单体是现阶段亟待解决的问题。
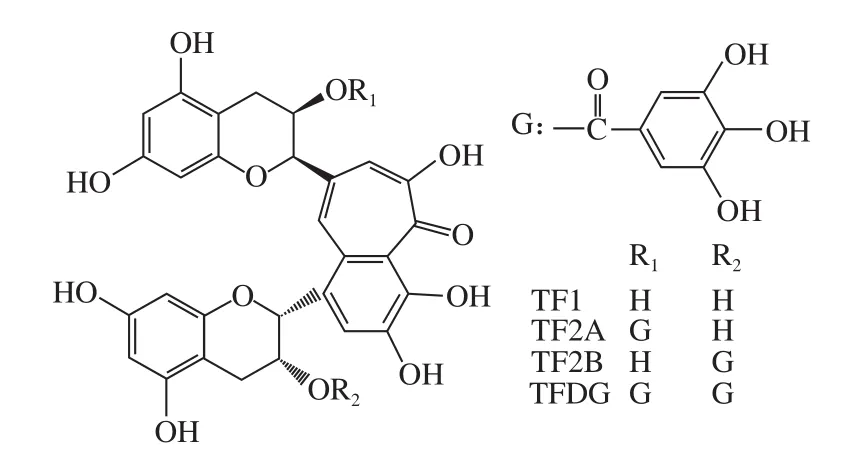
图1 茶黄素的化学结构Fig.1 Chemical structures of theaf l avins
获取茶黄素粗品的方法主要有直接提取法、化学合成法和酶促合成法。酶促合成法指利用PPO在通氧的条件下催化儿茶素合成茶黄素的方法,酶促合成法效率高、安全性好。不同来源的PPO之间活性差异较大,其中梨PPO合成茶黄素的能力较高[20],是理想的PPO来源。茶黄素的分离纯化方法主要有柱层析法[21]、制备型高效液相色谱法和制备型高速逆流色谱(high speed countercurrent chromatography,HSCCC)法[22-23]。为大规模制备TFDG单体,本研究利用单因素试验和响应面法中的Box-Behnken设计优化TFDG合成底物EGCG/ECG物质的量比、pH值和温度等反应条件,并利用AB-8层析柱结合HSCCC从酶促反应液中纯化TFDG单体。
1 材料与方法
1.1 材料与试剂
皇冠梨(Pyrus bretschneideri Rehd cv. Huangguan)南京市苏果超市;EGCG、ECG 成都普瑞法科技开发有限公司;不溶性聚乙烯吡咯烷酮(polyvinyl pynrolidone,P V P P) 北京市索莱宝生物科技有限公司;乙腈、乙酸乙酯(色谱级) 美国Sigma公司;其他试剂均为分析纯,实验用水为超纯水。
1.2 仪器与设备
1100高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent公司;5C18-AR-II(250 mm×4.6 mm,5 μm)色谱柱 日本Cosmosil公司;BL-220H分析天平 日本Shimadzu公司;EYELA旋转蒸发仪 日本东京理化公司;LyoQuest-55真空冷冻干燥机 西班牙Telstar公司;CJJ78-1磁力加热搅拌器 金坛市大地自动化仪器厂。
1.3 方法
1.3.1 PPO粗酶液的制备
参考李健等[24]方法并稍作修改。称取100 g去皮后的皇冠梨切成碎块,加入适量PVPP、VC和预冷的柠檬酸-磷酸盐缓冲液(pH 5.6)100 mL,捣碎,4 ℃、10 000 r/min离心15 min,取上清液。往上清液中缓慢均匀加入硫酸铵粉末,制成70%硫酸铵饱和度的溶液,粗酶液制备操作在冰浴中进行,所得溶液4 ℃冰箱中过夜,10 000 r/min离心10 min,沉淀以适量pH 5.6柠檬酸-磷酸盐缓冲液溶解,即为PPO粗酶液。
1.3.2 PPO催化儿茶素合成TFDG的条件优化
按一定的EGCG/ECG物质的量比称取EGCG和ECG,加入到50 mL一定pH值的柠檬酸-磷酸盐缓冲液中,使得ECG终浓度为10 mmol/L,加入1 mL PPO,于一定温度120 r/min磁力搅拌下进行酶促反应,HPLC分析反应液中各个组分含量。TFDG产率计算见下式:
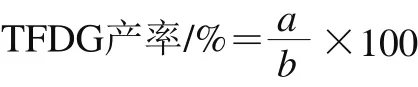
式中:a为TFDG合成的物质的量;b为加入的ECG物质的量。
1.3.2.1 单因素试验
选择EGCG/ECG物质的量比、pH值和温度3 个单因素分别进行单因素试验。固定pH 4.5、反应温度30 ℃,探究EGCG/ECG物质的量比(1∶1、3∶1、4.5∶1、6∶1、9∶1)对TFDG产率的影响。固定EGCG/ECG物质的量比3∶1、反应温度30 ℃,探究pH值(3.0、4.0、4.5、5.0、5.5、6.0、6.5、7.0)对TFDG产率的影响。固定EGCG/ECG物质的量比3∶1、pH 4.5,探究温度(15、25、35、45、55 ℃)对TFDG产率的影响。
1.3.2.2 响应面试验
利用单因素试验确定的水平范围,应用Design-Expert 8.0.6软件设计3因素3水平的响应面试验并确定PPO催化合成TFDG的最佳试验条件。响应面试验因素与水平见表1。
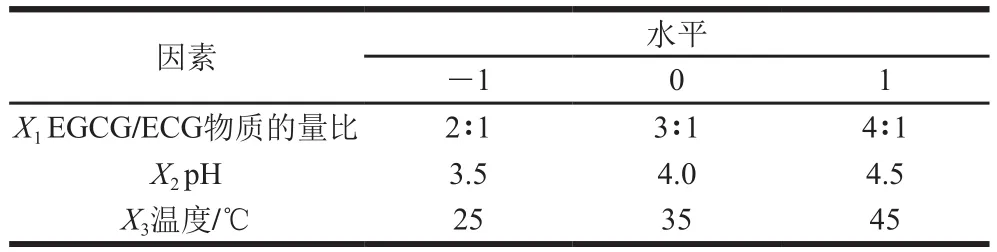
表1 Box-Behnken试验设计因素及水平Table1 Level and code of factors used for Box-Behnken design
1.3.3 HPLC分析
方法1:参考薛金金[25]方法,HPLC分析采用Agilent液相色谱仪,色谱柱:5C18-AR-II(250 mm×4.6 mm,5 μm);柱温:40 ℃;进样量:20 μL;检测波长:280 nm;流动相:A:50 mmol/L磷酸;B:乙腈;流速:0.7 mL/min;梯度洗脱程序:0~39 min,96%~70% A相;39~54 min,70%~25% A相。
在方法1基础上稍作修改得方法2:H P L C分析采用Agilent液相色谱仪,色谱柱:5C18-AR-II(250 mm×4.6 mm,5 μm);柱温:40 ℃;进样量:20 μL;检测波长:280 nm;流动相:A:50 mmol/L磷酸;B:乙腈-乙酸乙酯(7∶1,V/V);流速:1.0 mL/min;洗脱程序:0~25 min,82%~68% A相。
1.3.4 TFDG单体的纯化
以最优EGCG/ECG物质的量比、pH值及温度条件下酶法合成TFDG,反应60 min后置于沸水浴5 min灭酶以终止酶促反应,随后将反应液上样于AB-8层析柱,先用1 个柱体积(BV)的水洗脱层析柱,除去反应液中的蛋白等杂质,再用2 BV的90%乙醇溶液洗脱层析柱,收集乙醇洗脱液并浓缩冻干,得TFDG粗品。
参照江和源等[26]方法利用HSCCC从TFDG粗品中纯化TFDG单体。配制水-乙酸乙酯-正己烷-甲醇(6∶3∶1∶1,V/V)的两相溶剂体系,将其充分混合后,静置分层,上相作为固定相,下相作为流动相;称取适量的TFDG粗提物,加入15 mL上相溶解并上样于HSCCC仪,转速:800 r/min,流速:2.0 mL/min,检测波长:280 nm,温度:25 ℃,流出液部分收集器收集利用HPLC检测,将TFDG组分合并浓缩冻干,即为TFDG单体。
2 结果与分析
2.1 生成TFDG的HPLC检测结果
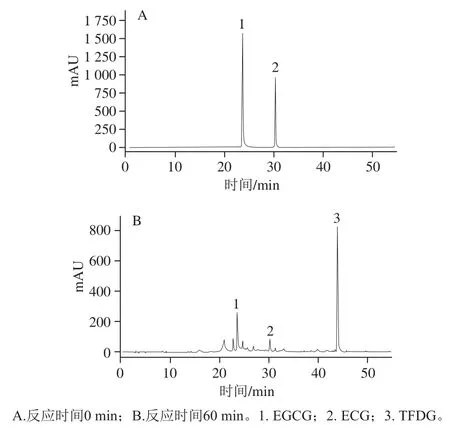
图2 黄冠梨PPO合成TFDG的HPLC图Fig.2 HPLC chromatograms of reaction mixtures during TFDG synthesis mediated by PPO from Huangguan pear
如图2所示,梨PPO可以催化EGCG和ECG合成TFDG,经过60 min的反应,大部分EGCG和ECG转化为TFDG,这说明梨PPO具有较好的合成TFDG能力。因此,本研究以TFDG产率高低作为评价标准,探讨PPO催化EGCG和ECG合成TFDG的最适EGCG/ECG物质的量比、pH值和反应温度。
2.2 单因素试验结果
2.2.1 EGCG/ECG物质的量比对合成TFDG的影响
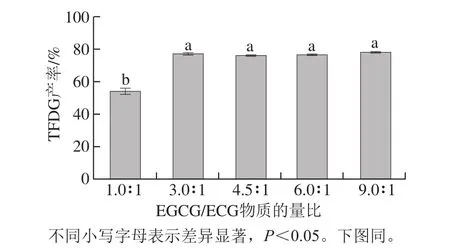
图3 EGCG/ECG物质的量比对梨PPO合成TFDG的影响Fig.3 Effect of EGCG/ECG molar ratio on the synthesis of TFDG
TFDG的生成过程为EGCG和ECG生成相应的醌和;相应的醌再等量结合生成TFDG。据文献[27]报道,反应体系中EGCG可能会被酶氧化所消耗,使得EGCG产生的醌不足以和ECG产生的醌相结合;且EGCG容易被ECG产生的醌氧化,导致EGCG的量进一步减少,因此需提高反应体系中EGCG/ECG物质的量比。由图3可知,以EGCG和ECG作为底物合成TFDG时,EGCG和ECG的物质的量比对TFDG产率影响较大。EGCG/ECG物质的量比为1∶1时,EGCG产生的醌不足以和ECG产生的醌相结合,TFDG的产率为54.1%;但是EGCG/ECG物质的量比为3∶1时,EGCG产生的醌足以和ECG产生的醌相结合,TFDG的产率可大幅度提高到77.3%,随着底物物质的量比例的升高,TFDG的产率并未明显提高。为节约儿茶素同时保证TFDG产率,设定EGCG/ECG物质的量比为3∶1作为响应面试验的中心点。
2.2.2 反应pH值对合成TFDG的影响
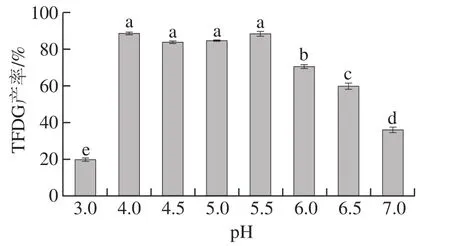
图4 反应pH值对梨PPO合成TFDG的影响Fig.4 Effect of reaction pH on the synthesis of TFDG
TFDG在碱性条件下不稳定,且PPO活性受pH值影响较大,可见反应pH值对于TFDG产率有着重要影响。由图4可知,当pH值为3.0时,酶活力在该pH值条件下比较低,导致TFDG的产率仅为22.7%;pH值在4.0~5.5范围时,TFDG产率为80%~87%;当pH值升高到6.0~7.0时,TFDG产率急剧下降至35.5%,推测pH值升高使得PPO活力下降,且TFDG在碱性条件下不稳定。根据单因素试验结果,选取pH 4.0作为响应面试验的中心点。
2.2.3 反应温度对合成TFDG的影响
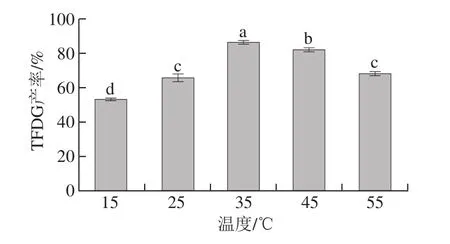
图5 反应温度对梨PPO合成TFDG的影响Fig.5 Effect of reaction temperatures on the synthesis of TFDG
温度对酶促反应的影响表现在2 个方面:一方面是温度升高,酶促反应速度加快;另外一方面温度升高,酶的高级结构发生变化导致酶活性降低甚至失去。从图5可以看出,温度升高到35 ℃,TFDG的产率随着温度的升高而增加,在35 ℃左右TFDG产率达到峰值,随后开始下降。由此,选择35 ℃作为响应面试验的中心点。
2.3 响应面试验结果与分析
通过响应面法对EGCG/ECG物质的量比(X1)、pH值(X2)和反应温度(X3)3 个因素的优化设计及结果见表2。
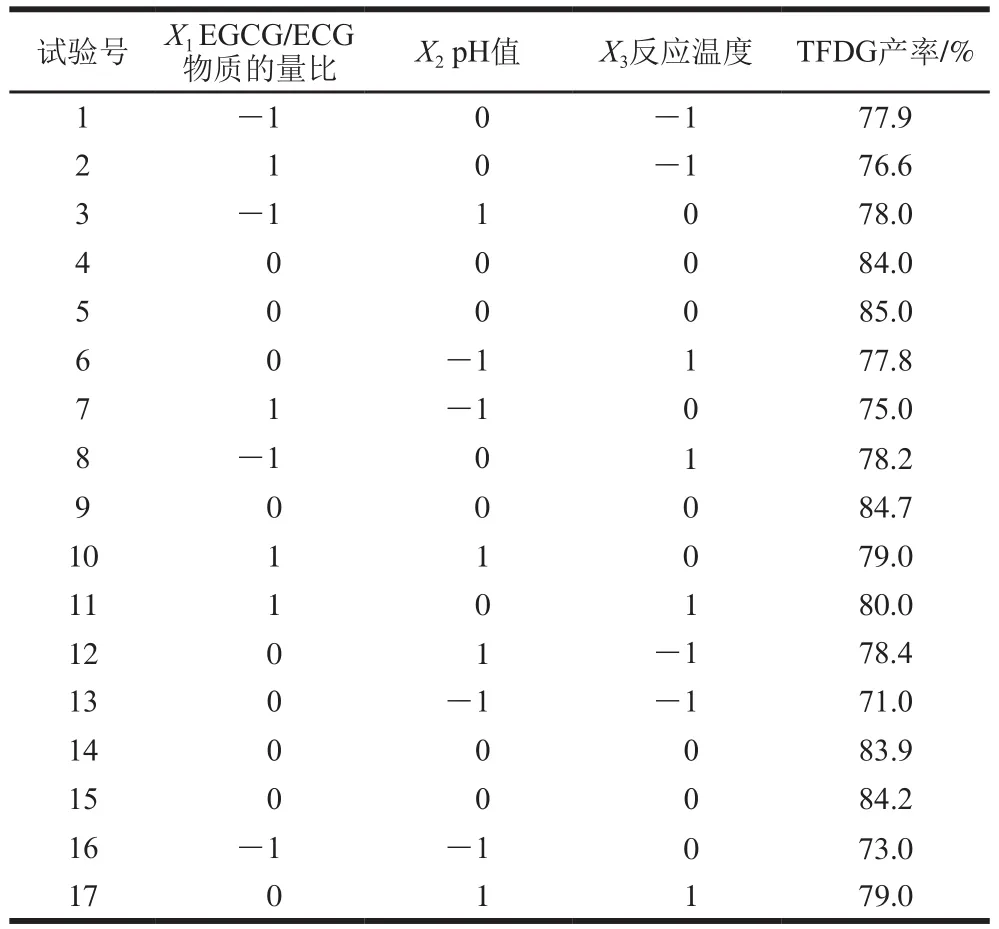
表2 响应面试验设计及结果Table2 Experimental design and results for response surface analysis
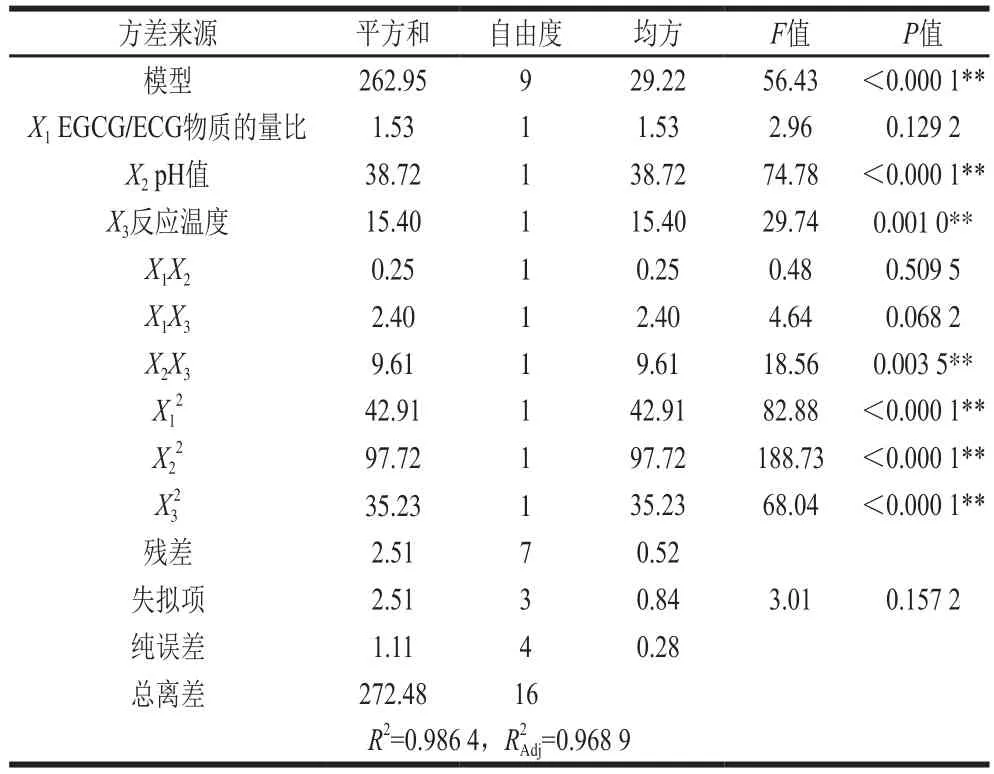
表3 多元回归模型方差分析Table3 Analysis of variance for the quadratic polynomial model
通过Design-Expert 8.0.6软件对表2的数据进行分析,得到方差分析结果如表3所示。由表3可知,p H值和温度对T F D G得率的影响极显著(P<0.01)。以TFDG得率作为响应值,经过拟合后得回归方程:TFGD产率=84.26+0.44X1+2.20X2+1.39X3-0.25X1X2+0.78X1X3-1.55X2X3-3.19X12-4.82X22-2.89X32。
回归模型的F值较高(6 7.4 6),P值较低(<0.000 1),说明模型极显著。该模型的决定系数R2值为0.986 4,表明TFDG产率的实验值和预测值间的一致性良好;调整系数值为0.968 9,说明TFDG产率总变异中的96.89%由独立变量决定,所研究的因素中只有3.11%不能被此回归模型解释。此外还可得出独立变量对TFDG产率的影响次序为pH值>反应温度>EGCG/ECG物质的量比。
由图6可以直观地看出,各因素交互作用对TFDG产率的影响,若曲线越陡峭,表明各因素对得率的影响越大[28];2D图形状可以说明因素间的交互作用显著与否,若等高线是圆形,说明交互作用不显著,若为椭圆,则显著[29]。pH值和反应温度对TFDG产率的影响作用较大,两者交互作用显著,这与表3结果吻合。
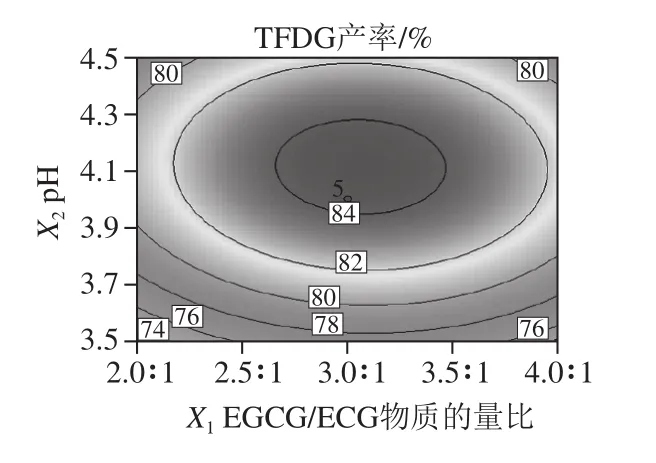
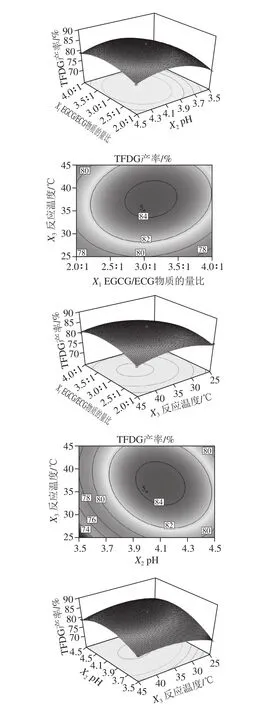
图6 多元回归模型响应面图和等高线图Fig.6 Response surface and contour plots for the quadratic polynomial model
通过软件分析确定PPO催化合成TFDG的最佳条件为EGCG/ECG物质的量比为3.08∶1、pH 4.10、温度36.96℃,在此条件下计算得出的TFDG产率理论值为84.63%。为方便实验进行选取EGCG/ECG物质的量比3.1∶1、pH 4.10、温度37 ℃进行验证实验,得到TFDG产率为(85.14±0.40)%,实验值与预测值一致性较好。说明该多元二次回归方程可靠性较好,适合对TFDG产率的预测。
2.4 TFDG单体的纯化结果
大孔吸附树脂多用于黄酮类、生物碱类和苷类等成分的分离纯化,具有吸附量大、选择性好、再生简单和成本低等优点。郁军等[30]研究了NKA-9、AB-8和ADS-73 种不同极性的大孔吸附纯化茶黄素的工艺条件,结果发现ADS-7的纯化效果最差,NKA-9较AB-8有更高的解吸率,但是两者差别不大。本实验使用AB-8树脂对酶法合成的TFDG进行纯化,以除去反应液中的蛋白等杂质。同时,HSCCC是无载体的分离,所以不存在载体的吸附,样品利用率高,HSCCC最大的优点在于进样量大,因而在生物医药、天然产物及食品领域被广泛利用。本研究先用AB-8树脂对酶促反应反应液进行纯化得到TFDG粗品,再利用HSCCC纯化粗中的TFDG单体。
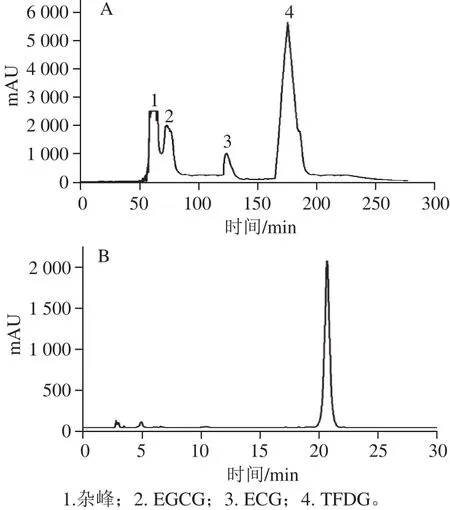
图7 HSCCC纯化TFDG粗提物色谱图(A)、TFDG单体的HPLC图(B)Fig.7 HSCCC chromatogram of crude TFDG (A) and HPLC of monomeric TFDG (B)
图7A为HSCCC纯化TFDG的色谱图,经HPLC分析2号和3号峰分别为EGCG和ECG,4号峰为TFDG(图7B),TFDG的纯度可达到97%,说明该方法能够高效地从TFDG的粗提物中纯化出高纯度的TFDG单体。
3 结 论
通过单因素试验探讨了物质的量比(EGCG/ECG)、pH值和反应温度对皇冠梨PPO催化EGCG和ECG合成TFDG的影响,利用Box-Behnken试验优化得出最佳底物物质的量比(EGCG/ECG)3.1∶1、pH 4.1、反应温度37 ℃;利用AB-8层析柱结合HSCCC对最优反应条件下合成的TFDG反应液进行纯化,TFDG产率和纯度分别能达到85.14%和97%;实验表明该方法对TF1、TF2A和TF2B的制备同样适用,因此本研究为高效率制备各茶黄素单体提供了参考依据。
